[导读] 编译整理:强子
子宫内膜浆液性癌仅占子宫内膜癌的10%左右,但其恶性程度却相对较高。目前精准治疗大行其道的情况下,对这一肿瘤进行靶向治疗的需求也逐渐增加。其实上世纪九十年代中期已有子宫内膜癌中抗HER2治疗的相关研究,但由于缺乏标准化及评分方案,因此文献中子宫内膜癌HER2蛋白过表达的比例差异较大,自14%至80%不等;即使FISH检测的HER2基因扩增比例也自21%至47%不等。此外,相关研究中几乎包括了所有组织学类型的子宫内膜癌、具体如低级别子宫内膜样癌。相关的临床案例、临床实验也有诸多的不足之处。
近日,美国耶鲁大学医学院病理专家Buza在美国病理学家协会(College of American Pathologists,CAP)官方期刊《Archives of Pathology & Laboratory Medicine》撰文,就子宫内膜浆液性癌中HER2检测的部分问题做了综述。为帮助大家更好的了解这一问题并尽量达到检测和报告的标准化,我们将该文要点编译介绍如下。
最新的多机构、随机二期临床实验表明,HER2阳性子宫内膜浆液性癌治疗方案中加入曲妥珠单抗,可以延长进展期病变的无进展生存期近9个月,延长复发性病变的无进展生存期3.2个月;对总生存率的评估正在进行中。有鉴于此,NCCN子宫肿瘤指南支持对HER2阳性、进展期或复发性子宫内膜浆液性癌标准化疗方案中加入曲妥珠单抗。也正是因为这样的大背景下,子宫内膜浆液性癌中HER2检测的临床需求显著增加。
目前已经明确,不同器官系统肿瘤中的HER2蛋白表达、基因扩增特点也有所不同;子宫内膜浆液性癌中HER2蛋白表达、基因扩增特点也已有系统评估。需要注意的是,免疫组化层面,50%以上的HER2阳性肿瘤中可见HER2蛋白表达的肿瘤内异质性,而这一点与大部分病例中FISH检测时HER2基因扩增呈簇状、异质性结果相对应。这里的免疫组化肿瘤内异质性是指至少50%的肿瘤细胞、染色强度具有至少两个级别的差异。此外,约75%的HER2阳性肿瘤并无顶端膜着色,而是呈基底/侧方膜着色,类似胃腺癌。就膜强阳性细胞比例的阈值来说,30%要比10%时的免疫组化-FISH结果一致性更好。

图1. 子宫内膜浆液性癌中的HER2免疫组化:(A)3+:30%以上的肿瘤细胞细胞膜呈完整的强阳性;(B)2+:≥10%的肿瘤细胞在基底侧呈弱至中等的膜着色。

图2. 子宫内膜浆液性癌中的HER2免疫组化,图示瘤内异质性。
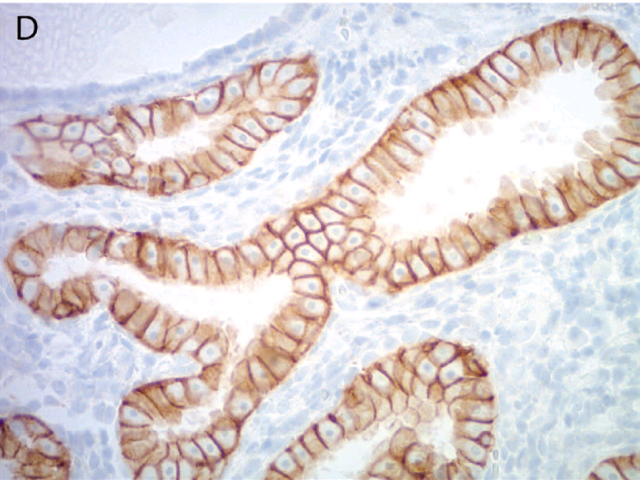
图3. 子宫内膜浆液性癌HER2免疫组化中,一般并无顶端膜的着色。
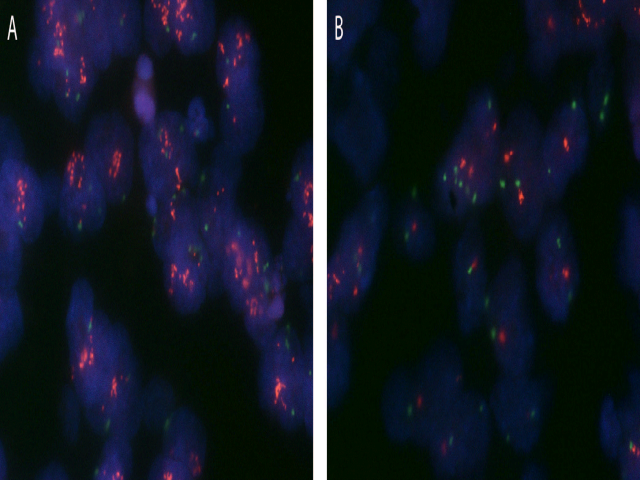
图4. 子宫内膜浆液性癌HER2的FISH检测中也有瘤内异质性的体现,如本例中,(A)一簇肿瘤细胞呈“簇状”扩增表现,HER2/CEP17比例为7.14;而背景中可见非扩增表现的肿瘤细胞(B,HER2/CEP17比例为1.25)。
对于纳入临床研究的病例来说,首先应对肿瘤切片进行复阅,证实是否为浆液性癌,然后再进行HER2免疫组化检测。如30%以上的肿瘤细胞呈膜完整着色、或侧方/基底侧膜着色,则评为3+;如呈膜完整着色、或侧方/基底侧膜着色肿瘤细胞的比例≤30%,或≥10%的肿瘤细胞呈弱至中等程度着色,则评为2+。仅对于免疫组化2+的情况进行FISH检测进一步明确HER2扩增情况,HER2/CEP17比值≥2.0则考虑为有扩增。
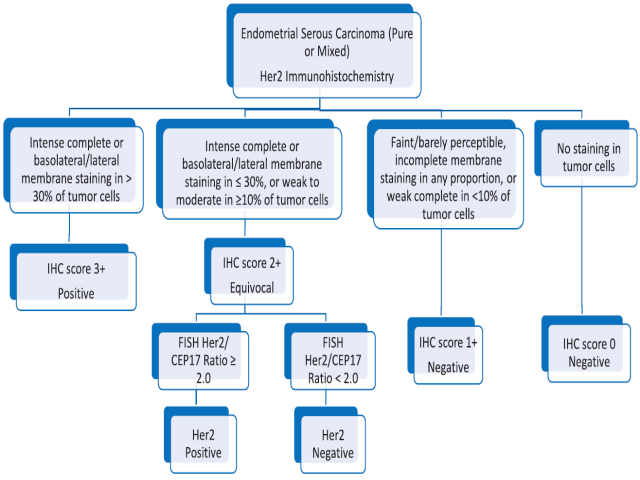
图5. 根据临床实验的纳入标准所提出的子宫内膜浆液性癌HER2检测方案。
展望
针对子宫内膜浆液性癌HER2检测问题,仍有诸多问题有待解决。具体如HER2检测的最适宜标本是活检、还是子宫全切?活检标本中的结果是否应在子宫全切标本中进一步检测、对比?原发灶和转移灶中相关结果是否一致?此外还需进一步临床病理研究确定肿瘤内异质性的相关影响,并确定相关异质性对治疗效果的影响。
此外,随着相关临床需求的增加,目前病理也应关注相关因素对子宫内膜浆液性癌HER2检测的影响,具体如标本处理和固定、冷缺血的时间、组织块的选择等。
点击下载英文文献
参考文献
Buza N. HER2 Testing in Endometrial Serous Carcinoma. Arch Pathol Lab Med. 2020;10.5858/arpa.2020-0207-RA.
doi:10.5858/arpa.2020-0207-RA


















共0条评论