病例9 卵巢黏液性癌
(Mucinous Carcinoma of the Ovary)
【病例介绍】
患者,女,66岁;患者因“下腹部隐痛不适3月余”就诊,发现右侧卵巢囊肿;行右侧卵巢肿瘤及输卵管切除术。
【病理变化】
(1)巨检 灰白灰红色结节状包块1枚,14cm×2cm×9cm上附输卵管1条,长5cm,直径0.3cm,切开包块呈囊性,内含咖啡色粘稠液体,囊壁厚0.1cm~0.2cm,见两处增厚区,一处4cm×3cm,厚约1cm,另一处3cm×1cm×0.4cm,呈结节状突起。
(2)镜检 低倍镜示囊壁复杂的乳头状结构,部分区域腺体背靠背、无间质支持,部分区域腺体融合呈迷宫样结构,局部可见浸润性成分,囊腔壁及腺体内部可见粉红淡染的黏液样物质及散在分布的肿瘤细胞、细胞簇,(图1-A至图1-B)。图1-C和图1-D局部放大进一步显示上述结构特征。高倍镜示肿瘤细胞排列呈复层且极性紊乱,部分区域呈小的实性片状或筛状结构;肿瘤细胞界限不清,胞浆嗜酸红染,部分区域可见杯状细胞;细胞核大小、形状不一,部分细胞核深染,部分细胞核呈泡状、核仁明显,可见核分裂象(图1-E、图1-F)。
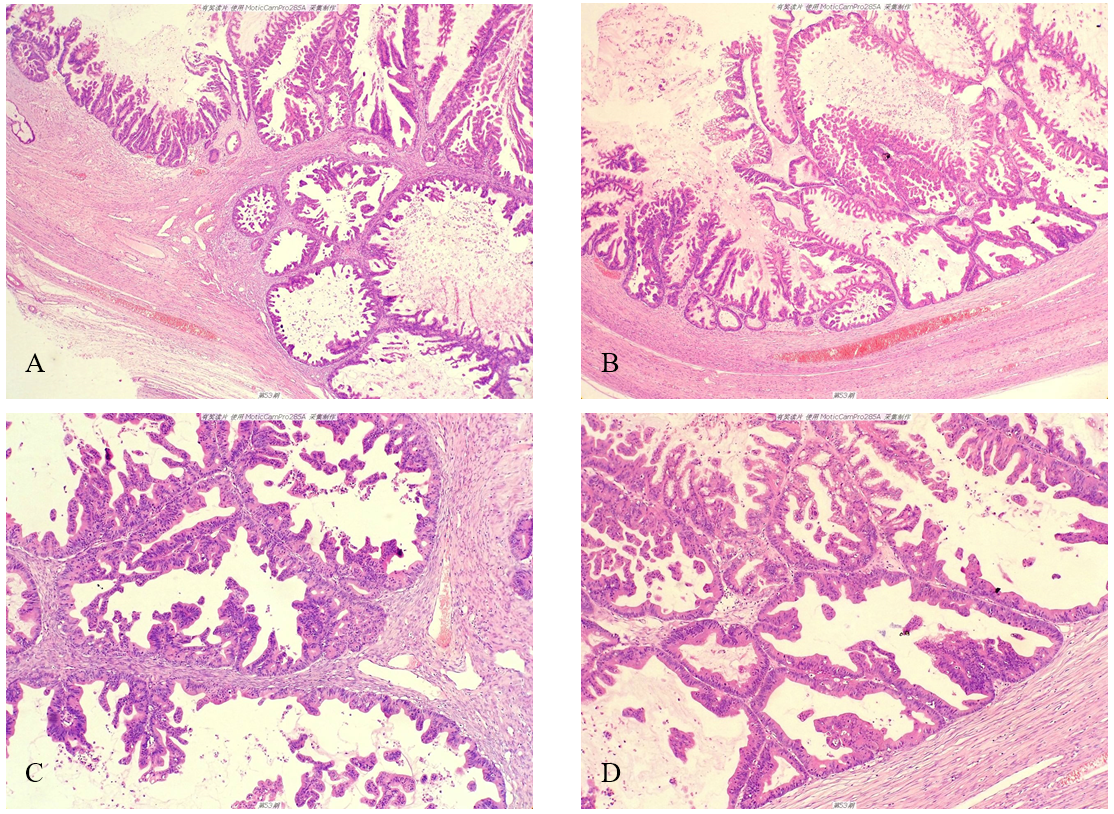
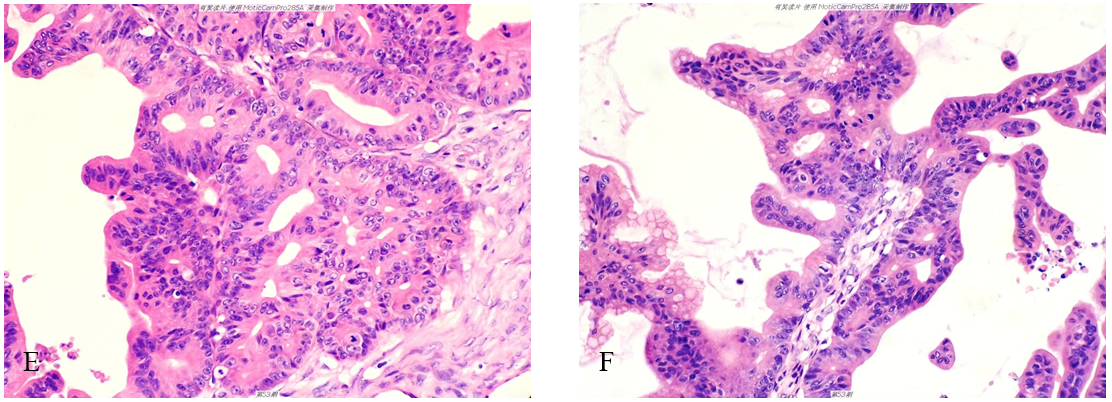
图1卵巢黏液腺癌。图1-A至图1-D示囊壁复杂的乳头状结构,部分区域腺体背靠背、无间质支持,部分区域腺体融合呈迷宫样结构,局部可见浸润性成分;图1-E和图1-F示肿瘤细胞界限不清,胞浆嗜酸红染,部分细胞核深染,部分细胞核呈泡状、核仁明显。
(3)免疫组化 CA125(-),CEA(+),CK7(+),CK20(-),EMA(+),ER(-),PR(-),Ki67(+),P53(+)。
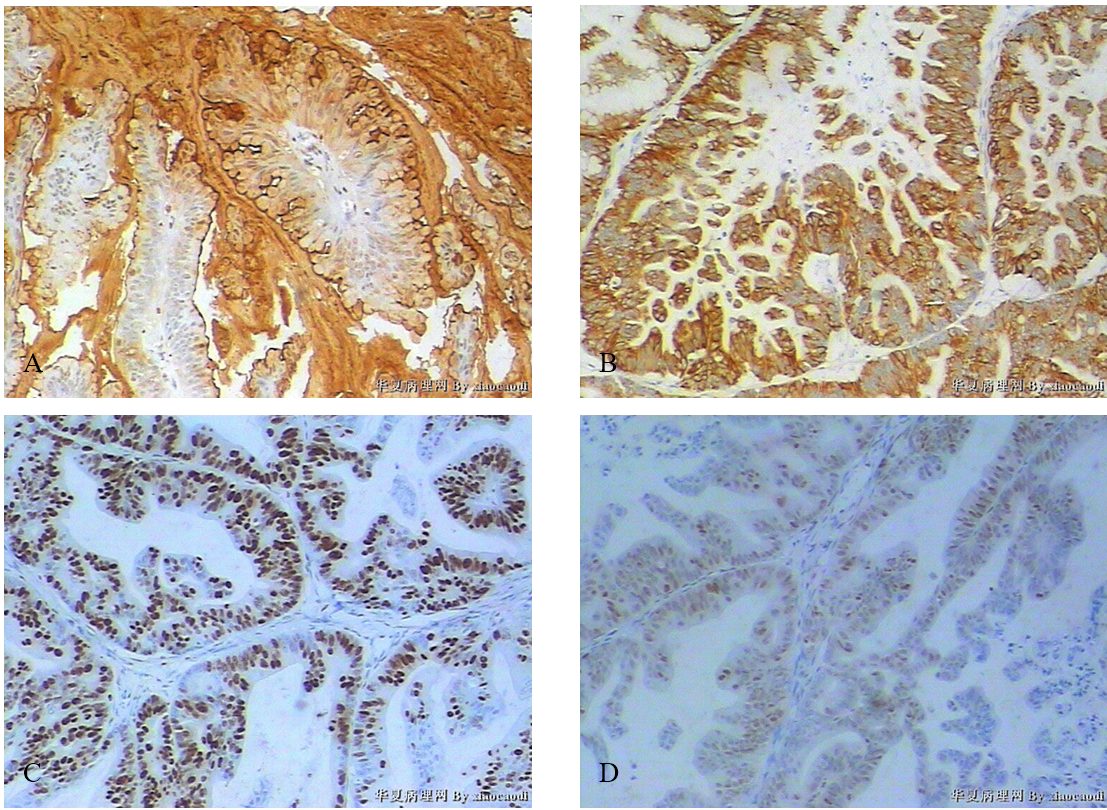
图2 卵巢黏液腺癌免疫组织化学。A示CEA(+),B示CK7(+),C示Ki-67(+),D示p53(+)。
【讨论】
卵巢黏液性肿瘤(ovarian mucinous tumors,OMTs)是由来源于卵巢表面上皮、部分或全部含有细胞内黏液的肿瘤细胞组成的一类较常见的肿瘤,肿瘤细胞与子宫颈内膜上皮细胞(宫颈内膜样型)或胃肠上皮细胞(肠型)相似,包括良性黏液性肿瘤(囊腺瘤)、非典型增生性黏液性肿瘤(APMT,也称作交界性或低度恶性潜能的肿瘤)和黏液性癌(上皮内癌和浸润性癌)。黏液性肿瘤约占卵巢肿瘤的12%~15%,其中良性约占80%,其余大部分为交界性,黏液性腺癌仅占原发性卵巢癌的3~4%[1]。2014年WHO女性生殖器官肿瘤分类将黏液性腺癌定义为“由含有细胞内粘液的胃肠型细胞组成的一种恶性上皮性肿瘤”,其ICO-D编码为8480/3[2]。
原发性卵巢黏液性癌患者多为40~70岁女性(平均年龄45岁),临床表现主要为腹部肿块或疼痛,血清CEA、CA199、CA72.4相对于CA125更加敏感。肿瘤伴有间质黄素化患者可出现内分泌症状,如阴道出血、闭经甚至男性化等。绝大多数黏液腺癌为临床I期,即局限于卵巢[1]。
原发性卵巢黏液性癌的大体表现与交界性黏液性肿瘤类似,体积较大,平均直径18~22cm,多为单侧性,肿瘤表面光滑,切面囊性、多房,内含黏液,常可见乳头状突起,也可见灰白实性区以及灶性出血、坏死区。
卵巢原发性黏液性癌的上皮细胞可为肠型或宫颈内膜样型,但是绝大多数为肠型上皮(如本例),结构上其通常分化良好,上皮显示明显的肠型分化,并可见各种腺管状结构,癌旁经常可见APMT区域。目前按侵犯间质的方式将其分为浸润型和膨胀(浸润)型,而本例属于膨胀(浸润)型,表现为恶性腺体拥挤、复杂,没有间质支持,腺体背靠背,相互融合形成筛状、迷宫样结构。对于以交界性为主要成分的肿瘤,呈融合性生长的区域应大于诊断“微浸”的上限,即直径>5mm或面积>10mm2(或2个直径限超过3mm),目前多采用5mm为标准[1]。卵巢黏液性肿瘤常伴发一些附壁结节,一些恶性的结节通常为未分化癌,但是也有各种类型肉瘤的报道,McFarland M等[3]报道了1例卵巢肠型黏液性癌和1例肠型交界性黏液性肿瘤伴发附壁结节的骨肉瘤。
卵巢原发性黏液性癌呈CK7弥漫阳性,CK20有不同程度的表达,可以表达CDX2(核染色),p16有灶状表达,不表达ER、PR、CA125。Wang J等[4]研究显示,黏液性肿瘤通常MUC5AC+/MUC1-,与胰腺、胆管、食管、胃、结(直)肠以及阑尾来源的癌不同。有研究显示,PAUF(Pancreatic adenocarcinoma up-regulated factor)在黏液性腺癌中的表达较良性和交界性病变中要高,其可以为组织病理学分类的一个比较实用的生物学标记,并且可以作为卵巢黏液性肿瘤的一个预后指标[7];另有研究显示,HER2在原发性卵巢黏液性癌中的过表达与其膨胀性(非浸润性)侵入形式和良好的预后相关,其也可以为组织病理学分类的一个生物学标记,并且可以作为卵巢黏液性癌的一个预后指标[9]。
卵巢原发性黏液性癌主要与转移性黏液性癌鉴别,转移性黏液性癌多为双侧性,体积较小,累及卵巢表面,卵巢肿瘤呈结节状,在间质中杂乱无章的浸润,另外免疫组化可以帮助鉴别诊断。P JG等[8]报道1例原发性卵巢黏液性癌伴印戒细胞,注意与伴有印戒细胞的肿瘤相鉴别。
以膨胀性浸润为主的卵巢原发性黏液性癌患者的生存率约为90%,较破坏性浸润预后好。与其他类型的卵巢癌一样,铂类-紫杉醇是治疗黏液性癌的标准方案。Missaoui N等[5]一篇在北非的研究报道显示,HER2过表达的卵巢黏液性癌患者可以选择曲妥珠单抗治疗。Lee JY等[6]研究显示,仅限于卵巢的原发性黏液性癌可以选择保育手术,其与复发和死亡率的增加不相关。
【回帖精选】
1、雅马哈(18楼)回复:
卵巢黏液性肿瘤是临床病理工作中最难棘手的问题,卵巢黏液性肿瘤可以存在灶状病变,在同一肿瘤中可以同时存在明确的良性、交界性和恶性,并且可以是局灶性的。取材不仔细便容易造成漏诊。
卵巢黏液性肿瘤侵袭方式主要有经典的浸润性间质浸润和新近认识的扩张性侵袭。浸润性侵袭---肿瘤组织突破基底膜侵入间质,常常引起间质的纤维组织增生性反应;。扩张性侵袭---是指恶性腺体在固有组织中极度内生性和外生性生长的结果,具体表现为以下四种形态:①迷宫样结构:是多个复杂迂曲的腺体互相交织,不易分解为独立单位的一种三维结构;这些增生的腺体往往成片,同时排斥周围间质使其消失;②筛状结构:是一种腺体融合现象,即腺体共壁;③绒毛巨腺型结构:大腺体增生,是腺腔增大巨腺体内含有复杂的多级分支的绒毛状结构;④广泛的外生性乳头状结构:包括向表面生长的和巨腺腔、腺囊内具有纤维血管轴心的分支状乳头(扩张性侵袭的标准尚需进一步统一)。
经上述分析,此例没有出现经典的浸润性间质浸润,局部小灶可疑出现扩张性侵袭(主要是绒毛巨腺型结构)。组织学上主要表现为:囊腔内衬黏液性柱状上皮细胞,呈复层排列,其中可见到较多杯状细胞,部分区域囊腔内衬上皮细胞呈恶性,并形成乳头状及筛孔状结构,细胞呈复层排列,局部可达更多层,并可见到核分裂像。
形态支持卵巢交界性黏液性囊腺瘤伴上皮内癌。
现在认为伴有微浸润的黏液性肿瘤也属于交界性范畴,这些肿瘤可以出现在交界性肿瘤的背景中,间质有单灶或多灶浸润。WHO分类规定微侵袭范围为单个浸润灶<3mm,多个浸润灶不累加计算。伴有微浸润的黏液性交界性肿瘤的预后与没有微浸润的交界性肿瘤无显著差异。但是必须明确的是不管是那种侵袭形式,超过微侵袭的范围都应该诊断为黏液腺癌。
免疫组化对诊断没有太大的帮助,必要时可以染:Alcion蓝染色、AE/AE3、CK20、CK7
鉴别:(1)需要鉴别的就是卵巢黏液腺癌:鉴别要点就是对“扩张性侵袭”的把握程度及准确度;(2)至于消化道转移的此例组织学特点不符合,但是某些卵巢转移性腺癌可以极其类似于普通的交界性肿瘤,也不得不考虑在内。
2、huna(28楼)回复:
Mucinous intestinal cystadenoma of borderline maligancy.The tumor is a large ,cystic and mucus-filled mass. Irregular glands are lined by tall columnar epithelium that resembles intestinal epithelium.Such tumors differ from benign cystadenomas in that they show more nuclear unrest ,atypia ,and focal invasion .
【提供者单位及姓名】安徽省合肥市妇幼保健院 解正新(城北)
【专家点评-刘从容老师】
1、本例肿瘤细胞内可见黏液滴,故是黏液性肿瘤。
2、 对于卵巢黏液性肿瘤,最首要的问题是判断“原发还是转移”?本例为单侧发生,直径14厘米(双侧发生直径小于10厘米的卵巢黏液肿瘤90%为转移性),以膨胀性生长方式为主,腺腔内可见多量嗜酸性细胞坏死碎片,上述形态特点均提示“卵巢原发性黏液性肿瘤可能性大“。但必须强调的是,根据最新文献提示,经过严格的鉴别诊断和随访后,卵巢真正原发的黏液腺癌仅占上皮性卵巢癌的不到3%。故切记的是卵巢原发黏液腺癌其实是一种相对少见的肿瘤,过去有很多转移性腺癌(主要来自消化道和消化腺)没有能够被准确地鉴别出来,而某些转移性腺癌在形态上与呈交界性黏液性肿瘤样表现。因此,本例应在术中和术后提醒临床探查,并借助影像学除外消化道和消化腺的肿瘤。此外,应该关注是否有卵巢表面累及(如有,提示转移);为弥漫性生长还是多结节状生长(多结节着提示转移);是否有卵巢外累及(如有,尤其是伴腹膜假黏液瘤者提示转移);同时建议加染下列组化指标,虽然它们的特异性不高(尤其是对于来自胆道和胰腺的转移性黏液腺癌鉴别能力非常有限),但可在某种程度上协助鉴别诊断。
| CK7 | CK20 | CEA | Vim | CA125 | MUC5AC | MUC2 | PAX8 |
原发性 | + | - | - | + | + | + | - | + |
转移性 | - | + | + | - | - | - | + | - |
3、 如果经过上述小心验证后,依然支持为卵巢原发性黏液性肿瘤,那么接下来的问题就是诊断“交界性”还是“黏液腺癌”。卵巢原发性黏液腺癌的一大特点就是,大部分以膨胀性浸润方式为主,仅少量可伴侵袭性浸润方式。所谓膨胀性浸润的黏液腺癌诊断标准如下:“1)腺体背靠背/相互融合的复杂腺体;2)间质无/非常稀少;3)面积>10mm2/两个直径均>3mm”。根据出片单位提供的图片,前两种标准已经符合,唯一需要确认的是面积是否已经达到标准。不过,根据多张图片中均可见这种膨胀性生长方式,相信面积已经达到上述标准。故如果上述推测均成立,本例似乎更应该诊断为卵巢原发性黏液腺癌,以膨胀性浸润方式为主,灶状(图2,图5, 图10)可见侵袭性浸润生长方式。根据文献报道,卵巢黏液腺癌的预后与生长方式高度相关,以膨胀性浸润为主者(五年生存率90%)预后要远远好于以侵袭性浸润方式为主者(五年生存率50%)。
4、如果膨胀性生长区域的面积没有达到癌的标准,则考虑到图2,图5, 图10中可见浸润性生长方式,但面积似乎很小(需要面积<10mm2, 或直径<3mm),图16,20,21内上皮具有重度异型性,且细胞层次超过了4层,但似乎面积不大(需要面积<10mm2, 或直径<3mm),故本例可诊断“卵巢交界性黏液性肿瘤,伴据灶上皮内癌和微小浸润。”由于目前认为上皮内癌和微小浸润均不影响预后,故本例患者的预后会非常好,5年生存率几乎为100%。
5、综上,本例所提供的临床信息和病理信息不够,不足以给出确切的诊断。目前只能给出如下几种可能性,并依据可能性的大小排序如下:
1) 卵巢原发性黏液腺癌,以膨胀性浸润方式为主,偶见侵袭性浸润方式。5年生存率约90%。
2) 卵巢交界性黏液性肿瘤,伴据灶上皮内癌和微小浸润。5年生存率接近100%。
3) 卵巢转移性黏液腺癌,来自消化道/消化腺可能性大。患者预后不良,具体须结合原发癌的状况判断,一般5年生存率低于50%。
推荐参考文献:
1. Primary and metastatic mucinous adenocarcinomas of the ovary: Evaluation of the diagnostic approach using tumor size and laterality. Gynecol Oncol, 2006, 101(1):152-157.
2. Mucinous tumors of the ovary: Diagnostic challenges at frozen section and clinical implications. Gynecologic Oncology 125 (2012) 75-79.
感谢安徽省合肥市妇幼保健院 解正新(城北)老师提供病例,个人查阅文献整理相关内容,仅供参考学习!不当之处敬请批评指正!
【参考文献】
[1]郑文新, 沈丹华, 郭东辉. 妇产科病理学. 北京: 科学出版社, 2013年: 583-600.
[2]Robert J. Kurma, Maria Luisa Carcangiu, C. Simon Herrington, et al. WHO Classification of Tumours of Female Reproductive Organs [M]. Lyon: IARCC, 2014: 27-28.
[3]McFarland M, Dina R, Fisher C, et al. Osteosarcoma as Malignant Mural Nodule in Ovarian Mucinous Neoplasms of Intestinal Type: Report of 2 Cases [J]. Int J Gynecol Pathol, 2015, 6.
[4]Wang J, El-Bahrawy MA. Expression profile of mucins in ovarian mucinous tumors: distinguishing primary ovarian from metastatic tumors [J]. Int J Gynecol Pathol, 2014, 33(2):166-175.
[5]Missaoui N, Abdelkarim SB, Ayachi M, et al. HER2 expression in ovarian mucinous carcinomas in Tunisia [J]. Asian Pac J Cancer Prev, 2014, 15(19): 8121-8125.
[6]Lee JY, Jo YR, Kim TH, et al. Safety of fertility-sparing surgery in primary mucinous carcinoma of the ovary [J]. Cancer Res Treat, 2015, 47(2):290-297.
[7]Kim SK, Song SY, Kim S, et al. Association of pancreatic adenocarcinoma up-regulated factor expression in ovarian mucinous adenocarcinoma with poor prognosis [J]. Int J Clin Exp Pathol, 2014, 7(8):5103-5110.
[8]P JG, R VC, P KM, et al. Primary ovarian mucinous carcinoma with signet ring cells - report of a rare case [J]. J Clin Diagn Res, 2014, 8(6): 12-13.
[9]Kim SK, Cho NH. HER2-positive mucinous adenocarcinomas of the ovary have an expansile invasive pattern associated with a favorable prognosis [J]. Int J Clin Exp Pathol, 2014, 7(7):4222-4230.
















共0条评论