病例5未分化子宫肉瘤
(undifferentiated uterine sarcoma,UUS)
【病例介绍】
患者,女,49岁。经期下腹部胀痛伴经量多1年,加剧半月。临床诊断为子宫腺肌症合并子宫肌瘤、宫颈赘生物、失血性贫血。
【病理变化】
1、宫颈活检:
(1)巨检 术中见宫颈呈败絮状,触之出血,取3、6、9、12点送检。
(2)镜检 低倍镜示宫颈活检组织两块,部分区域出血明显,部分区域细胞较丰富,似乎呈浸润性生长,可见散在的宫颈管腺体(图1A)。进一步放大显示,肿瘤细胞相对丰富的区域局部可见坏死,与周围组织境界不清(图1B、图1C)。高倍镜示肿瘤细胞呈实性片状、巢状排列,局部可见管腔形成,肿瘤细胞呈上皮样、浆细胞样(图1D、图1E)或梭形细胞样(图1F),异型明显;肿瘤细胞界清,胞质丰富、嗜酸性,部分肿瘤细胞可见胞质内空泡;上皮样、浆细胞样肿瘤细胞的细胞核偏位,呈圆形、卵圆形或不规则形,胞核浓染或泡状,具有明显核仁;梭形细胞样肿瘤细胞的细胞核呈梭形,胞核浓染,可见核仁;未见明确的核分裂象。肿瘤背景中可见慢性炎细胞浸润。
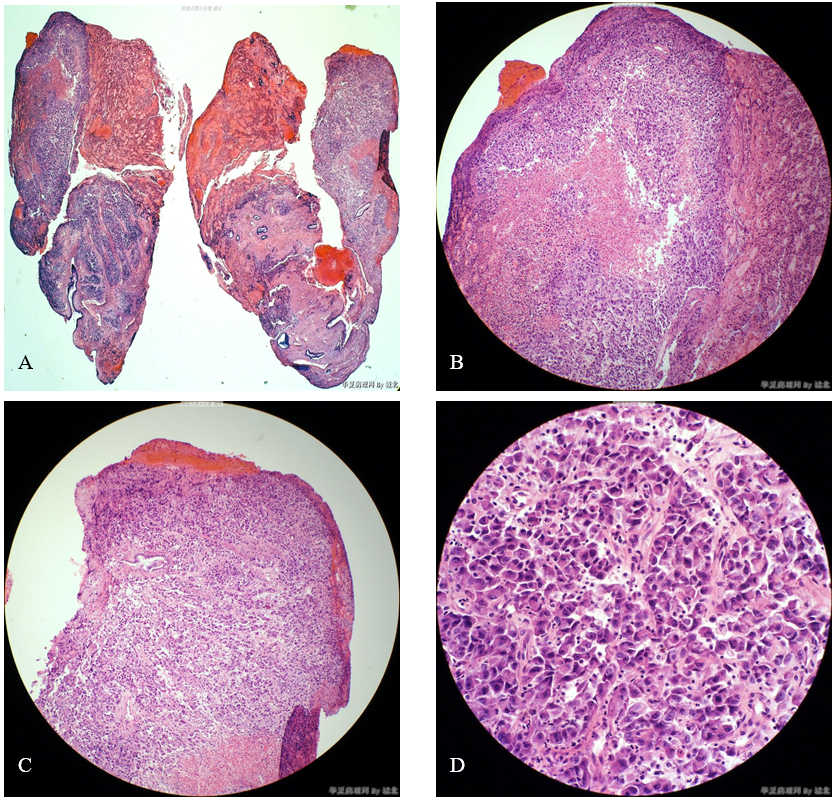
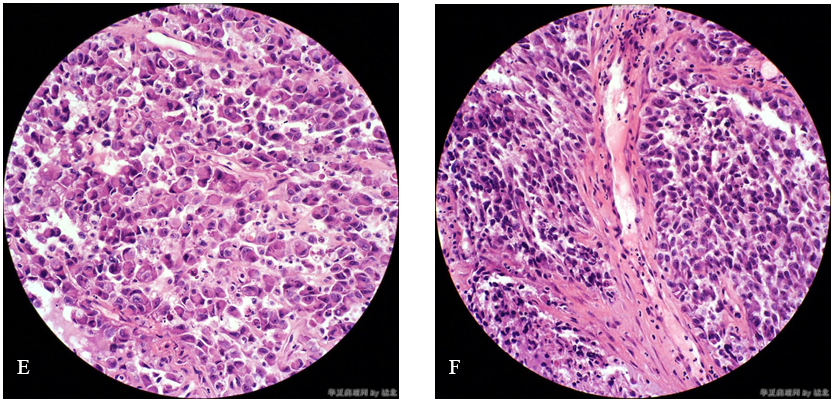
图1 未分化内膜肉瘤。A示部分区域肿瘤细胞相对丰富,呈浸润性生长;B示中央区域可见坏死,与右侧宫颈管组织境界不清;C示肿瘤细胞排列成实性、条索状,与周围组织境界不清,左上方见一埋陷于肿瘤组织中的正常宫颈管腺体;D示肿瘤细胞呈上皮样、浆细胞样,局部可见腺样结构,胞浆丰富、嗜酸性,细胞核偏位,可见明显的核仁;E示肿瘤细胞呈上皮样、浆细胞样,胞浆丰富、嗜酸性,部分细胞可见胞质内空泡,细胞核偏位,可见明显的核仁;F示肿瘤细胞呈梭形、上皮样,胞浆丰富、嗜酸性,梭形细胞核浓染,部分可见核仁。
(3)免疫组化: P53(+)、Vimentin(+)、Ca125(+)、EGFR(+)、Desmin(灶状+)、Ki-67(+); CK5/6(-)、AE1/AE3(-)、P63(-)、CEA(-)、P16(-)、HMB45(-)、S-100(-)、SMA(-)、Myoglobin(-)、ER(-)、LCA(-)、Inhibin(-)、E-Cad(-)、PLAP(-)。
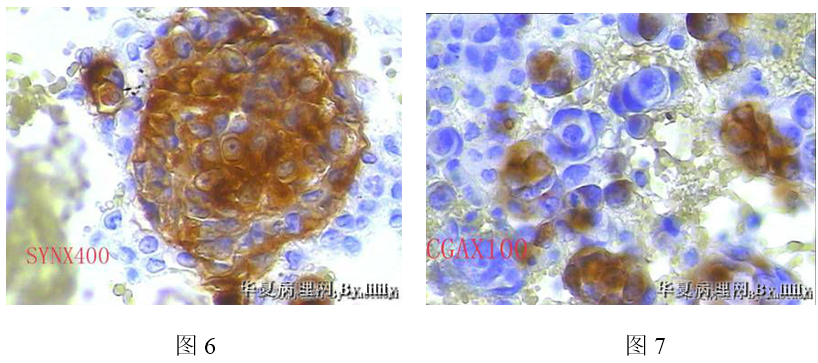
2、腹水细胞块:
(1)镜检 低倍镜示血性背景中散在的肿瘤细胞及细胞巢(图2A、图2B)。高倍镜示肿瘤细胞的细胞形态与宫颈活检中的肿瘤细胞的细胞形态相似(图2C、图2D),上皮样细胞,胞浆丰富、嗜酸性,细胞核大小不一、呈泡状,核膜不甚规则,核仁明显。
 图2 未分化内膜肉瘤(腹水细胞块)。
图2 未分化内膜肉瘤(腹水细胞块)。
(2)免疫组化 Syn(+)、CgA(+)、Ki-67(+)、AE1/AE3(-)、CD10(-)。
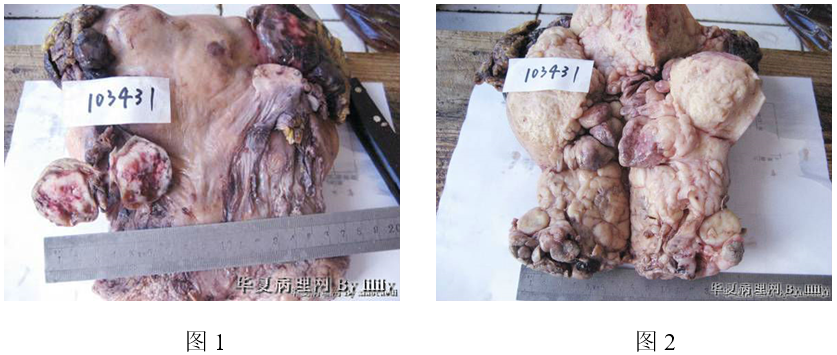
3、全切子宫:
(1)巨检 全切子宫的宫腔、宫颈管内及宫颈外口可见数个大小不一、灰黄色/灰褐色的息肉状肿物,其中大者直径约3cm(图3A);子宫浆膜面可见一直径约3cm的肿物,包膜完整,切面灰白色,肿物中央可见出血、坏死(图3B)。
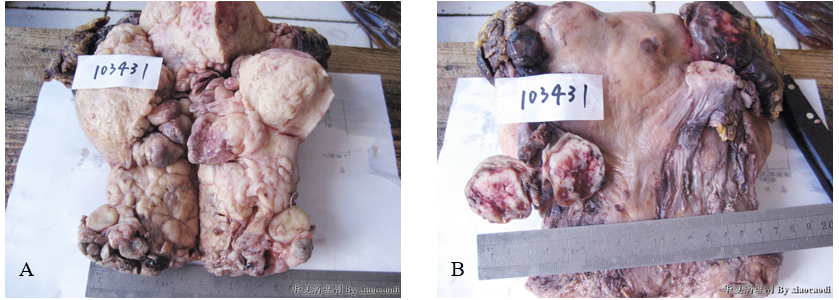
图3 未分化内膜肉瘤。
(2)镜检
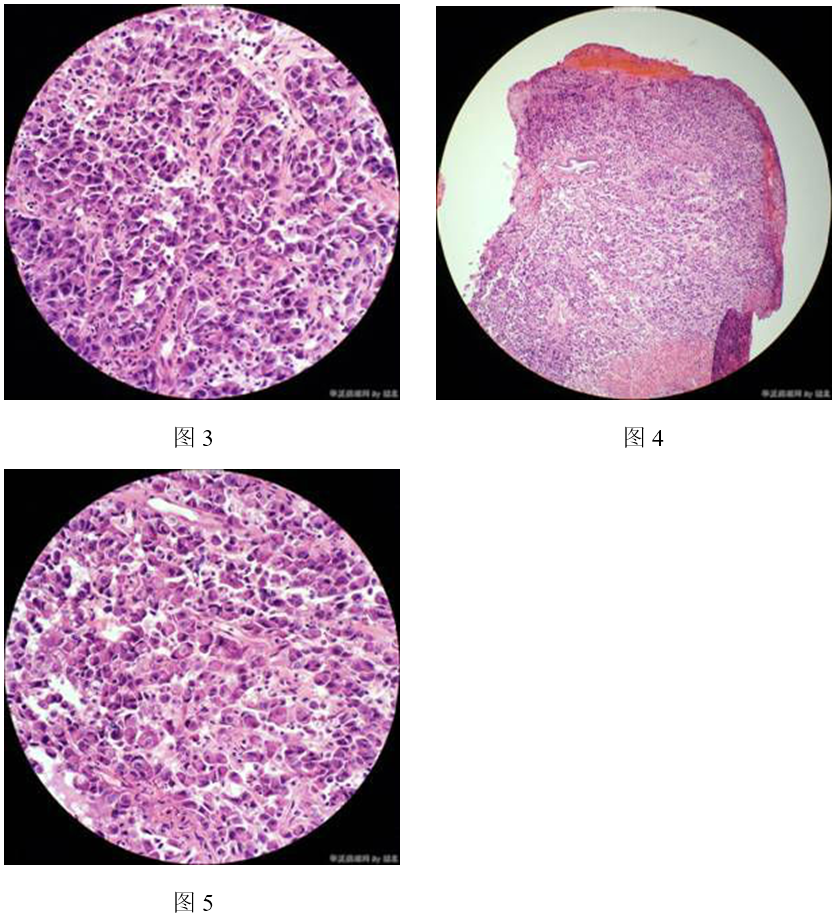
1)子宫肌层:肿瘤细胞在子宫肌层内呈弥漫浸润性生长(舌状浸润)(图13),肌层内血管/淋巴管内可见舌状浸润灶(图14、图15),局部血管/淋巴管壁可见浸润性的肿瘤细胞巢(图16),部分区域可见大片坏死(图17)。肿瘤细胞排列呈实性片状或条索状(图18、图19),局部似有管腔形成,肿瘤细胞形态同宫颈活检组织,呈上皮样、浆细胞样或梭形细胞样(图20,图21),异型明显;肿瘤细胞界清,胞质丰富、嗜酸性;上皮样、浆细胞样肿瘤细胞的细胞核偏位,呈圆形、卵圆形或不规则形,胞核浓染或泡状,具有明显核仁;梭形细胞样肿瘤细胞的细胞核呈梭形,胞核浓染;可见核分裂象(图21)。
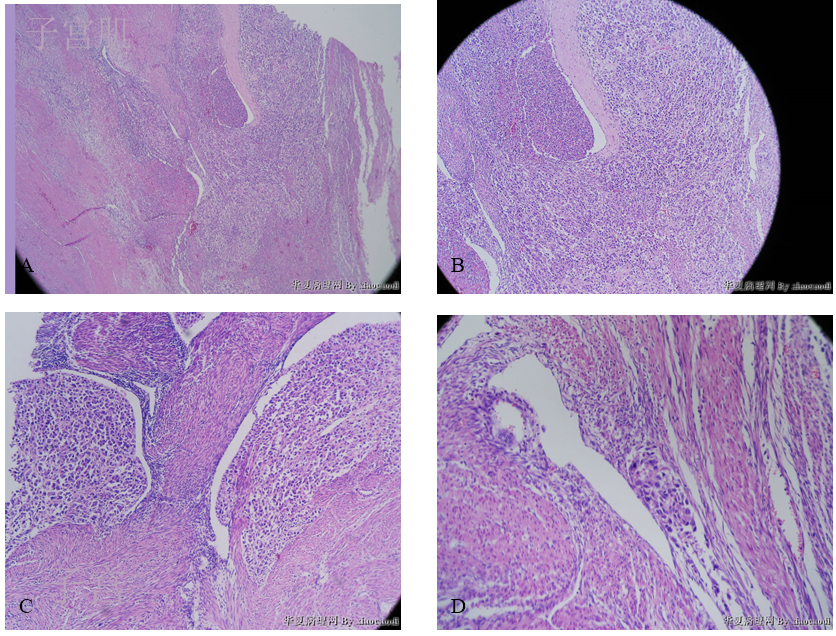
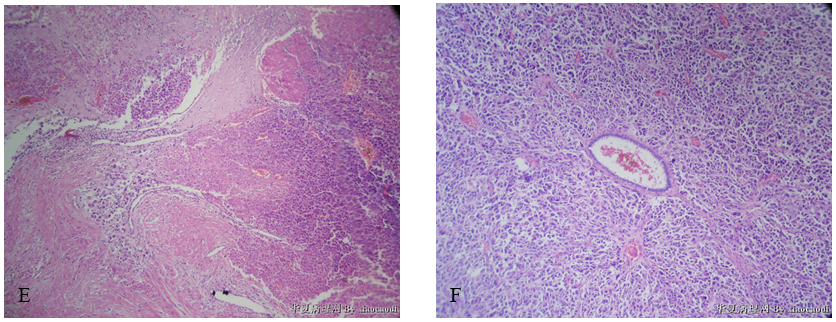
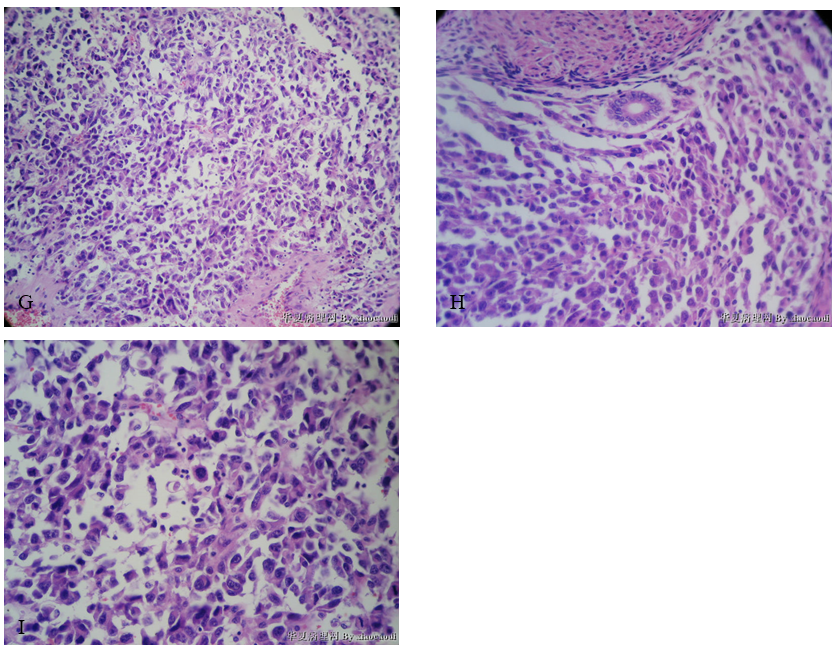
图4 未分化内膜肉瘤。A示肿瘤细胞呈舌状浸润;B、C示肌层内血管/淋巴管内舌状浸润灶;D示血管/淋巴管壁肿瘤细胞巢;E示大片坏死;F示肿瘤细胞排列呈实性片状,部分肿瘤细胞围绕血管呈放射状分布;G示部分肿瘤细胞呈梭形;H示肿瘤细胞呈上皮样、浆细胞样,可见核仁;I示核分裂象。
2)宫颈:肿瘤细胞呈舌状浸润宫颈组织(图5A、图5B)。
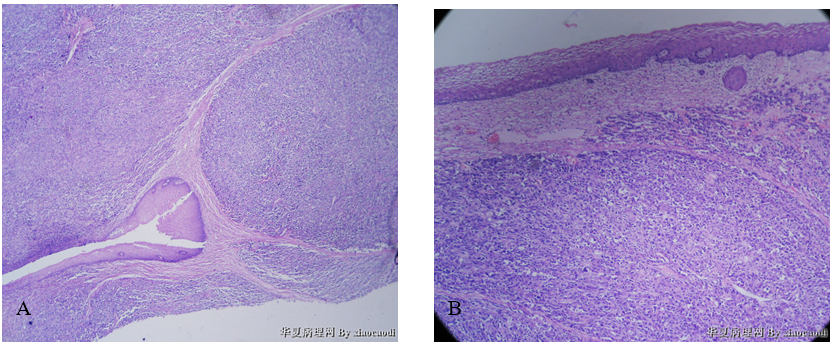 图5 未分化内膜肉瘤累及宫颈。
图5 未分化内膜肉瘤累及宫颈。
3)卵巢:未分化内膜肉瘤累及卵巢(图6A、图6B)。
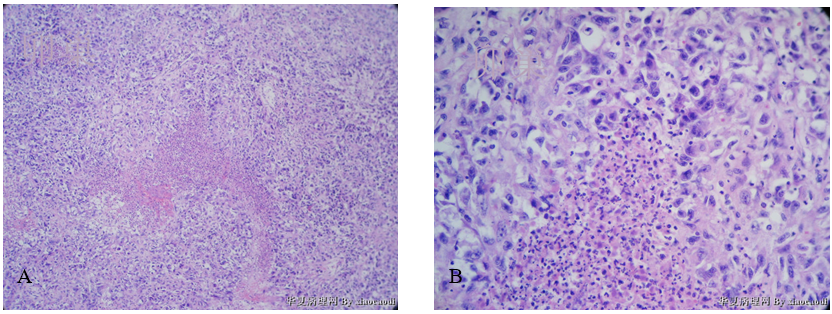 图6 未分化内膜肉瘤累及卵巢。
图6 未分化内膜肉瘤累及卵巢。
4)淋巴结:未分化内膜肉瘤盆腔淋巴结转移(图7A、图7B)。
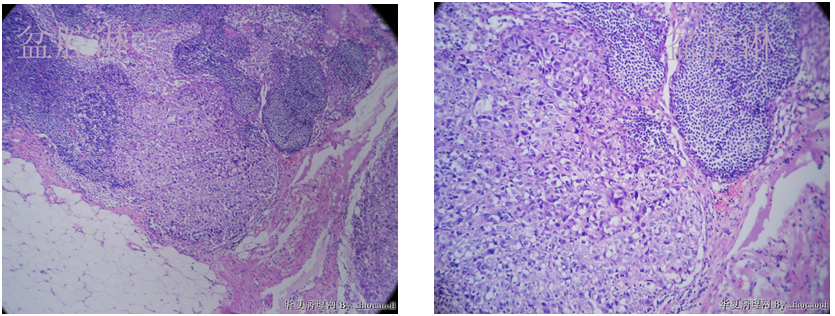 图7 未分化内膜肉瘤盆腔淋巴结转移。
图7 未分化内膜肉瘤盆腔淋巴结转移。
(3)免疫组化 : Vimentin(+)、CD10(灶状+)、Ca125(+)、EGFR(弱+)、Desmin(灶状+)、Ki-67(+)、CD56(+)。
【讨论】
子宫内膜间质肿瘤(endometrial stromal tumors,ESTs)由形态学上类似正常增殖期子宫内膜间质细胞的肿瘤细胞组成,大多数学者认为其起源于子宫原始间叶细胞,绝大多数发生于子宫,极少数发生于子宫外。2014年WHO女性生殖器官肿瘤分类将ESTs分为子宫内膜间质结节、低级别子宫内膜间质肉瘤、高级别子宫内膜间质肉瘤、未分化子宫肉瘤和类似卵巢性索-间质肿瘤的子宫肿瘤 [1]。
未分化子宫肉瘤( undifferentiated uterine sarcoma,UUS) 又称为未分化子宫内膜肉瘤( undifferentiated endometrial sarcoma,UES),是一种较少见的子宫内膜间质来源的恶性肿瘤,该肿瘤侵袭性强、预后差,缺乏间质细胞的特异性分化和组织学特点。2014年WHO女性生殖器官肿瘤分类将其定义为“一种起源于子宫内膜或子宫肌层的肿瘤,缺乏任何增殖期子宫内膜间质细胞的特征,伴有高级别细胞学特征并且没有特殊类型的分化”,其ICO-D编码为8805/3[1]。Flicker K等[6]使用arrayCGH研究显示UES具有高数量的染色体畸变,并且在每一条染色体中检测到拷贝数(copy number changes,CNCs)的变化,最常见的变化是染色体1q、2q(占75%)和13的缺失,以及染色体1q、17p的获得。
UUS较低度恶性子宫内膜间质肉瘤少见,患者发病年龄较大,多为绝经后妇女,平均年龄为55~60岁;UUS的临床表现与低度恶性子宫内膜间质肉瘤相似,如绝经后阴道出血、下腹部坠胀及盆腔包块等,少数患者无明显临床症状或表现为远处转移,可达到盆腔淋巴结、上腹部、及远处部位(如“肺”,即III期或IV期肿瘤);肿瘤大多发生于子宫体,偶见原发子宫外者,常伴有子宫内膜异位症,曾有文献报道未分化子宫内膜肉瘤伴肱骨转移,临床表现为上臂疼痛[2-3]。
UUS大体常表现为宫腔内一个或多个棕黄至灰色的息肉样肿物,质软,鱼肉样,常见出血和坏死,有时脱出到宫颈外口。常累及深肌层,具有宽广的浸润边缘。
UUS可以分为单形性和多形性两种亚型:单形性UUS由相对一致的肿瘤细胞组成,肿瘤细胞和子宫内膜间质细胞具有相似性,但是肿瘤细胞更大并且具有中等大小的异型核,染色质从细颗粒状至粗糙,核仁从较小到中等大小;肿瘤细胞具有嗜酸性或嗜双色胞质,细胞边界不清,核分裂多见;UES偶尔可呈纤维黏液样生长方式,其中肿瘤细胞呈梭形或被黏液样间质分隔。多形性UUS瘤细胞具有明显的多形性,通常较大,呈奇异型、圆形或梭形,有时具有丰富的嗜酸性胞质;细胞核大小和形状明显不同,染色质浓密,呈粗糙的团块状,常有大核仁;某些肿瘤中存在巨细胞和多核巨细胞。UUS的两种亚型核分裂象有所变化,几乎总是超过10个/10HPFs,有时接近50个/10HPFs;常出现广泛的坏死;UUS中的血管大小不一,杂乱分布,不像ESS的一致性小血管增生;多数病例可见肿瘤细胞呈舌状或栓状浸润血管[3-4]。
免疫组织化学肿瘤细胞vimentin、EGFR阳性,CD10、ER、PR、desmin、SMA、CK、EMA 阴性,少数病例CD10、SMA散在阳性。
鉴别诊断主要与子宫内膜间质肉瘤(ESS)、平滑肌肉瘤等鉴别(详见本例专家点评部分)。
手术根治是未分化子宫内膜肉瘤首选治疗方式,也可以结合放射治疗和化疗,但该肿瘤具有较强的侵袭性,患者预后极差,多数患者在诊断3年内死亡。据Gremel G等[7]等报道,UUS可以分为两个不同的预后组,即高分裂指数组和低分裂指数组。两组的预后具有显著的统计学差异,其中ER、PR的表达及YWHAE-FAM22异位的存在与低分裂指数组相关,并且具有良好的预后。
近年研究发现未分化子宫内膜肉瘤EGFR 高表达,EGFR有可能成为分子治疗的靶点,为未分化子宫内膜肉瘤的治疗开拓一片新的途径[5]。
【回帖精选】
1、xhyong 回复:
(6楼)肿瘤细胞胞浆丰富,上皮样,浆样,像这种形态的肿瘤有很多,包括癌,恶黑,上皮样肉瘤 横纹肌样瘤 ETT 还有少见的宫颈大细胞神经内分泌癌,肿瘤还有坏死,我还是首先考虑近心型上皮样肉瘤,鉴别诊断:上皮样平滑肌肉瘤(胞浆丰富,上皮样,有坏死,该诊断必须鉴别),ETT(虽然形态很相似,但ETT常见累腺,类似鳞状上皮样区域,和玻璃样间质,此例不是很典型),恶性黑色素瘤(胞浆似乎太红了点,而且大红核仁不是很典型) 大细胞神经内分泌癌(一般认为内分泌肿瘤血窦丰富,这点不典型,但是大细胞神经内分泌癌并不一定都出现血窦丰富的特点)。
(50楼)楼主的免疫组化结果看来,上皮样肉瘤也不支持了,CA125的表达很少在肉瘤中表达(我还没有查阅文献,感觉),CK5/6和广谱CK 及P63阴性,基本上堵住了鳞状细胞癌和腺癌的可能,而vimentin的阳性在癌中的表达除了内膜癌,肾细胞癌,部分泌尿道癌,前列腺癌,宫颈癌,很少有癌表达(除非肉瘤样),而本例强阳性表达,ER的阴性基本上也不太支持内膜癌。CA125的阳性,卵巢,内膜,宫颈皆可能,但是上皮的阴性表达让人无所适从,如果将CA125的表达认为是上皮的表达,则会得出双相性表达,这种情况,除了肉瘤样癌,内膜癌外,有可能就是恶性间皮瘤和滑膜肉瘤了,而滑膜肉瘤不见得表达CA125。本例下一步可能的趋势是再做D2-40 WT-1 CD34,及了解病史,单分析免疫组化,恶性间皮瘤的转移不无可能,看P53表达比较高,浆液性癌的转移有可能,但是Vimentin不好解释。CD34的阴性才能让我真正放掉上皮样肉瘤。
(51楼)记得陈国璋老师说过,上皮样间皮瘤细胞之间有连接,仔细看看本例似乎有点,关键是位置太少见,我们一般的思路还是要考虑位置的,也用他一句话说,如果你抛开位置,你会考虑什么,这时候也许我会考虑到上皮样恶性间皮瘤了,期待最后结果(呵呵,第三次回帖,学习为主)。
(57楼)查阅文献,真有ES表达CA125。CA125 Expression in Epithelioid Sarcoma(http://jjco.oxfordjournals.org/content/34/3/149.short);Proximal-type epithelioid sarcoma with elevated serum CA 125: report of a case with CA 125 immunoreactivity(http://www.ncbi.nlm.nih.gov/pubmed/16740043)。
文献看的不够,不再跟帖了,诊断排序:1、近心型上皮样肉瘤;2、转移性上皮样恶性间皮瘤。
(68楼)楼主循序渐进,大家是来回徘徊啊。还是等更低分子量的角蛋白(就细胞块的结果加上前面的已经给出大细胞神经内分泌癌的诊断了),CD34,D2-40出来吧,等得我煎熬啊!
(119楼)从前面的图片很难看出是子宫内膜未分化间质肉瘤。
2、木蚂蚁回复:
(8楼)上皮样细胞及短梭形细胞,呈片、巢状,有管腔形成,核类圆、偏位,核仁明显,胞浆偏红,可见浆内伊红色包涵体,细胞界清,伴有凝固性坏死,恶性肿瘤,考虑恶性黑色素瘤,不排除恶性横纹肌肉瘤、上皮样肉瘤;鉴别诊断:转移癌、血管肉瘤、PEComas、ETT。
(29楼)温习了一下书本,结合免疫结果 考虑近端型上皮样肉瘤,期待结果和分析。
(46楼)补充思路:免疫组化CK5/6_ AE1/AE3- CEA- Vimentin+、desmin灶状弱+、基本排除上皮源性肿瘤;HMB45-、S-100-也不支持恶黑;myogenin- 不支持横纹肌肉瘤;SMA瘤细胞也未显示表达判定为SMA-,排除平滑肌源性,; ETT (会有上皮样细胞、地图装坏死、围血管腔生长等,但免疫结果P63- Vimentin+、desmin弱+,不能支持
结合免疫及HE形态(1、结构特点:片、巢状,图6显示类似腺泡状,高倍也可看到腺腔形成,同时伴有坏死2、细胞特点:瘤细胞以上皮样细胞为主,伴有短梭形细胞(11图),胞浆偏嗜酸,亦有少许细胞浆偏淡染,胞浆界限大部分较清楚,核偏位,核仁明显,个别细胞浆内隐约可见伊红小球(似浆内包涵体),以上综合考虑:近端型上皮样肉瘤(PES)(形态学各种结构可以被其解释,免疫结果myogenin(-)、CK5/6(-)、AE1/AE3(-)、CEA(-)、Vimentin(+)、desmin(+)、HMB45(-)、S-100(-)也可支持。不过正如前面zhanglei老师所言“为myoglobin分化差的横纹肌肉瘤可以不表达”,所以应当加做myoD1、EMA 与横纹肌肉瘤鉴别,结果如果myoD1(+)、EMA(-)则支持横纹肌肉瘤;如果myoD1(-)、EMA(+)则支持PES;还有应当加做LCA
综上所述:诊断:近端型上皮样肉瘤(PES),鉴别诊断:横纹肌肉瘤,建议至少加做免疫:myoD1 EMA LCA
个人疑问:P53在横纹肌肉瘤中可以+,在PES或普通上皮样肉瘤中如何表达?
(53楼)CA125+即使不做MyoD1也可以排除横纹肌肉瘤了;上皮样肉瘤可以呈双向免疫表型表达,CA125+倒仍可以解释过去,会不会如此弥漫,无据可考。可LCA也有表达,就不能解释了。至此;上皮源性标记物CA125+,间叶源性标记Vimentin+、desmin灶状+、如果LCA判定为+,则杯具了……
所以我将那张LCA的表达判定为假阳性(理由:LCA(白细胞共同抗原)阳性表达着色点应当是胞膜着色,而图片内胞膜、胞浆、核以及薄壁血管壁都有阳性表达,所以不可靠),而且CA125+也基本将淋巴造血系统肿瘤排除在外了,并更支持了PES的诊断,至少目前的免疫表型表达结果尚不能排除PES。
(67楼)从目前免疫来看淋巴造血系统肿瘤可以彻底排除了。未分化子宫内膜间质肉瘤在HE下应当是高核分裂指数的肿瘤,这一点与HE中图片中分裂指数少不符合,CD10- _排除!恶性间皮瘤:Vimentin+、P53+、CA125+、CEA-,都可以,可是CK5/6_ syn+ CGA+ 不支持——排除!
(70楼)从目前标记来看,已经排除了很多肿瘤,基本进入“宫颈大细胞神经内分泌癌”与“PES(近端型上皮样肉瘤)”之间的鉴别比对中了;从HE来讲,不容易区别(广泛坏死、大细胞、核仁明显),只是核分裂指数,本例图片核分裂很少——这点与宫颈大细胞神经内分泌癌核分裂多略有区别;免疫组化:PES免疫:EMA+、Vimentin+、CD34半数+syn也可以+,CGA表达需要再查文献;所以鉴别点在:desmin、CD34、CGA表达上了,如果desmin+、CD34+,则支持PES;如果desmin-、CD34-,则支持大细胞神经内分泌癌;CGA+本身支持大细胞神经内分泌癌;不过在PES的表达还需要再查文献;AE1/AE3在细胞学的表达是间皮细胞还是肿瘤细胞,看不太清楚,似乎是肿瘤细胞+;在组织学表达是-;要支持神经内分泌癌还需要上皮源性标记明确表达的支持;desmin的表达,网友判断不一致,有+有-;该如何判断?一点点放免疫结果,倒引起不少兴趣;或许还有别的诊断;分析至此,希望各位老师指正!
(80楼)贵在参与,重在学习吧。楼主分3次给出3组免疫,曾亦步亦趋表达了自己的思路;不妨顺着原来思路继续:可看了大体标本,头晕了,看来做个围观者最好啊
第三组免疫给出了神经内分泌标记syn+ CGA+;尤其是CgA+表达基本否定了原来认为的PES诊断(经查文献,CGA未见在ES或PES的表达报道).所以我就开始想啊:
1、从HE来看片巢状、片状坏死;看不到很明显的梁岛状结构及菊形团样结构;细胞与周围的淋巴细胞对比,体积较大,浆红染-淡然,核有异型,部分明显可见核仁;很显然在HE中看不到很明显的神经内分泌肿瘤特点;可以考虑诸多肿瘤;鉴别诊断依赖IHC
2、神经内分泌标记syn+ CGA+;P53+、肌源性标记- ;第三组免疫中 广谱角蛋白有了表达——似乎直指“神经内分泌癌”!
3、在前面的分析中根据免疫组化已经排除了肌源性肿瘤、恶性黑色素瘤、ETT、未分化子宫内膜间质肉瘤、恶性间皮瘤、淋巴造血肿瘤等;在排除PES后需要和神经内分泌癌鉴别的就是非角化性鳞状细胞癌;
4、p63-,CGA+排除了非角化性鳞癌;而p63-则支持了神经内分泌癌;
5、至于其它免疫表达结果均可以被解释;波形蛋白Vimentin+的表达可见于宫颈部位的癌;
所以最终考虑诊断:宫颈神经内分泌癌
(本着至少一个神经内分泌标记阳性;至少一种上皮标记+的诊断原则,如果能有低分子角蛋白阳性则诊断依据更为充分)
对desmin免疫图片的判断,应当为-(阳性反应细胞占<5%)
可是再看那个大体标本,咋也不像癌啊,可是能表达CA125的非上皮源性肿瘤没几个啊,崩溃。
(120楼)最后一组大切标本图像,不能排除了,查了《诊断病理学第二版》和阿克曼第九版,都有“核分裂数不能单独作为低级别ESS和未分化子宫内膜肉瘤的鉴别指标”类似的描述,以前没多注意到这一点。只是CA125表达不好理解,还有那个细胞学也不好理解,不过倒从中获益不少!最重要的是无论有无CA125的表达,有无神经内分泌的表达,在排除了转移性肿瘤和淋巴瘤以及癌之后,从临床角度治疗方案上应该不会有什么影响。
3、TK1905回复:
(40楼)形态学表现为上皮细胞巢状梁状排列伴有上皮内坏死,确实首先从ETT、鳞癌考虑,再考虑上皮样形态的各种肉瘤,但是IHC都出来了,CK5/6、AE1/AE3都是(-),本例Vim明确+,结合其他IHC结果,楼上各位考虑ETT、上皮样平滑肌肉瘤、恶黑可能性都很小了。
ETT一般表达AE1/AE3、P63、CK18、E-cadherin、EGFR、PLAP,所以本例HE支持ETT但是IHC不支持;
本例恶黑标记明显阴性;平滑肌肉瘤的2个标记SMA和Desmin都(-),所以肯定不是
至于近端型ES可能性也低,除非INI-1(-)、EMA+、CD34+还有机会
我考虑:间质肉瘤、未分化肉瘤,IHC还需要做CD10、HCG、HPL、E-cadherin、CK18、EGFR、PLAP、CD31、CD34、Fli-1排除其他一切肿瘤。
(84楼)从大体图片考虑首先想到的是子宫原发的肉瘤,肯定不是癌,而且我觉得肯定是子宫原发的而非转移性肿瘤,考虑间皮瘤的也不靠谱,大体就排除了,因为肿瘤是从子宫内部弥漫浸润子宫肌壁,而未表现为浆膜面大量结节,IHC广谱CK都是阴性的啊,上皮样间皮瘤不可能不阳的,肿瘤结节状浸润子宫肌壁、子宫下段、子宫颈,表现为质地非常均质偏灰黄色,感觉质地是细嫩柔软的,我有限的经历就是——子宫内膜间质肉瘤是这样表现的,回头再看HE,部分地方确实有上皮样细胞围绕螺旋动脉的特征,只是CD10是阴性不好解释
平滑肌肉瘤基本已经给Pass了,因为SMA和Desmin都是阴性,为什么还要考虑?
要诊断横纹肌肉瘤可能性更小,老年人这个位置得这个病报道极少而且报道的都是胚胎性横纹肌肉瘤的亚型葡萄状横肉,按发病年龄和HE形态考虑横肉话应该划在多形性横纹肌肉瘤or上皮样横纹肌肉瘤(上皮样型最近美国外科病理学杂志有篇文章报道)范畴里面,原发在宫颈的多形性横肉真的罕见,再加上Desmin-和Myoglobin-还诊断它吗?即使加了MyoD1阳性的可能性也很低
近端型上皮样肉瘤报道的大多是会阴部、外阴、骨盆,目前IHC没有CD34、EMA和INI-1不好说,但是大体好像不是这个样子,位置还是外阴和耻骨前区较好发而非宫颈和子宫
CA125和EGFR+我认为特异性很低,间皮瘤、子宫内膜间质肉瘤、未分化肉瘤均可以表达后者,而血清学检查间质肉瘤可以有CA125增高,IHC表达CA125不知道有无意义
这例IHC表达的都没有明确诊断性的表达,那么最后排除了一切其它诊断可以考虑:子宫原发未分化肉瘤。
【提供者单位及姓名】安徽省宣城市人民医院病理科 陈海玲(xiaocaodi)
【专家点评-张祥盛老师】
这是一例很好的病例,网友讨论很踊跃,阅读次数高达5308,回复107条。
这也是一例很有挑战性的病例,在回复的107条信息中,提出的诊断有8类,18种,包括:①癌:低分化鳞癌、非角化型浸润性鳞状细胞癌、低分化腺鳞癌(毛玻璃细胞癌亚型);②神经内分泌肿瘤:大细胞神经内分泌癌、低分化鳞癌(伴有神经内分泌分化)、类癌;③肉瘤:横纹肌肉瘤、间质肉瘤、未分化肉瘤、上皮样血管肉瘤、近心型上皮样肉瘤;④恶性黑色素瘤;⑤淋巴造血系统肿瘤:浆细胞瘤、间变性大细胞淋巴瘤;⑥混合性肿瘤:腺肉瘤、癌肉瘤或MMMT;⑦滋养叶细胞肿瘤:ETT和⑧转移性腺癌(印戒细胞癌)。原单位提供的病例也很全面,大体标本、HE切片,免疫组化、细胞学及细胞学免疫组化,免疫组化就做了24种:包括:阳性8种(P53+、Vimentin+、Ca125+、Syn-+、CgA+、EGFR+、Desmin灶状阳性和CD10灶状阳性);阴性16种(Ck5/6-、AE1/AE3-、P63-、CEA-、P16-、HMB45-、S-100-、SMA-、Myoglobin-、ER-、KI-6715%、LCA-、Inhibin-、E-Ca-、PLAP-、AE1/AE3-)。现把我的一些看法和大家谈谈,不一定正确,望各位网友踊跃参加讨论。
一、原发性肿瘤还是转移性肿瘤?
子宫的转移性肿瘤绝大部分是癌,巨检多为弥漫性浸润或子宫表面弥漫性结节,IHC广谱CK应该阳性;本例大体观察肿瘤累及子宫肌层,向子宫内膜表面结节状突起,组织学上大部分呈弥漫性结构,有些区域呈巢团状,但缺乏促纤维组织增生,IHC广谱CK都是阴性,不支持转移性肿瘤,而是原发性肿瘤。
二、是癌么?
癌包括鳞癌、腺癌、尿路上皮癌和神经内分泌癌,除了少数神经经内分泌癌以外,癌细胞均有呈巢的特点,主间质分界清楚;而肉瘤瘤细胞弥漫性分布,无细胞巢,主间质分界不清;网染细胞间有网状纤维。血管丰富、血道转移早。子宫体的肿瘤以腺癌为主,少数为鳞癌。本例瘤细胞大部分呈弥漫性排列,部分区可见不明显的梁岛状结构,间质缺乏促纤维组织增生,可见灶状、片状坏死;细胞与周围的淋巴细胞对比,体积较大,胞质红染-淡染,核有异型,部分可见明显核仁;但在腹水细胞学明显呈颗粒状,细胞胞质丰富,相互嵌合,似有癌的特征,但IHC广谱CK、P63、CEA都是阴性,不支持癌,包括鳞癌、腺癌。
三、是神经内分泌肿瘤么?
本例细胞学图片SYN和CgA阳性,给诊断带来困难,但在HE切片中从细胞学改变到组织结构均无神经内分泌肿瘤的特点;结合大体不支持神经内分泌肿瘤,建议对组织做一下神经内分泌肿瘤的免疫组化。
四、是黑色素瘤么?
黑色素瘤结构复杂多样,有似癌非癌、似肉瘤非肉瘤的感觉。有些肿瘤癌和肉瘤分别不清,想到黑色素瘤是一个正确的思路,此时要注意看核,核的大小,有无大核仁,有无芽瓣状细胞核等。本例细胞异型性很大,确有弥漫(似肉瘤)和呈巢(似癌)的特点,部分细胞核也较大,想到黑色素瘤不无道理,但IHC S-100、HMB45均阴性,不支持黑色素瘤。巨检也不象黑色素瘤。
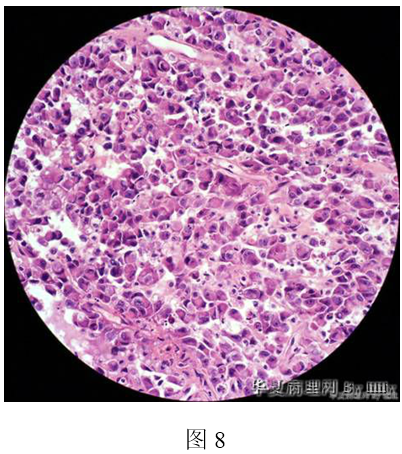
五、是肉瘤么?哪型肉瘤?
网友提出肉瘤的诊断有横纹肌肉瘤、近心型上皮样肉瘤、上皮样血管肉瘤、子宫内膜间质肉瘤等。发生在女性生殖道的横纹肌肉瘤以葡萄簇肉瘤多见,常发生在阴道,小儿多见,组织学特点为表面上黏膜存在,在黏膜下可见幼稚细胞构成的“形成层” (cambium layer),是以树木的韧皮部和木质部之间能产生新生细胞的薄层结构比喻这一分裂增生, 特征为紧贴上皮下的疏松带分隔活跃的细胞密集带。其下是黏液水肿样间质,散布有分化程度不一的横纹肌母细胞。腺泡状横肉和多形性横肉均较少见,免疫组化desmin、myoglobin、MSA、Myo D1、myogenin、HHF-35等阳性,本例从组织学改变、免疫组化结果不支持横纹肌肉瘤。上皮样肉瘤构成于上皮样细胞和梭形细胞,呈结节状浸润性生长,中心有坏死,往往呈地图状,结节周可见炎细胞浸润和胶原增生,发生在肢体远端,主要累及手指、手掌和前臂的屈肌面,称远心型,发生于躯干者称为近心型,免疫组化低分子和高分子CK、EMA和波形蛋白阳性,约60%的病例CD34阳性。本例非结节状生长,细胞异型性明显,CK、EMA阴性,不支持上皮样肉瘤。但是本例CA125阳性,Kate发现上皮样肉瘤可Ca125一致性强阳性,部分患者血清CA125升高,可作为肿瘤检测的标记物。有一位网友在http://jjco.oxfordjournals.org/content/34/3/149.short查到上皮样肉瘤表达Ca125,从发生部位、构成的细胞、组织学结构以及免疫组化(除Ca125除外)结果,我个人觉得不支持上皮样肉瘤,也不支持上皮样血管肉瘤,对于Ca125的意义我不能解释。
六、滋养叶细胞肿瘤:ETT
ETT为一种来源于平滑绒毛膜IT的奇特的滋养细胞肿瘤,30%位于子宫体,50%位于子宫下段或子宫颈,其余20%位于子宫外包括小肠和肺。上皮样中间滋养细胞成巢状或片状,位于广泛的坏死中;瘤细胞异形性较小,大小均匀, 单圆核,胞浆丰富, 透明或嗜酸性; 瘤细胞呈结节样生长: 结节中央常常有红色的无定型物质和坏死。核分裂一般0~9/10高倍镜,平均2/10高倍镜, 一般有很多凋亡小体。免疫组化: Inhibin, p63,E-cad +++,CK +++,EMA+,hPL,hCG,PLAP,CD146 一般灶状阳性。易于鳞状细胞癌混淆。本例不支持。
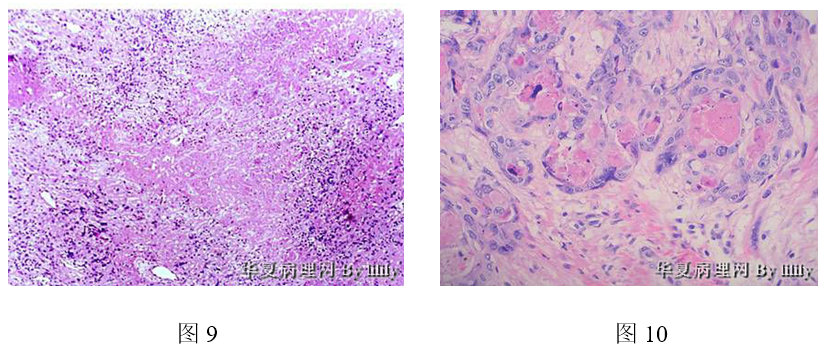
七、淋巴造血系统肿瘤
尽管任何组织学改变都不能排除淋巴瘤,但细胞相对一致、弥漫排列是淋巴瘤的组织学特点,免疫组化对淋巴瘤的诊断和分型起决定作用。本例组织学特点要考虑淋巴瘤的话,要想到浆细胞瘤、粒细胞肉瘤和T细胞淋巴瘤。子宫的淋巴瘤很罕见。总体上不支持,免疫组化可帮助鉴别。
八、尽管肿瘤形态不典型,免疫组化不典型,细胞分化很低,但从大体、生长方式、组织学改变以及免疫组化结果支持本例为子宫原发性肉瘤。
常见的子宫肉瘤为平滑肌肉瘤、子宫内膜间质肉瘤和含有癌成分的恶性苗勒管混合瘤,从组织学形态和免疫组化不支持平滑肌肉瘤和恶性苗勒管混合瘤,那是不是子宫内膜间质肉瘤呢?子宫内膜间质肉瘤包括子宫内膜结节、低级别子宫内膜间质肉瘤和未分化子宫内膜肉瘤,本例形态学即可排除前两者,剩下的就是未分化子宫内膜肉瘤。未分化子宫内膜肉瘤属高级别子宫内膜肉瘤,肿瘤缺乏特异性分化,没有子宫内膜间质肿瘤的组织学特点。此瘤有一个明显的特点,就是巨检肿瘤的大体形态与低级别ESS相同,发现时肿瘤常较大,常见出血和坏死;而镜检与低级别ESS相比未分化子宫内膜肉瘤有明显的细胞异型性,瘤细胞大,细胞境界不清,胞质嗜酸性或嗜双色性,细胞核大、泡状核明显,核染色质粗大呈块状,核仁明显。尽管核分裂数不能单独作为低级别ESS和未分化子宫内膜肉瘤的鉴别指标,但高核分裂数是未分化子宫内膜肉瘤的特点,可见病理性核分裂,组织学相似于癌肉瘤的肉痼成分。因而应充分取材,以排除癌肉瘤和其他肉瘤的可能性。本例具有巨检类似低级别子宫内膜间质肉瘤,镜检瘤细胞明显异型性,缺乏ESS的组织学特点,免疫组化CD10和Desmin灶状阳性,符合未分化子宫内膜肉瘤。
TK1905回复的较好。
此例也有几个难以理解的问题,瘤细胞Ca125和EGFR阳性,意义是什么?细胞学免疫组化SYN和CgA阳性,怎样解释?
感谢安徽省宣城市人民医院病理科陈海玲老师提供病例,个人查阅文献整理相关内容,仅供参考学习!不当之处敬请批评指正!
【参考文献】
[1]Robert J. Kurma, Maria Luisa Carcangiu, C. Simon Herrington, et al. WHO Classification of Tumours of Female Reproductive Organs [M]. Lyon: IARCC, 2014:141-146.
[2]牛多山,陈海玲,扬杰,等. 未分化子宫内膜肉瘤6例临床病理观察析[J].临床与实验病理学杂志, 2011, 27(8) :820-822.
[3]薛德彬译. Blaustein女性生殖道病理学[M]. 北京:北京科学技术出版社, 2014: 477-480.
[4]郑文新, 沈丹华, 郭东辉. 妇产科病理学. 北京: 科学出版社, 2013年:393.
[5]Moinfar F,Gogg- Kamerer M,Sommersacher A,et al.Endometrial stromal sarcomas frequently express epidermal growth factor receptor (EGFR,HER-1) : potential basis for a new therapeutic approach [J].Am J Surg Pathol,2005, 29( 4): 485-489.
[6]Flicker K, Smolle E, Haybaeck J3, et al.Genomic characterization of endometrial stromal sarcomas with array comparative genomic hybridization [J]. Exp Mol Pathol, 2015, 98(3):367-374.
[7]Gremel G, Liew M, Hamzei F, et al. A prognosis based classification of undifferentiated uterine sarcomas: identification of mitotic index, hormone receptors and YWHAE-FAM22 translocation status as predictors of survival [J]. Int J Cancer, 2015, 136(7):1608-1618.







 图2 未分化内膜肉瘤(腹水细胞块)。
图2 未分化内膜肉瘤(腹水细胞块)。



 图5 未分化内膜肉瘤累及宫颈。
图5 未分化内膜肉瘤累及宫颈。 图6 未分化内膜肉瘤累及卵巢。
图6 未分化内膜肉瘤累及卵巢。 图7 未分化内膜肉瘤盆腔淋巴结转移。
图7 未分化内膜肉瘤盆腔淋巴结转移。












共0条评论