[导读] 作者:慧海拾穗
【摘要】
在过去的50年,发现病毒与多种疾病有关,包括肿瘤性和非肿瘤性疾病。一些EB病毒相关的疾病发生于消化道,包括从轻微的暂时性炎症到甚至致命的疾病。本文探讨消化系统中新发现或新近发现的与EB病毒相关的疾病的临床病理学特征及相关治疗。
【前言】
Epstein-Barr病毒(EBV)或人类疱疹病毒4,是疱疹病毒家族的成员,是一种包被的双链DNA病毒。90%以上的人群感染了EBV,尽管感染通常是亚临床的。传播通常是口对口的;然而,在EBV+供体和EBV受体之间的器官移植和输血可以传播感染。EBV可引起年轻人急性传染性单核细胞增多症,而儿童原发性感染通常无症状。
EBV于1964年首次被认识。Epstein等人在培养的Burkitt淋巴瘤细胞中观察到病毒颗粒。作者描述该病毒具有疱疹病毒的特征,但病毒的性质及其在该病中的作用仍不清楚。此后不久,从感染性单核细胞增多症患者的外周血白细胞和健康人的囊胚细胞培养物中分离出相同的病毒。在同一时期,当Pope和Gerber等人报告病毒诱导正常白细胞的类胚转化时,将病毒与淋巴增生性疾病联系起来的尝试最终获得成功。从那时起,EBV被认为是第一种肿瘤病毒,不仅与血液系统恶性肿瘤有关,还与鼻咽癌和胃癌有关。随后,EBV与平滑肌肿瘤和免疫缺陷相关的淋巴增殖性疾病有关。
对病毒学方面的全面讨论超出了本综述的范围。简而言之,EBV感染淋巴细胞、上皮细胞和表达CD21的滤泡树突状细胞。在naïve B细胞中,病毒DNA物质的暂时性表达在裂解基因、EBNA2、BCL2同源基因(BHRF1和BALF1)的影响下,迫使细胞走向成熟、初始复制和防止细胞死亡,病毒的microRNAs会产生淋巴母细胞(溶解期)。感染会导致EBV基因物质的表达下降,从而使病毒避开宿主的免疫检测(潜伏期)。通过编码以下基因的差异表达,病毒可显示4种潜伏类型:潜伏膜蛋白(LMP1、LMP2A和LMP2B)、EBV核抗原(EBNA-1、EBNA-2、EBNA-3和EBNALP)。此外,在BamHI A向右转录本(BARTs)中有2个非编码RNAs(EBER1和EBER2)和microRNAs编码。研究表明,LMP1和LMP-2是调节细胞存活、增殖(NF-κB、JAK/STAT、PI3K/AKT、MEK/ERK和JNK信号通路)、细胞周期和凋亡的主要转化蛋白。此外,激活NFκB会对BART microRNA表达产生负面影响,阻止向裂解期的转变,并以一种能够避免免疫监视的方式调节宿主细胞的基因表达,包括细胞因子和干扰素的产生。
由EBV引起的消化系统疾病的范围很广,从传染性单核细胞增多症和急性胃炎中的自限性急性肝炎到更多的慢性和侵袭性疾病,如以T细胞和NK细胞型的慢性活动性EBV感染为背景的慢性活动性胃肠炎,免疫抑制患者中的EBV相关淋巴增殖性疾病和淋巴瘤,包括EBV+-黏膜皮肤溃疡(EBVMCU)。此外,还与消化道EBV+炎性滤泡树突状细胞肉瘤(FDCS)和EBV相关性胃癌(EBVaGC)有关。
【EBV阳性黏膜皮肤溃疡】
EBV阳性黏膜皮肤溃疡(EBVMCU)是一种新近增加的EBV相关淋巴增生性疾病的亚型。Dojcinov等人首先描述了这种局部形式的EBV相关的多形态B细胞增殖,它影响了具有霍奇金样形态和免疫表型但临床进程缓慢的免疫抑制患者的皮肤和粘膜。大多数报告的病例累及口咽部,其次是皮肤和胃肠道。溃疡大多发生在中位年龄为66.4岁(16-101岁)的老年患者身上,且以女性为主。患者通常表现为孤立的、疼痛性溃疡,与肝脏、脾脏、全身淋巴结或骨髓受累无关,尽管区域淋巴结受累和多灶性(17%的病例)已被描述。几乎所有病例的血病毒载量都是阴性的。组织学上,病变包括黏膜局限性多形性淋巴浆细胞浸润,包括大型EBV免疫母细胞和里Reed-Sternberg(RS)样细胞(PAX5、MUM1、OCT2和CD30染色阳性,CD15、CD20和CD45表达不一)、散在凋亡的单核细胞、嗜酸性粒细胞、一些组织细胞和溃疡底部小CD3+淋巴细胞带(图1)。EBV编码小RNA(EBER)的原位杂交在免疫母细胞和部分小B细胞中呈阳性。克隆性B细胞免疫球蛋白基因重排在一半的病例中被发现,而T细胞受体基因可以是寡克隆的,甚至是单克隆的。
与其他EBV相关的淋巴增生性疾病类似,EBVMCU主要是由于免疫功能受损,主要是在医源性免疫抑制(主要是甲氨蝶呤、环孢素和硫唑嘌呤治疗)、与年龄相关的免疫衰老和不常发生的原发性免疫功能丧失的环境中造成的。在免疫力正常人中,在T细胞的控制下EBV感染在记忆细B胞中保持休眠。移植后或治疗相关的免疫抑制加上相关T细胞表位限制,由寡克隆或甚至单克隆T细胞受体基因重排证明,允许转化的B细胞增殖。此外,甲氨蝶呤和环孢素等药物通过激活前者的早期病毒启动子或通过氧化应激介导的后者的激活,直接促进B细胞增殖。
在胃肠道,溃疡可以影响任何器官。临床症状各不相同,包括出血、腹泻和肛周皮肤溃疡,临床上类似于炎症性肠病(IBD)。当累及结肠时,溃疡表现出相同的细胞浸润,渗透在不明显的隐窝之间。有趣的是,在结肠和肛周皮肤中报告的一些病例是在用硫唑嘌呤和英夫利昔单抗进行免疫抑制治疗的IBD患者中。这些病例都不是发生在年龄相关免疫抑制环境中。IBD粘膜损伤可促进B细胞的复制和EBVMCU的发生。乍一看,EBV可能代表IBD患者的重叠感染。然而,在难治性结肠炎中EBV的发生提示了其在组织损伤中的作用。Pezhouh等人发现,难治性IBD患者EBER+炎性细胞的表达高于对治疗有反应的IBD患者,EBV感染负荷与炎症深度相关。同样,除了IBD外,最近的一份报告描述了4例EBVMCUs并发由免疫检查点抑制剂引起的结肠炎;这些病例是类固醇难治性的,与穿孔有关。免疫抑制和类固醇难治性结肠炎患者的高怀疑指数是诊断胃肠道EBVMCU的关键,因为非特异性表现和活检材料的发现混淆了诊断,而已知结肠炎患者的症状通常归因于疾病复发。
然而,EBVMCU可与其他免疫缺陷相关的淋巴增殖性疾病相混淆,主要是多形性淋巴浸润,类似于移植后淋巴增殖性疾病、霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤。与多形态淋巴浸润不同,EBVMCUs是溃疡性非肿块性病变,与全身病变无关,患者的EBV血清滴度结果为阴性。区分EBVMCU和经典HL也很棘手;然而,胃肠道HL是极其罕见的,特别是在没有淋巴结受累的情况下。此外,小细胞和R-S样细胞中CD20、CD45和EBER的阳性表达是一个分化特征。了解临床表现和疾病程度是诊断的关键。
此外,EBVMCU是一个惰性过程。许多患者会自发性消退,特别是在与年龄相关的免疫抑制的情况下,而其他患者则对使用或不使用利妥昔单抗的免疫治疗减少作出反应。有些病变可能持续存在,但通过化疗、放疗或手术切除治愈。罕见的病例已经发展成HL,而在移植后患者中,复发与其他更具侵袭性的移植后淋巴增生性疾病已被报道。只有一种与疾病相关的死亡报告。
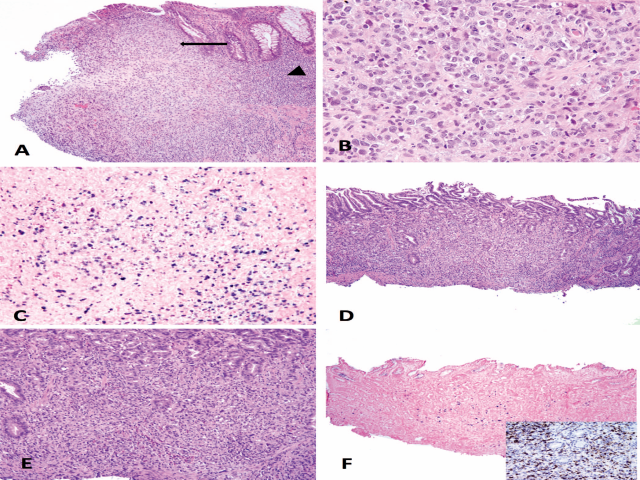
图1 EBV阳性皮肤粘膜溃疡的组织学表现:A、 在本例中,结肠溃疡周围有多形性炎症细胞浸润(箭头),周围有小淋巴细胞(箭头)。B、 浸润主要由大的非典型淋巴细胞和小的淋巴细胞组成。C、 EBV编码的RNA原位杂交显示大淋巴细胞和部分小淋巴细胞为细胞核阳性。D和E,另一个涉及胃粘膜局限性浸润的病例,当EBV编码的RNA为阳性(F)时,背景中有CD3+T细胞(F,插图)。总的来说,区别淋巴瘤的线索是炎症细胞浸润的异质性/多样性。
【参考文献】
[1] Select Epstein-Barr Virus–Associated Digestive Tract Lesions for the Practicing Pathologist. doi:10.5858/arpa.2019-0703-RA














共0条评论