[导读] 作者:曹 威,何英剑,李金锋,解云涛,王天峰,范 铁,王歆光,汪 星,范照青. 来源: 中国癌症杂志, 2020, 30 (3): 217-223.基金项目:首都卫生发展科研专项基金资助项目(2018-2-2152)。通信作者:范照青 E-mail: zhqfan@sina.com


[摘要]背景与目的:由于存在病理学低估,乳腺导管原位癌(ductal carcinoma in situ,DCIS)是否需要行腋窝前哨淋巴结活检(sentinel lymph node biopsy,SLNB)仍有争议。通过回顾性分析,探索超声引导下空芯针穿刺活检(core needle biopsy,CNB)诊断的DCIS出现病理学低估的危险因素,探讨穿刺病理学诊断为单纯DCIS的患者免除腋窝SLNB的可能性。方法:选取2005年3月—2014年10月北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺癌预防治疗中心收治的符合以下条件的乳腺癌病例纳入研究:女性;超声引导下CNB诊断为乳腺DCIS(含微浸润);腋窝淋巴结临床阴性;接受规范的手术、放疗或全身系统性治疗。统计患者的临床病理学特征,采用χ2检验或Fisher精确概率法进行临床病理学特征与病理学低估比例的相关性分析,采用logistic回归探索病理学低估可能的危险因素。结果:研究纳入单纯DCIS、DCIS伴微浸润和DCIS可疑微浸润分别360、63和31例。单纯DCIS术后病理未升级占56.4%,升级为微浸润癌和浸润癌分别为21.7%和21.9%;后两组术后病理学诊断为微浸润癌的比例为30.2%和35.5%,浸润癌的比例为66.7%和61.3%,组间差异有统计学意义(P<0.001)。肿瘤>3 cm和核分级高发生病理学低估的风险,分别是肿瘤≤3 cm和核分级中低的1.97倍(95% CI:1.17~3.32,P=0.011)和2.30倍(95% CI:1.34~3.98,P=0.003),而人表皮生长因子受体2(human epidemal growth factor receptor 2,HER2)不确定(OR=0.37,95% CI:0.19~0.72,P=0.003)和阳性(OR=0.38,95% CI:0.20~0.73,P=0.004)发生病理学低估的风险低于HER2阴性,差异有统计学意义。肿瘤>3 cm、核分级高、HER2阳性的CNB单纯原位癌的病理学低估比例最高,为73.1%;肿瘤>3 cm、核分级高、HER2不确定的病理学低估比例最低,为11.9%。结论:超声引导下CNB诊断的DCIS伴微浸润或DCIS可疑微浸润病理学低估的比例远高于单纯DCIS,二者不能免除SLNB。肿瘤>3 cm、核分级高和HER2阴性是术前单纯DCIS出现病理学低估可能的危险因素,单纯DCIS仍需行腋窝SLNB。
随着乳腺癌筛查的发展,新发乳腺癌中导管原位癌(ductal carcinoma in situ,DCIS)的比例不断提高[1]。DCIS的确诊依靠活检基础上的病理学诊断,国内常用的活检方法之一是超声引导下空芯针穿刺活检(core needle biopsy,CNB)。但有综述显示,CNB诊断的DCIS中9%~52%[2]和10%~38%[3]的病例术后出现病理学低估,最终诊断升级为浸润性癌,腋窝前哨淋巴结活检(sentinel lymph node biopsy,SLNB)的阳性率达1.4%~13.0%[4-5]。因此,寻找合适的临床病理学特征预测DCIS发生病理学低估的风险,从而准确评估患者的腋窝淋巴结状态及预后,具有重要的临床意义。本研究选择经超声引导下CNB诊断为DCIS的病例进行回顾性分析,总结患者的临床病理学特征,分析与病理学低估可能有关的危险因素,探讨穿刺单纯DCIS的患者免除SLNB的可能性。
1.资料和方法
1.1 临床资料
对2005年3月—2014年10月北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺癌预防治疗中心收治的乳腺癌病例进行筛选,入组标准为:① 女性;② 超声引导下CNB诊断为乳腺DCIS(含微浸润);③ 腋窝淋巴结临床阴性;④ 接受规范的手术、放疗或全身系统性治疗。排除标准为:① 穿刺病理学诊断为浸润癌;② 既往存在其他恶性肿瘤,包括乳腺浸润性癌病史。符合条件的病例收集其临床病理学特征。
1.2 病理学检查
CNB组织全取,术后切除标本病灶≤2 cm者间隔0.5 cm、>2 cm者间隔1.0 cm取材,取材面积2 cm×1 cm。标本石蜡包埋、切片、染色后阅片,进行H-E染色和免疫组织化学法(immunohistochemistry,IHC)检测。
1.3 定义
1.3.1 激素受体状态
采用IHC检测,细胞核阳性染色的肿瘤细胞占所有肿瘤细胞的比例≥10%定义为激素受体(hormone receptor,HR)阳性,<10%的肿瘤细胞核呈现不同程度的着色或完全无着色定义为HR阴性。
1.3.2 人表皮生长因子受体2(human epidemal growth factor receptor 2,HER2)状态
采用IHC检测,IHC 0或1+为HER2阴性,IHC 2+为HER2不确定,IHC 3+为HER2阳性。
1.3.3 微浸润
乳腺癌细胞突破基膜并侵犯临近组织,但病灶最大径不超过1 mm定义为微浸润,多灶性微浸润以其中最大浸润灶的直径作为判断浸润的标准。
1.4 统计学处理
采用SPSS 23.0软件进行统计分析,数值型变量根据其分布描述其均数、标准差或中位数、四分位间距,分类变量描述其百分比。组间率的比较采用χ2检验或Fisher精确概率法。采用二元logistic回归进行OR及其95% CI估计,采用后退法(最大似然比)进行变量筛选。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2.结果
2.1 病例特点
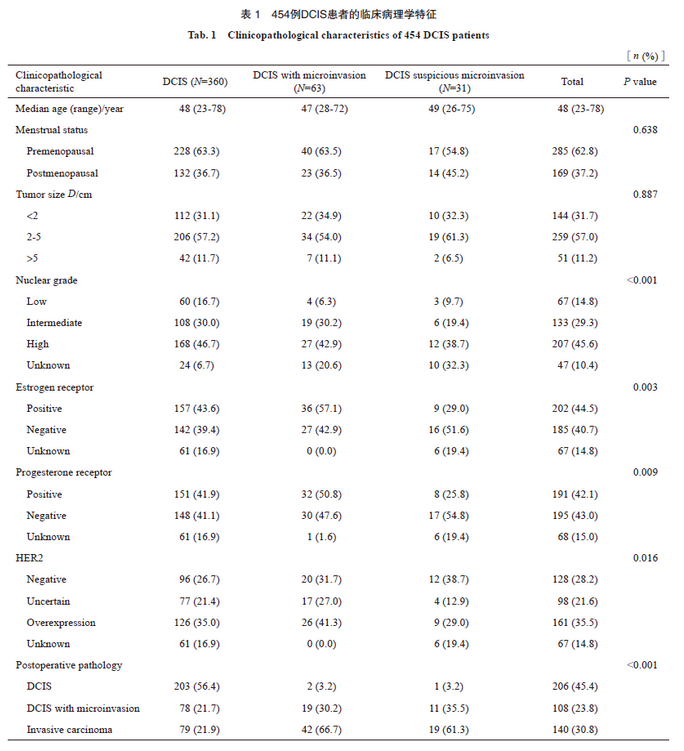
符合本研究筛选条件的病例共454例,其中CNB病理学诊断为单纯DCIS、DCIS伴微浸润和DCIS可疑微浸润的病例数分别为360、63和31例。DCIS伴微浸润和可疑微浸润两组中,术后病理升级为浸润癌的比例分别为66.7%和61.3%。单纯DCIS术后病理未升级的比例为56.4%,升级为微浸润癌和浸润癌的比例分别为21.7%和21.9%。DCIS伴微浸润或可疑微浸润两组术后诊断浸润癌的比例显著高于DCIS组(P<0.001)。各组的详细临床病理特征见表1。
2.2 单纯DCIS病理学低估的危险因素分析
根据Brennan等[6]和Park等[7]的研究加入发现方式、是否触及和超声表现3项临床特征,最终CNB诊断为单纯DCIS的360例患者中,临床病理学特征信息完整的患者共280例。采用χ2检验对临床病理学特征与病理学低估比例进行相关性分析。结果显示,肿瘤发现方式、肿瘤大小3 cm、核分级和HER2状态是病理学低估可能的影响因素,未发现肿瘤是否触及、超声表现和雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)状态与病理学低估有关(表2)。
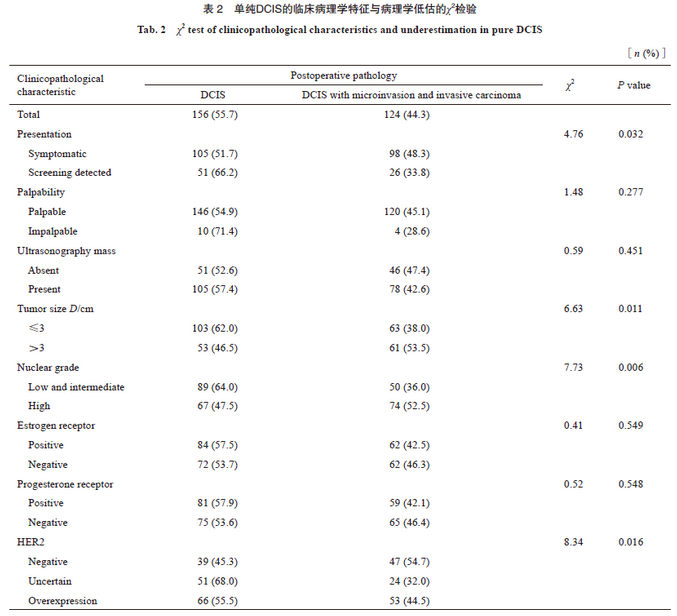
采用二元logistic回归对280例患者的4个相关因素与病理学低估的结果进行分析后发现,肿瘤>3 cm和核分级高发生病理学低估的风险,分别是肿瘤≤3 cm和核分级中低的1.97倍(95% CI:1.17~3.32,P=0.011)和2.30倍(95% CI:1.34~3.98,P=0.003),而HER2不确定(OR=0.37,95% CI:0.19~0.72,P=0.003)和阳性(OR=0.38,95% CI:0.20~0.73,P=0.004)发生病理学低估的风险低于HER2阴性患者(表3)。
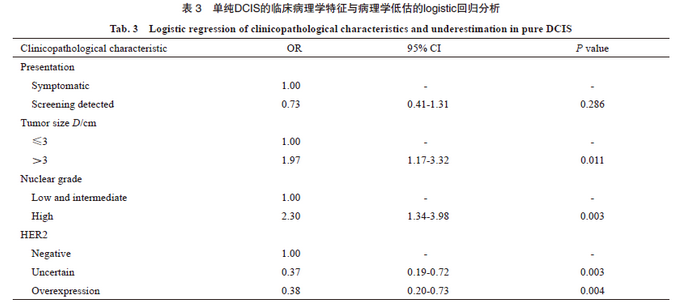
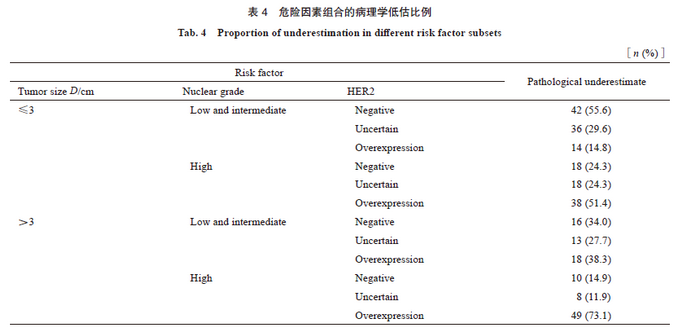
将肿瘤大小、核分级和HER2状态3个危险因素进行组合,计算各亚组的病理学低估比例。结果显示,当肿瘤>3 cm、核分级高、HER2阳性时CNB单纯原位癌的病理学低估比例最高,为73.1%;而当HER2不确定,其他条件不变时病理学低估比例最低,为11.9%(表4)。
3.讨 论
在以往的研究中,术前DCIS在术后升级为浸润性癌的危险因素包括肿瘤出现症状,可触及,体积大,钼靶可见钙化或致密肿块,超声可见肿物、分级高,磁共振成像(magnetic resonance imaging,MRI)肿块样强化、乳头乳晕复合体受累,空芯针类型和活检方式,核分级高,HER2过表达,Ki-67标记指数高,以及可疑微浸润等[6,8-15]。但是上述研究的病例数量不一,预测因素分散,部分结果甚至互相矛盾。因此尽管有研究提出了风险预测模型[11],但至今没有公认的预测标准。
本研究入组的患者采用国内使用最广泛的超声引导,相比钼靶X线检查更适合中国女性的致密型乳腺。由于钼靶X线检查和MRI所见在临床上与超声发现可能并非同一病灶,因此本研究选择相关因素时排除了钼靶X线检查和MRI影像表现。入组的63例穿刺DCIS伴微浸润和31例DCIS可疑微浸润,术后病理学诊断是微浸润和浸润性癌的比例之和均高达96.8%,因此这两类病例不纳入多因素分析,也提示这两者不能免除SLNB,这与Bertozzi等[16]的研究观点一致。
由于穿刺诊断DCIS的IHC指标不能指导系统性治疗,因此本研究入组的单纯DCIS中约15%的病例未检测ER、PR和HER2状态,另有少数早期的DCIS病理学诊断未明确核分级。最终280例资料齐全的穿刺单纯DCIS患者进入统计分析,结果发现,肿瘤最大径>3 cm和核分级高是DCIS病理学低估的危险因素,这两项危险因素也被国内外多个研究证实[6,8,11-12,14-15,17]。进一步分析上述研究,Kim等[8]和Kondo等[11]认为肿瘤大小>2 cm即为危险因素,Munck等[15]发现肿瘤>5 cm病理学低估的相对风险比肿瘤>2 cm更高,说明肿瘤体积越大,穿刺取材的局限性也越大,提示在做较大肿瘤穿刺时可考虑增加取材数量,以获取更准确全面的信息。Brennan等[6]和Lee等[14]的研究则发现核分级高是病理学低估的危险因素,与本研究结果一致。Co等[18]对DCIS的患者中位随访近9年,发现核分级高是术中切缘阳性的唯一独立危险因素,而切缘阳性又是局部复发的独立危险因素。说明高级别DCIS的生物学行为比中低等级DCIS活跃,更应考虑病理学低估和区域淋巴结转移的可能性。此外,国外至少3项研究认为HER2过表达是病理学低估的危险因素[11-12,19],但本研究中HER2阴性患者更易出现病理学低估,说明现有研究尚未充分了解DCIS肿瘤细胞的生物学行为与HER2状态的关系,需要进一步探讨。
其他因素中值得注意的是肿物是否可触及,国外至少有5项研究[6,8-10,13]认为可触及肿物是病理学低估的危险因素,但本研究中不可触及肿物的患者仅占所有患者的5%,远低于国外研究,差异无统计学意义,这显然与国内乳腺癌筛查普及程度较低、肿瘤发现较晚有关。
将肿瘤大小、核分级和HER2状态三项危险因素进行组合,病理学低估比例最高的亚组是肿瘤>3 cm、核分级高和HER2阳性,低估率达73.1%,其中HER2状态与本研究不符,但与以往研究中的危险因素均吻合,因此符合该亚组的病例局部治疗前应考虑先行SLNB评估腋窝淋巴结状态。低估率最低的亚组中同样包含了肿瘤>3 cm和核分级高两项危险因素,只有HER2不确定是保护因素,与本研究的多因素分析矛盾。而理论上病理学低估比例可能较低的亚组(肿瘤≤3 cm、核分级低、HER2不确定或阳性),实际低估率为29.6%和14.8%,其他亚组的低估率均高于14.8%,临床实践中难以接受,因此本研究未能找到可免除SLNB的亚组。
综上所述,本研究通过回顾性分析发现,超声引导下CNB确诊的DCIS伴微浸润或DCIS可疑微浸润病理学低估的比例远高于单纯DCIS,提示前两种类型的DCIS不能免除SLNB。多因素分析发现肿瘤>3 cm、核分级高和HER2阴性是CNB诊断的单纯DCIS出现病理学低估的危险因素,将上述危险因素组合后计算各亚组的病理学低估比例,结果表明单纯DCIS仍需行腋窝SLNB。
[参考文献]
VIRNIG B A, TUTTLE T M, SHAMLIYAN T, et al. Ductal carcinoma in situ of the breast: a systematic review of incidence, treatment, and outcomes[J]. J Natl Cancer Inst, 2010, 102(3): 170-178.
VAN DEURZEN C H, HOBBELINK M G, VAN HILLEGERSBERG R, et al. Is there an indication for sentinel node biopsy in patients with ductal carcinoma in situ of the breast? A review[J]. Eur J Cancer, 2007, 43(6): 993-1001.
KANBAYASHI C, IWATA H. Current approach and future perspective for ductal carcinoma in situ of the breast[J]. Jpn J Clin Oncol, 2017, 47(8): 671-677.
ZETTERLUND L, STEMME S, ARNRUP H, et al. Incidence of and risk factors for sentinel lymph node metastasis in patients with a postoperative diagnosis of ductal carcinoma in situ[J]. Br J Surg, 2014, 101(5): 488-494.
RUVALCABA-LIMON E, DE JESUS GARDUNO-RAYA M, BAUTISTA-PINA V, et al. Sentinel lymph node metastasis in patients with ductal breast carcinoma in situ[J]. Cir Cir, 2014, 82(2): 129-141.
BRENNAN M E, TURNER R M, CIATTO S, et al. Ductal carcinoma in situ at core-needle biopsy: Meta-analysis of underestimation and predictors of invasive breast cancer[J]. Radiology, 2011, 260(1): 119-128.
PARK J W, KO K H, KIM E K, et al. Non-mass breast lesions on ultrasound: final outcomes and predictors of malignancy[J]. Acta Radiol, 2017, 58(9): 1054-1060.
KIM J, HAN W, LEE J W, et al. Factors associated with upstaging from ductal carcinoma in situ following core needle biopsy to invasive cancer in subsequent surgical excision[J]. Breast, 2012, 21(5): 641-645.
PARK H S, PARK S, CHO J, et al. Risk predictors of underestimation and the need for sentinel node biopsy in patients diagnosed with ductal carcinoma in situ by preoperative needle biopsy[J]. J Surg Oncol, 2013, 107(4): 388-392.
GUILLOT E, VAYSSE C, GOETGELUCK J, et al. Extensive pure ductal carcinoma in situ of the breast: identification of predictors of associated infiltrating carcinoma and lymph node metastasis before immediate reconstructive surgery[J]. Breast, 2014, 23(2): 97-103.
KONDO T, HAYASHI N, OHDE S, et al. A model to predict upstaging to invasive carcinoma in patients preoperatively diagnosed with ductal carcinoma in situ of the breast[J]. J Surg Oncol, 2015, 112(5): 476-480.
LEE C W, WU H K, LAI H W, et al. Preoperative clinicopathologic factors and breast magnetic resonance imaging features can predict ductal carcinoma in situ with invasive components[J]. Eur J Radiol, 2016, 85(4): 780-789.
WATANABE Y, ANAN K, SAIMURA M, et al. Upstaging to invasive ductal carcinoma after mastectomy for ductal carcinoma in situ: predictive factors and role of sentinel lymph node biopsy[J]. Breast Cancer, 2018, 25(6): 663-670.
LEE K H, HAN J W, KIM E Y, et al. Predictive factors for the presence of invasive components in patients diagnosed with ductal carcinoma in situ based on preoperative biopsy[J]. BMC Cancer, 2019, 19(1): 1201.
MUNCK F, CLAUSEN E W, BALSLEV E, et al. Multicenter study of the risk of invasive cancer and use of sentinel node biopsy in women with a preoperative diagnosis of ductal carcinoma in situ[J]. Br J Surg, 2020, 107(1): 96-102.
BERTOZZI S, CEDOLINI C, LONDERO A P, et al. Sentinel lymph node biopsy in patients affected by breast ductal carcinoma in situ with and without microinvasion: retrospective observational study[J]. Medicine (Baltimore), 2019, 98(1): e13831.
司 婧, 全晨莲, 莫 淼, 等. 2006—2016年单中心1 557例乳腺导管原位癌腋窝处理方式回顾性分析[J]. 中华外科杂志, 2019, 57(9): 681-685.
CO M, KWONG A. Ductal carcinoma in situ of the breast-Long term results from a twenty-year cohort[J]. Cancer Treat Res Commun, 2018, 14: 17-20.
MUSTAFA R E, DESTEFANO L M, BAHNG J, et al. Evaluating the risk of upstaging HER2-positive DCIS to invasive breast cancer[J]. Ann Surg Oncol, 2017, 24(10): 2999-3003.



















共0条评论