[导读] 编译整理:强子
颅内肿瘤鉴别诊断实用方案(一)
颅内肿瘤鉴别诊断实用方案图例赏析
1. 颅神经的肿瘤
颅内肿瘤中,颅神经肿瘤相对罕见;两种主要类型为神经鞘瘤、恶性外周神经鞘膜瘤。神经鞘瘤典型情况下有A区和B区的结构,有Verocay小体,不过,小活检组织中有时和恶性外周神经鞘膜瘤鉴别困难。这种情况下可以加做免疫组化Ki-67,恶性外周神经鞘膜瘤增殖指数较高,同时恶性者p53阳性。
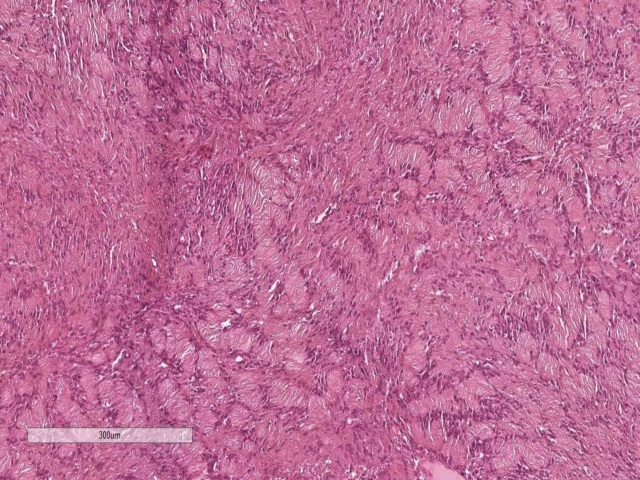
图1. 神经鞘瘤中Verocay小体的典型表现。
2. 鞍区肿瘤
对于鞍区肿瘤来说,手术记录及影像学所见会有很大帮助,尤其是激素水平异常的病例可能会进一步提示垂体腺瘤的具体类型。考虑垂体癌的时候,免疫组化Ki-67增殖指数高;颅咽管瘤则表达EMA、AE1/AE3、p53。
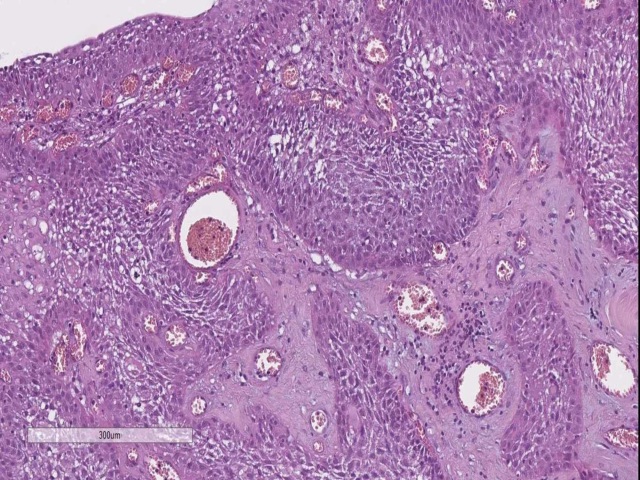
图2. 颅咽管瘤典型表现。
3. 脑膜肿瘤
脑膜的肿瘤有时鉴别也很困难,尤其是可向深部浸润直至脑实质的间变型者。手术记录及影像学结果有助于鉴别。如肿瘤为弥漫性,则远处转移而来的几率大,此时可结合病史并加做诸如EMA、AE1/AE3、Ki-67等。
脑膜瘤需根据组织学表现进行分级。WHO I级的脑膜瘤细胞学无异型性、或轻度异型性,无核分裂,并不侵犯脑实质;II级肿瘤可侵犯脑实质,核分裂可高达20个/10个高倍视野;III级肿瘤也可侵犯脑实质,细胞学具有异型性,核分裂超过20个/10个高倍视野,甚至可有肉瘤样分化。就脑膜瘤和转移性病变的鉴别而言,不管分级如何,脑膜瘤会表达vimentin、S100,高达70%的病例会表达EMA,但不表达AE1/AE3。
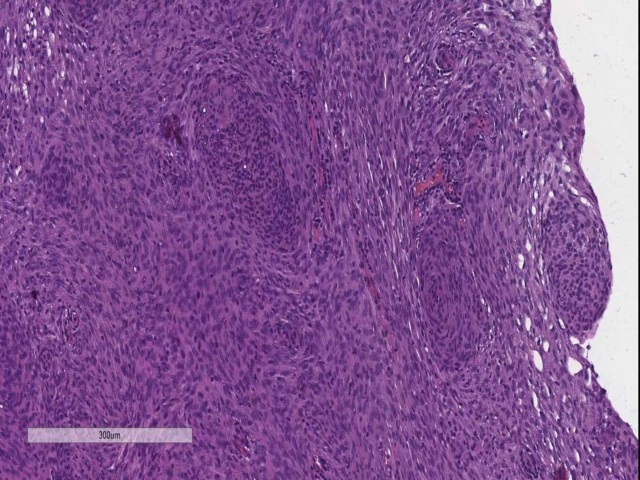
图3. WHO I级脑膜瘤,无核分裂,无脑实质侵犯。
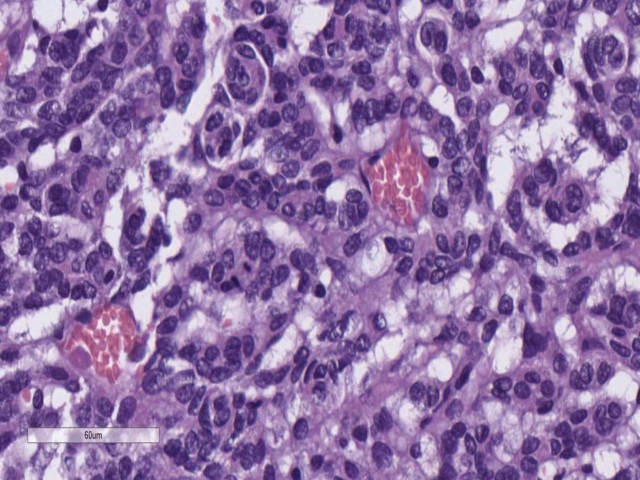
图4. WHO II级脑膜瘤。
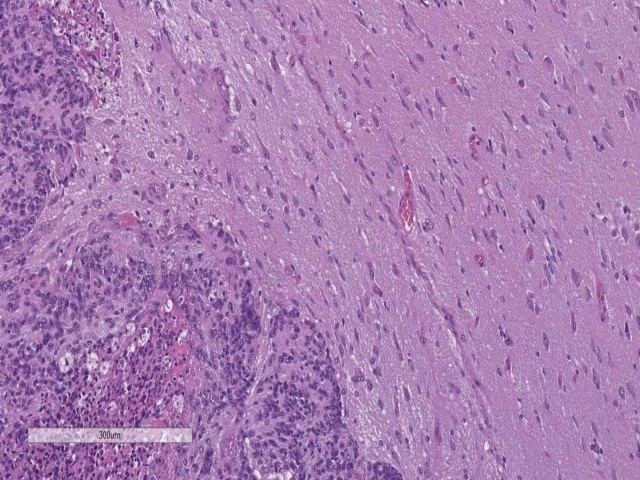
图5. WHO III级脑膜瘤,图示侵犯脑实质。
4. 起源于脉络丛的肿瘤
一般该组肿瘤见于儿童,部分为先天性病变。主要的两种肿瘤类型分别为良性的脉络丛乳头状瘤、以及恶性的脉络丛癌;二者的鉴别主要在于组织学表现,前者无细胞学异型性、无核分裂,与正常的脉络丛极为相似,而脉络丛癌则有一定程度上的细胞学异型性,且有核分裂。
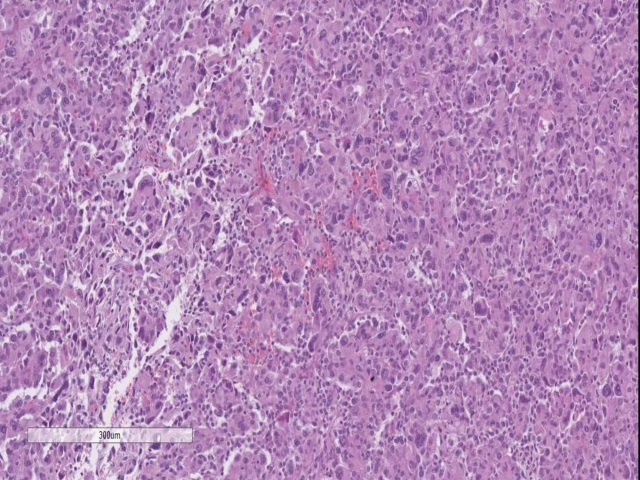
图6. 脉络丛癌。
5. 脑实质肿瘤
该组肿瘤有时候会因患者无法提供既往史等情况而鉴别困难;即使明确患者恶性肿瘤远处转移的情况,也要注意同时有中枢神经系统肿瘤的可能。另外,转移性肿瘤也可表现为境界清楚的肿物、多灶性肿物,但也可能在大体和影像学上表现为极似原发性肿瘤的单发病灶。该组肿瘤的鉴别诊断可从大体表现入手:
囊性病变
脑肿瘤中呈囊性者相对较少;其中最常见为转移性肿瘤,另一组多为囊性表现的肿瘤为WHO I级的毛细胞型星形细胞瘤,该肿瘤中有大量毛细胞,GFAP阳性,主要发生于儿童。此外还要注意中枢神经系统有部分非肿瘤性病变会表现为囊性,具体如包虫病、脓肿、表皮样囊肿、假性囊肿等
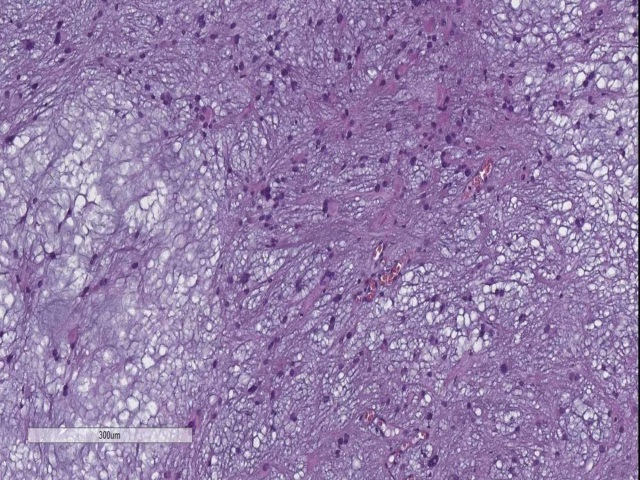
图7. 毛细胞型星形细胞瘤,WHO I级。
实性病变
关于该组肿瘤的鉴别诊断,一定要首先了解有无Scherer结构。德国病理医生Hans Joachim Scherer是中枢神经系统肿瘤病理专家,他确定了诸多HE切片中的组织学标准,也是神经胶质性肿瘤WHO分级的基础。所谓原发Scherer结构,是指局灶性的假栅栏状坏死,这是WHO IV级星型胶质细胞肿瘤-多形性胶质母细胞瘤的特征性结构。继发性Scherer结构是根据胶质性肿瘤的播散、生长、生物学潜能做出的组织学结构特征判定,具体如肿瘤细胞在软脑膜下呈栅栏状结构、肿瘤细胞在神经元及血管周围表现出的卫星现象(satellitosis)、肿瘤细胞在血管周围聚集(tractal aggregation)、肾小球样血管增生。
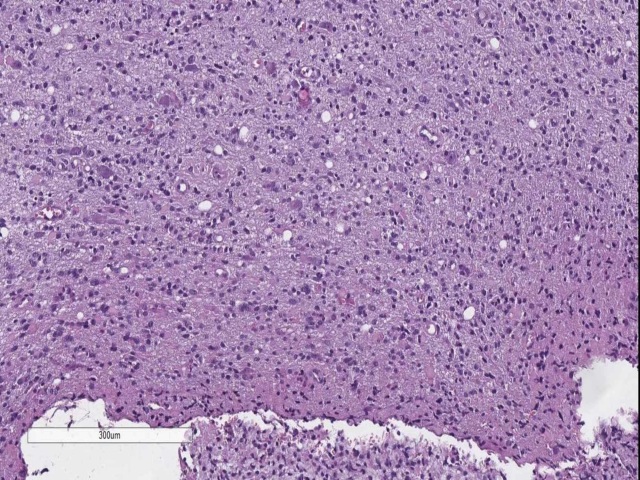
图8. 弥漫型星形细胞瘤,WHO II级。
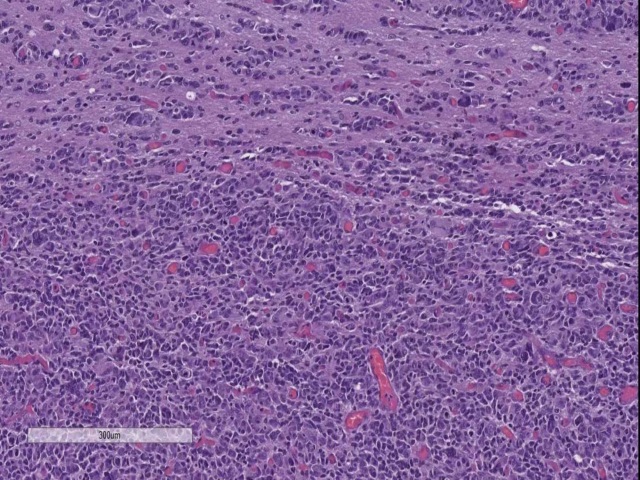
图9. 间变型星形细胞瘤,WHO III级。
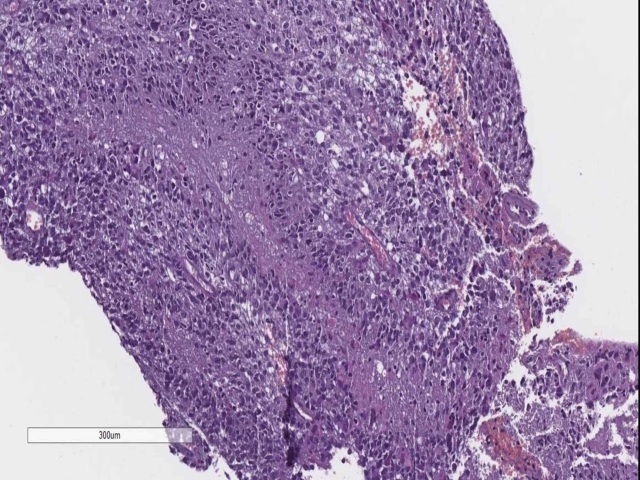
图10. 原发的Scheer结构,假栅栏状坏死。

图11. 肾小球样血管增生。
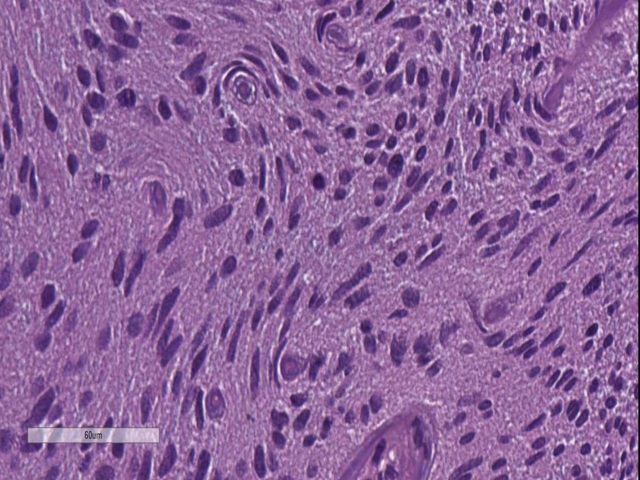
图12. 神经周围卫星现象。
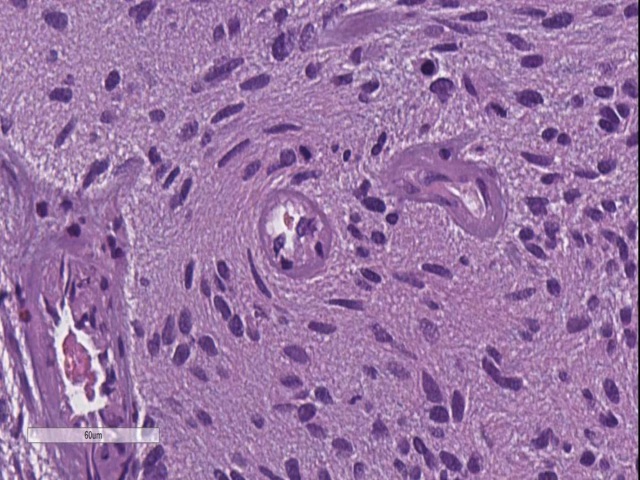
图13. 血管周围卫星现象。
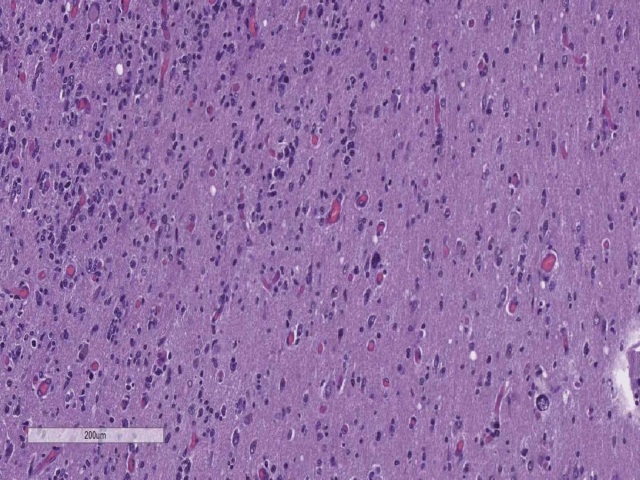
图14. 肿瘤细胞在血管周围聚集。
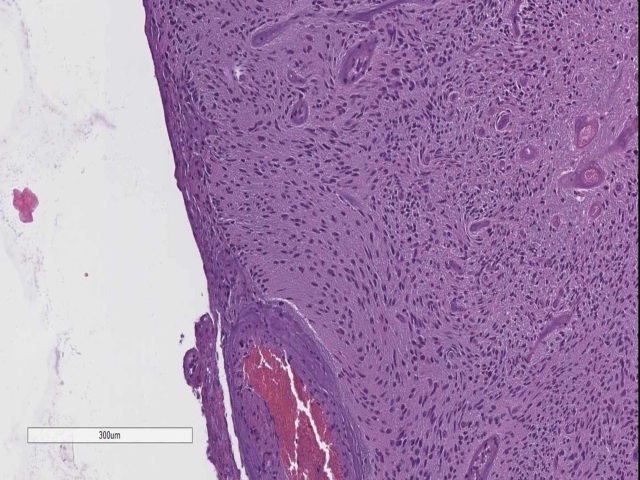
图15. 软脑膜下的栅栏状结构。
该组肿瘤中还需注意,虽然原发性Scherer结构是多形性胶质母细胞瘤的特征性改变,但该肿瘤中也可能出现继发性Scherer结构。多形性胶质母细胞瘤免疫组化GFAP、vimentin、S100阳性,但约2%的肿瘤会出现GFAP不表达;个别情况下会因为抗原相似性而出现EMA、AE1/AE3的阳性。与其他伴星形细胞分化的胶质性肿瘤一样,多形性胶质母细胞瘤的Ki-67增殖指数多变,因此不能仅凭这一指标来确定其WHO分级。
另一种伴原发或继发Scherer结构、但常诊断不足的肿瘤是胶质肉瘤,也是WHO IV的肿瘤。尽管该肿瘤与多形性胶质母细胞瘤有诸多相似,但其中有间质成分、伴肉瘤特征;此外,该肿瘤免疫组化弥漫阳性表达vimentin,GFAP仅在胶质成分有阳性表达。
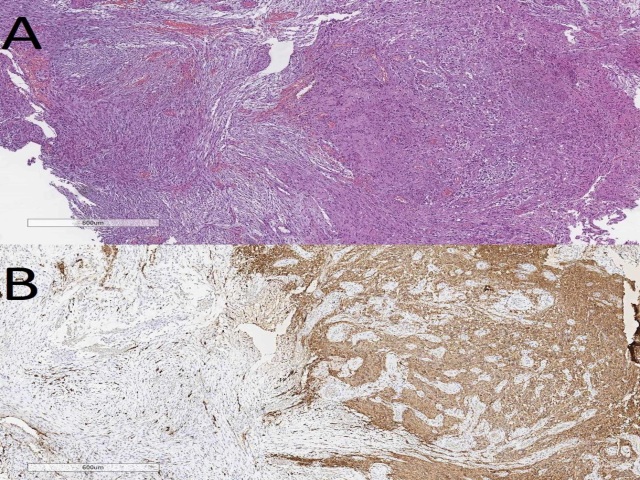
图16. 胶质肉瘤形态学表现,及免疫组化GFAP。
如HE切片中无原发Scherer结构,也不能排除胶质母细胞瘤的诊断。富于继发性Scherer结构的肿瘤应进行免疫组化检测,GFAP可勾勒出并不明显的假栅栏状坏死灶。如免疫组化中未能勾勒出这一结构,才可考虑诊断为WHO II级或III级的胶质性肿瘤。如肿瘤位于中线或基底节处,则应考虑弥漫性中线胶质瘤而不必考虑具体分级的情况。
HE切片及免疫组化中均无Scherer结构表现,此时应考虑到更加少见的原发肿瘤,如GFAP为阴性还应考虑转移性病变可能。肿瘤内有特殊的少突胶质细胞样成分,则应考虑到少突胶质细胞瘤、或少突星形细胞瘤,前者GFAP、OLIG2阳性,后者中少突胶质细胞成分OLIG2阳性,GFAP弥漫阳性且星形细胞成分表达更强。如Scherer结构确实或极少,加之无少突细胞成分,则应注意查找有无菊型团、假菊型团,并参考手术所见及影像学报告。

图17. 少突胶质细胞瘤。
伴菊型团的幕下肿瘤主要为髓母细胞瘤,该肿瘤Syn、NeuN阳性;少部分为伴多层菊型团的胚胎性肿瘤,此前也称之为原始神经外胚层肿瘤,该肿瘤Syn阴性,vimetin为斑片状阳性。此外,伴多层菊型团的胚胎性肿瘤其实更多见于幕上区。
其他伴菊型团或假菊型团的肿瘤还有室管膜瘤、室管膜下的肿瘤,这两组肿瘤均至少部分与脑室系统相连。一般室管膜瘤免疫组化表达vimentin、GFAP、EMA,而室管膜下的肿瘤免疫组化表达不一,也并无特异性指标,Ki-67增殖指数小于1%。
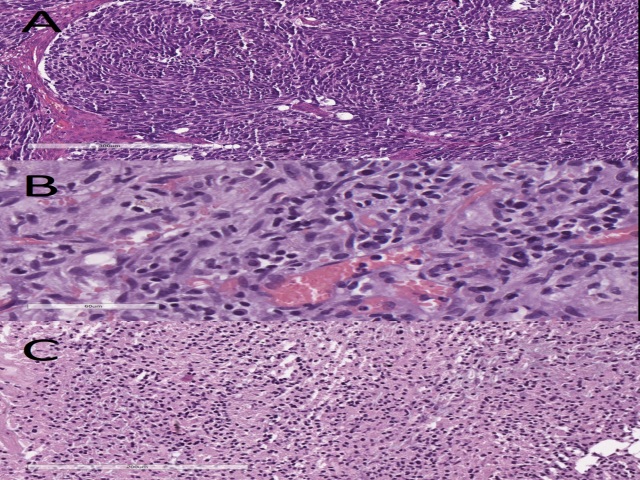
图18. (A)髓母细胞瘤;(B)伴多层菊型团的胚胎性肿瘤;(C)室管膜瘤。
6. 其他肿瘤
某些罕见肿瘤可能并不符合前述诊断方案,具体如原发性淋巴组织增生性疾病或系统性淋巴组织增生性疾病的累及、造血系统恶性肿瘤的累及、间质性肿瘤、成松果体细胞瘤,以及可能相对容易诊断但却罕见的肿瘤,如中枢神经系统原发的脂肪瘤等。
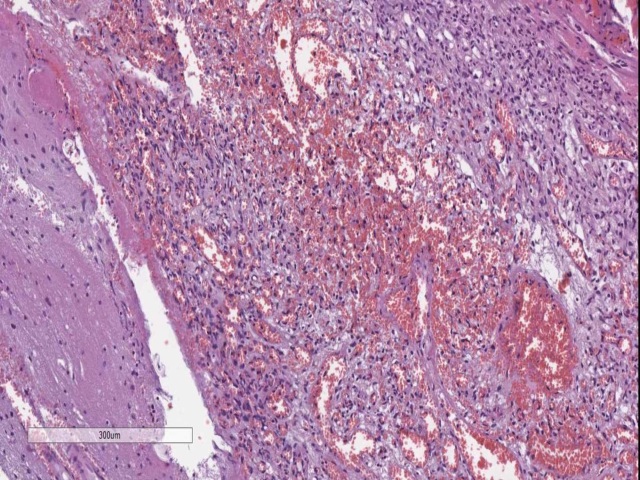
图19. 血管母细胞瘤。
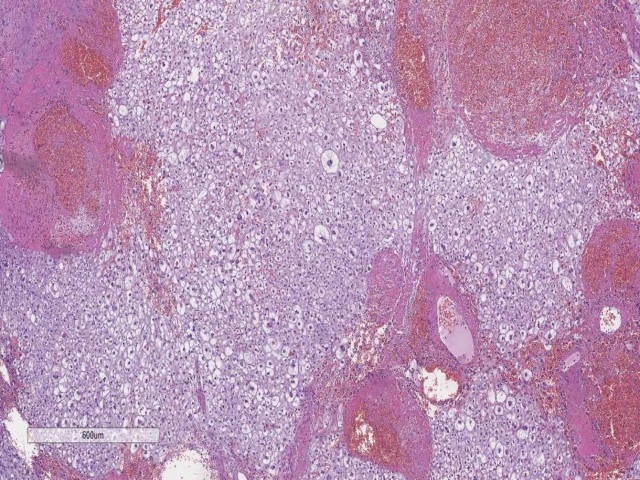
图20. 颅内的脊索瘤。
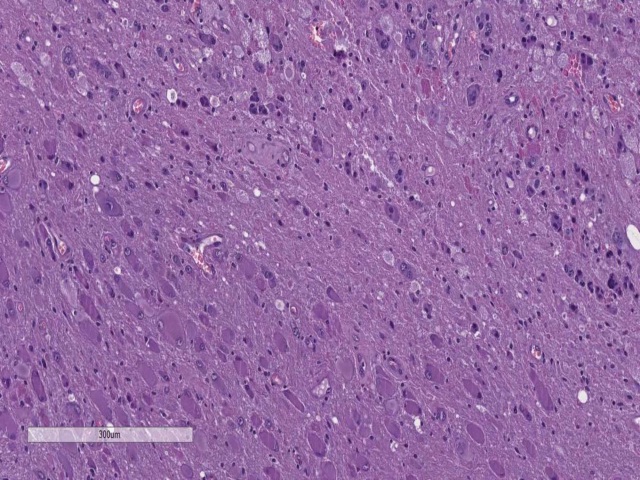
图21. 神经节细胞胶质瘤(ganglioglioma)。
点击下载英文文献
参考文献
Stoyanov G S, Petkova L, Dzhenkov D L (December 15, 2019) A Practical Approach to the Differential Diagnosis of Intracranial Tumors: Gross, Histology, and Immunoprofile-based Algorithm. Cureus 11(12):e6384.
DOI 10.7759/cureus.6384


































共0条评论