[导读] 来源:iNature;原创:叶子
固有淋巴细胞(innate lymphoid cells, ILC)是不表达重排受体的淋巴细胞,并且在先天免疫中具有重要的效应和调节功能。ILC家族不仅包括经典的细胞毒性自然杀伤细胞(natural killer cells, NK cells)和淋巴组织诱导细胞(lymphoid tissue inducer cells, LTi cells),也包括了最近发现的辅助性固有淋巴细胞(helper innate lymphoid cells, helper ILCs)。辅助性ILC家族的所有成员都表现为经典的淋巴细胞形态,表达辅助性ILC相关的转录因子以及表面标记CD127和IL-1R等,但不表达其他免疫细胞的表面标记分子(包括T细胞、B细胞、NK 细胞、髓系细胞、粒细胞、造血干细胞、树突状细胞、浆细胞等);因此,这些细胞被定义为谱系阴性细胞(lineage-negative cells)。每一种辅助性ILC都有其独特的细胞因子分泌模式并且与辅助性T细胞(helper T cells, Th)的分泌特征呈“镜像对称”,因此,基于辅助性T细胞命名法将辅助性ILC分为3大类:ILC1(镜像对称Th1细胞),依赖于转录因子T-bet并产生IFN-γ; ILC2(镜像对称Th2细胞)依赖于转录因子GATA3并产生2型细胞因子,主要是IL-4、IL-5、IL-9和IL-13; ILC3(镜像对称Th17/Th22细胞)依赖于转录因子RORγt并产生IL-17/IL-22。
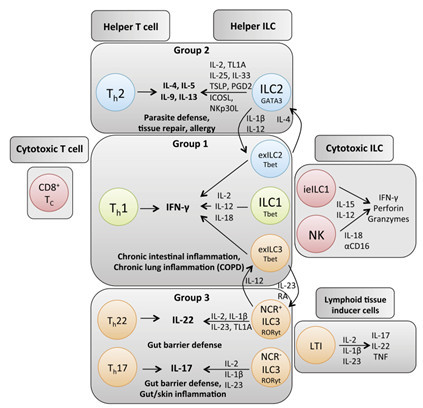
就像其他免疫细胞一样,辅助性ILC是否存在其对应来源的恶性肿瘤呢?近日,在最新一期的欧洲病理杂志《Virchows Archiv》上发表了一篇由中国学者报道的疾病“Lineage-negative lymphomawith a helper innate lymphoid cell phenotype”,该论著被列入杂志的“病理学精品”热点专题(Topical Collection on Quality in Pathology)。该文章在世界上首次报道了可能起源于辅助性ILC的淋巴瘤病例,该病例根据最新的WHO分类标准不能被归为任何已知的血液系统恶性肿瘤疾病实体。该研究填补了辅助性ILC来源恶性肿瘤的空白,对血液系统肿瘤的分类、诊断和治疗具有重要的理论和临床意义。该文第一作者为空军军医大学西京医院病理科李明阳博士,通讯作者为空军军医大学西京医院病理科王哲教授以及西京医院血液科梁蓉教授。

该病例是一位17岁的男性患者,多发淋巴结肿大一月余。淋巴结活检发现大量的单形性的异型细胞呈散在或者片状分布,核仁明显,胞浆丰富,背景中存在大量的组织细胞和反应性的淋巴细胞。免疫组化发现肿瘤细胞表达LCA和CD79a,但不表达其他谱系标志物,IG和TCR重排阴性。令人意外的是,肿瘤细胞高表达辅助性ILC的表面标志物CD127、IL-1R、ST2、IL-17Rβ、RANKL以及转录因子GATA3,还同时表达辅助性ILC相关的细胞因子IL-4 和GM-CSF。在肿瘤微环境中存在大量的PD-L1/PD-L2阳性的组织细胞和FOXP3阳性的Treg细胞。p53免疫组化弥漫强阳性,TP53基因测序发现存在5号外显子的序列替换。RNA测序和全外显子测序发现新的IGLV2-14/IGLL5基因融合以及大量抑癌基因突变或缺失,如PTPRB、PPP2CB、UPK1A等。该肿瘤临床侵袭性高,进展迅速,对多种化疗方案无反应,患者在发病6月后死于骨髓侵犯。
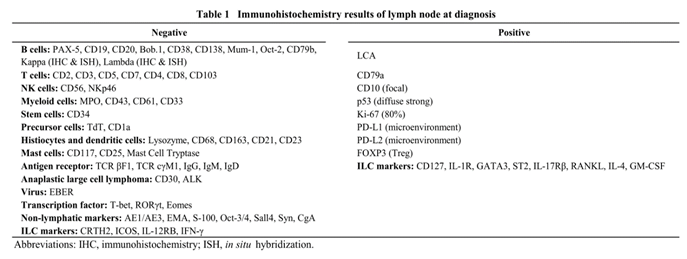
该病例鉴别诊断时最令人困惑的是肿瘤细胞高表达CD79a,这是一个B细胞的经典标志物。但是,在外周T细胞淋巴瘤、急性淋巴母细胞性白血病以及急性髓系白血病中均存在CD79a的异常表达,有研究推测可能是存在某种非特异抗原表位的交叉反应。在本例中,作者使用了CD79a的4种抗体(识别不同抗原表位)进行免疫组化检测,均呈强阳性表达,表明肿瘤细胞的CD79a的异常表达不是由于非特异的交叉反应。然而,与CD79a配合启动B细胞抗原受体复合物信号的CD79b在该病例呈阴性,B细胞表面标志物(CD20、CD19),B细胞相关转录因子(PAX-5、Bob.1、Mum-1、Oct-2),免疫球蛋白(IgG、IgM、IgD)以及IG单克隆重排均呈阴性,进一步表明该肿瘤不起源于B细胞,CD79a仅仅是一种肿瘤细胞的异常表达。
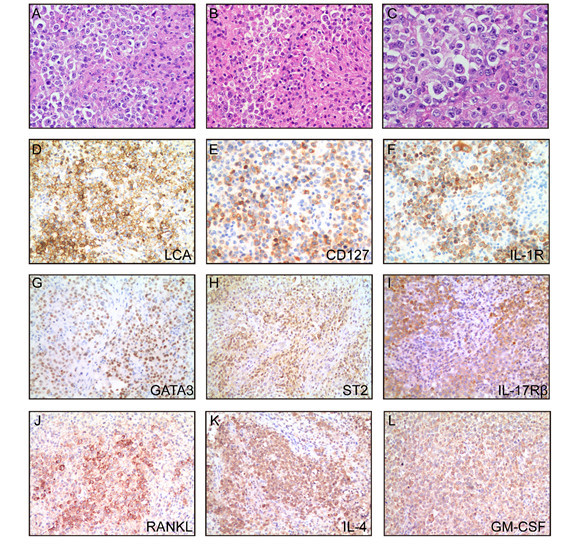
关于该肿瘤所属的辅助ILC亚群,由于肿瘤细胞表达ILC2的特异性转录因子GATA3,并且ILC2的表面标志物ST2和IL-17Rβ以及ILC2相关细胞因子IL-4呈阳性表达,故文章推测该肿瘤来源于ILC2。然而,肿瘤细胞还表达ILC3的标志物RANKL和GM-CSF,可能是由于ILC各亚型之间存在可塑性以及表型转换。文章还对该病例的发病机理进行了初步探讨,发现一系列抑癌基因的失活(TP53、PTPRB、 PPP2CB、UPK1A等),肿瘤微环境中存在大量的免疫抑制细胞(PD-L1/PD-L2阳性的组织细胞和FOXP3阳性的Treg细胞)以及IGLV2-14/IGLL5基因融合可能对该肿瘤的发生发展起了一定的促进作用。

由于文章仅收集并研究了一例该类肿瘤,因此目前还不能够充分说明起源于辅助性ILC的淋巴瘤是一种新的疾病实体。在未来,希望能够发现更多相似的病例,明确该类疾病的生物学本质,使其真正成为一种新的肿瘤类型。
参考消息:
https://link.springer.com/article/10.1007%2Fs00428-019-02658-x


















共0条评论