【指南与共识】中国临床肿瘤学会(CSCO)持续/复发及转移性分化型甲状腺癌诊疗指南-2019
前言
基于循证医学证据、兼顾诊疗产品的可及性、吸收精准医学新进展,制定中国常见癌症的诊断和治疗指南,是中国临床肿瘤学会(CSCO)的基本任务之一。近年来,临床诊疗指南的制定出现新的趋向,即基于诊疗资源的可及性,这尤其适合发展中或地区差异性显著的国家和地区。中国是幅员辽阔,地区经济和学术发展不平衡的发展中国家,CSCO指南需要兼顾地区发展差异、药物和诊疗手段的可及性以及肿瘤治疗的社会价值三个方面。因此,CSCO指南的制定,要求每一个临床问题的诊疗意见,需根据循证医学证据和专家共识度形成证据级别,同时结合产品的可及性和效价比形成推荐等级。证据级别高、可及性好的方案,作为Ⅰ级推荐;证据级别较高、专家共识度稍低,或可及性较差的方案,作为Ⅱ级推荐;临床实用,但证据等级不高的,作为Ⅲ级推荐。CSCO指南主要基于国内外临床研究成果和CSCO专家意见,确定推荐等级,便于大家在临床实践中参考使用。CSCO指南工作委员会相信,基于证据、兼顾可及、结合意见的指南,更适合我国的临床实际。我们期待得到大家宝贵的反馈意见,并将在更新时认真考虑、积极采纳合理建议,保持CSCO指南的科学性、公正性和时效性。
中国临床肿瘤学会指南工作委员会
2019年1月

1.持续/复发及转移性分化型甲状腺癌的诊断及动态评估
甲状腺癌以其发病率逐年增高日益引人关注,根据 2018年数据,全球甲状腺癌发病率为 6.7/ 100000,我国每年新增病例达 19万(194232例)。 值得注意的是,SEEr数据库显示美国甲状腺癌患者的 5年生存率高达 98.1%,而我国这一数据仅为 84.3% ,这提示中国甲状腺癌患者的死亡风险不容忽视,同时也意味着我国的相关临床医生将会接诊更多的晚期患者。
分化型甲状腺癌主要包括甲状腺乳头状癌、甲状腺滤泡癌、Hürthle细胞癌,共占甲状腺癌的 94%,由于其在一定程度上保留了甲状腺滤泡上皮细胞的功能,如钠碘转运体的表达及摄碘、分泌甲状腺球蛋白、依赖于促甲状腺激素生长的方式等,使得放射性碘131(131 I) 治疗、Tg在复发中的监测及 TSH抑制治疗在 DTC 中具有独特、要的作用。虽然多数DTC经过规范 化的手术、131 I治疗及 TSH抑制治疗后预后较好,但 仍有 14.9%的患者存在疾病持续/复发,7% ~ 23%的患者出现远处转移,这类复发及转移性DTC的处置一直是临床关注的重点。2009年美国甲状腺学会(ATA)指南中首次提出有关 DTC复发风险分层体系,该分层主要纳入了病灶大小、病理亚型、包膜及血管侵犯程度、淋巴结转移、远处转移、131I治疗后全身显像等权重因素 。此后,随着M Xing 等有关分子特征如 BRAFV600E与DTC复发及侵袭性的深入研究 ,以及 GW Randolph等有关淋巴结侵袭特征与复发风险的研究,2015年ATA指南对此复发风险分层又进行了更新,将 BRAF等分子特征以及淋巴结侵犯特征等因素细化地纳入了风险分层;应指出,在 ATA复发风险分层的权重因素之外,患者的一般特征(如年龄、性别)、初始手术、131I治疗、TSH抑制治疗、肿瘤病理特征及分子特征,如BRAF、TERT基因突变等多种因素均影响着 DTC的复发和转移。研究显示,由于生长缓慢等因素,有关 DTC复发或前期治疗后肿瘤持续的概念仍很难界定与区分,有研究将维持无病状态1年以上又出现新的病灶界定为复发,反之则为持续,但该界定仍存争议。持续/复发病灶可以出现在甲状腺床,也可以通过淋巴道、血行或种植等途径出现在甲状腺床以外的部位,如颈部区域淋巴结转移、远处转移等。本指南旨在针对持续/复发及转移性的诊断、治疗及评估进行阐述和推荐。

【注释】
a.prmDTC的诊治应重视多学科团队的作用,推荐有条件的单位将此类患者的诊疗纳入 MDT管理。
b.MDT的实施过程中由多个学科的专家共同分析患者的病史、临床表现、影像、病理和分子生物学资料,对患者的一般状况、疾病的诊断、分 期/侵犯范围、发展趋向和预后作出全面的评估,并根据当前的国内外治疗规范/指南或循证医学依据,结合现有的治疗手段及患者意愿,为患 者制定最适合的整体治疗策略。
c.MDT原则应该贯穿每一位患者的治疗全程。
d.MDT团队应根据治疗过程中患者病情的变化、对之前治疗的反应而适时调整治疗方案,以期最大幅度地提高治愈率、改善生活质量和延长
患者的生存。
【注释】 a.Tg的监测有助于进行术后评估及风险分层。在全甲状腺切除后,无 TgAb干扰下,低血清 Tg水平具有较高的阴性预测价值, 如 TSH抑制状态下 Tg检测不到(﹤0.2ng/ml)或刺激性 Tg﹤1ng/ml,预示疾病很可能达到完全缓解;Tg水平增高(如抑制性 Tg>1ng/ml)则提 示存在疾病持续/复发的可能。而与131I-全身显像显示残余甲状腺不匹配的可疑增高刺激性 Tg水平可能提示远处转移的存在,由于受到残余甲状腺组织、血清 TSH及 TgAb水平等因素的影响,目前尚无明确的最佳131I治疗 前ps-Tg界值点用以指导131I治疗决策,国内有关ps-Tg预测成人远处转移的最佳界值为 52.75ng/ml,儿童为 156ng/ml,这将有助于 为及时修正患者的131I治疗剂量、避免治疗不足提供分子证据。Tg在131I治疗前预测疗效及动态疗效评估也有其价值,近期我国学者采用兼顾 血清学及影像学的治疗疗效评估体系探索 Tg与131I治疗疗效的关系,显示ps-Tg水平对 DTC患者的治疗反应具有预测价值,ps-Tg>26.75ng/ ml时对治疗后结构性疗效不佳病灶具有较好的预测价值,为131I治疗前评估、特别是高ps-Tg者
131I治疗剂量的 合理定制提供了依据。在手术、131I等治疗后动态监测 Tg的变化,有助于判断131I治疗疗效,对于远处转移性 DTC患者 Tg动态监测还有助 于预测碘难治性 DTC的出现。
b.甲状腺球蛋白抗体的存在会降低通过化学发光免疫分析方法检测血清 Tg的测定值,从而影响通过 Tg监测病情的准确 性,故须同时监测 Tg和 TgAb水平的变化,并动态分析,在治疗前 TgAb明显增高者,TgAb的下降提示手术及131I治疗有效。TgAb的中位清 除时间约 3年,对治疗后 TgAb持续不降或下降后再次升高者,应进行相关影像学检查。
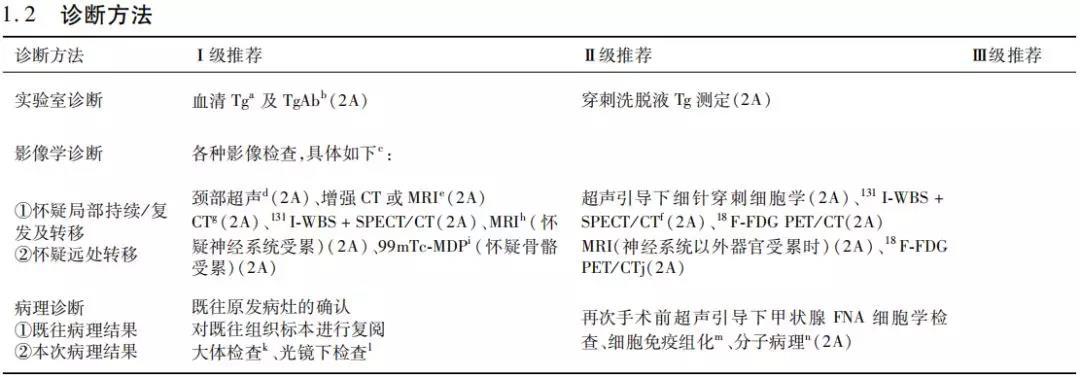
c.对于 prmDTC患者,建议采用多种影像学检查,以便准确评估疾病状态。其中超声是一线检查手段。
d.超声检查应采用高分辨率超声仪器,并由有甲状腺超声检查经验的医生进行操作。颏下至锁骨上、胸骨上后方均是扫查范围,采用横切 面及纵切面扫查侧方和中央区,可疑部位使用多切面及多普勒扫查。需特别关注咽后、咽旁及气管食管沟区域。颈部超声评估内容包括颈部 淋巴结、甲状腺床、颈部软组织、血管及气管食管。其主要超声成像特点如下(图 1):

超声不易区别甲状腺床良性病变(术后瘢痕、缝线肉芽肿、食管气管憩室、断端神经瘤以及炎性反应增生性淋巴结等)和复发病灶。超声图像的正确解释需结合临床病史和化验指标。如超声发现局部恶性或可疑恶性病灶,应加做颈部增强 CT检查;甲状腺全切术后,超声评估时机应根据患者的复发风险分层和动态疗效评估进行。1~3个月内超声评估应对比术前临床及影像学资料,判断外科手术是否达到预期目标;清甲后 3个月,评估病灶大小及清甲疗效;1~5年内,低危和中危患者/Er和 IDr患者不必要每年一次超声检查;高危患者,推荐每年 1~2次超声检查;术后 >5年,低危和中危患者/Er和 IDr患者:不再推荐规律超声检查;再 5年之后,行第 2次风险评估,之后的随访间隔取决于该次评估结果;对于高危患者同前。甲状腺侧叶切除术后 6~12个月第 1次评估根据疾病复发风险,定期行超声检查;当超声检查发现了异常回声区(甲状腺床可疑复发病变及颈部可疑淋巴结肿大),经验丰富的医师仍难以明确诊断时,可采取超声导引下细针穿刺活检或FNA-Tg检查。对于超声可疑淋巴结最短径线≥8~10mm时可行FNA细胞学检查和FNA-Tg;对于超声不确定淋巴结,应结合患者分期、病史、结节大小、部位、血清 Tg水平,评估是否行 FNA细胞学检查和 FNA-Tg;短径 ﹤5~7mm的淋巴结评估困难,可能 FNA临床意义有限;甲状腺床可疑超声病变,可疑病变大于 8mm,可行 FNA细胞学检查和 FNA-Tg。如病灶较小且监测径线稳定,可观察。由于实验室条件不同,操作者手法、测定方法及测量仪器也不同,FNA-Tg的阳性值标准并不一致。2013年欧洲指南和 2011年法国甲状腺内分泌研究组的专家共识对甲状腺术后 FNA-Tg的建议诊断阳性值是:Tg﹤1ng/FNA:正常,Tg=1~10ng/FNA(需要同细胞学检查对比),Tg>10ng/FNA:提示淋巴结内或甲状腺床存在肿瘤组织(TgAb过高会干扰 FNA-Tg的测量,导致虚假的 FNA-Tg低水平表达)。受到标本量和穿刺经验是否丰富的限制,并且目前临床意义不明,不做为常规推荐。
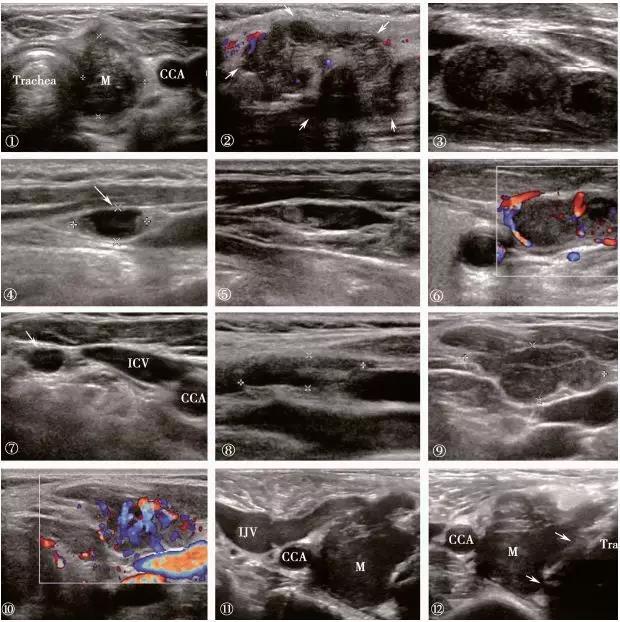
图 1 ① ~②甲状腺床局部复发:①甲状腺乳头状癌术后,横切面显示左侧甲状腺床低回声结节,纵横比大于 1;②纵切面显示肿瘤内可见血流信号;③ ~⑥可疑转移淋巴结:③淋巴结门消失,部分囊性变;④淋巴结内大部分囊性变;⑤淋巴结内可见高回声;⑥淋巴结边缘型血流;⑦不能确定性质的淋巴结:Ⅲ区淋巴结,短轴长约 5mm;⑧正常淋巴结;⑨ ~⑩肌肉软组织复发;K静脉瘤栓:右侧甲状腺床肿瘤组织延伸至右侧颈内静脉;L气管受侵:右侧甲状腺乳头状癌术后复发,侵及气管。(m:肿瘤;IJV:颈内静脉;CCA:颈总动脉;Trachea:气管)
e.颈部增强 CT或 mrI有助于评估超声可能无法完全探及的部位,如纵隔和Ⅱ区淋巴结,或者 Tg阳性而超声检查阴性时。转移性淋巴结在 CT中常表现为平扫点状钙化,增强时不均匀强化、囊变或坏死。此外,颈部增强 CT联合 US检查较单独 US检查可以更准确的检出DTC的复发病灶,帮助明确是否存在更多潜在 prmDTC病灶。颈部增强 CT或 mrI还有利于评估复发病灶或淋巴结与周围结构及器官的相对关系,如气管、食管、颈动脉鞘的关系,为手术范围提供帮助。
f国内临床尚无123I和124I,放射性碘显像所用核素为131I。131I-WBS可发现具有摄碘能力的病变,用于评估甲状腺残留复发和转移病灶的摄碘情况,判定其治疗效果。对摄碘部位进行 SPECT/CT显像,有助于判断摄碘部位的性质,排除假阳性摄取。
g.怀疑肺转移者应行 CT检查,以评估肺转移病灶部位,大小,数量,并结合治疗后131IWbS,部分肺转移性 DTC患者可能存在 CT不能发现的微小病灶(直径 ﹤1mm),而131IWbS表现为弥漫放射性浓聚。
h. MRI具有良好的软组织分辨率,是探查肿瘤脑脊髓转移的常规影像检查项目。
i . DTC骨转移应行骨扫描,但其诊断效能高低与转移病灶骨代谢活跃程度有关,且骨扫描发现病灶数目和范围可能低于131I-WBS。
j. PET/CT常用放射性药物为18F-FDG。虽然不推荐18F-FDG PET/CT作为DTC初诊的常规检查,但是对于复发和转移的高危病人,如有条件可以考虑,特别是经131I清甲治疗后Tg或TgAb持续升高,而131I-WBS全身显像阴性,超声,CT或MRI等影像学也无阳性发现时。
k. 大体检查应包括以下内容:标本类型、肿瘤部位、肿瘤大小、大体形态、肿瘤与毗邻组织结构的关系、淋巴结检出数目、大小和分组。
l. 光镜检查应包括以下内容:需参照2017年新版WHO甲状腺肿瘤分类明确组织学类型及亚型、肿瘤大小、侵及范围、腺内播散、切缘、脉管侵犯、神经侵犯、淋巴结转移数和总数、TNM分期。对形态学为PTC的病例,在可能的情况下进一步回报可能提示不良预后的组织学亚型,如高细胞亚型、柱状细胞亚型、弥漫硬化型及靴钉亚型等;如所含对应肿瘤成分达不到某一亚型的诊断标准,应注明提示不良预后的组织学亚型所占比例。对形态学为FTC的病例,需尽可能评估血管内癌栓数量。
m. 常用的用于提示起源的免疫组化标记物包括CK、Tg、TTF-1、TTF-2、PAX-8、Syn、CgA、Calcitonin和CEA等。常用的提示良恶性的免疫组化标记物包括:galectin-3、HBME-1、CK19、CD56、TPO、E-cadherin、p27、cyclinD1、P53、Ki-67指数等。
n. 常用的分子标记包括BRAFV600E、NRAS 61号密码子、HRAS61号密码子及KRAS 12/13号密码子突变,RET/PTC及PAX8/PPARã重排等。常用的提示预后不良的分子标记包括BRAFV600E、TERT启动子、TP53。其中,多篇研究证实,BRAF与TERT启动子共突变与PTC的侵袭性、复发、死亡风险及发生碘难治性甲状腺癌的风险等密切相关,这些研究使分子特征驱动的DTC风险分层及个体化治疗决策令人期待。
2.持续/复发及转移性分化型甲状腺癌多学 科综合治疗
2.1治疗基本原则
对于prmDTC的治疗方案包括手术切除、对可摄取131 I的病灶行131 I治疗、外照射治疗、L-T4抑制 治疗下的随诊观察、试验性治疗(如靶向药物、射频消融及经皮超声引导乙醇注射)等。其中,对于有 手术指征且可以手术切除的病灶应首选手术治疗。
2.2外科治疗
prmDTC临床中常见,其中约 95%都发生在颈部,侵犯重要结构少见。在疾病持续/复发的患者中,颈部或纵隔淋巴结转移占 74%,甲状腺残叶的复发占20%,气管或邻近肌肉的受累占 6%。因再次手术的难度、风险明显增加,所以选择再次手术时,始终要权衡手术风险和获益,在减少医源性损 伤的同时降低肿瘤复发和死亡风险。手术时机的选择和手术范围的确定是外科医生在诊治这类病人时 需要重点考虑的问题。外科治疗的目标是尽可能治 愈或控制疾病、改善生存,并保留重要器官的功能。 应由具有丰富临床经验的甲状腺专科医师进行手 术,有时需胸外科、血管外科、耳鼻喉科 (头颈外科)、骨肿瘤科、整形外科、ICU的多科协作,在肿瘤侵犯重要结构的病人中,尽可能切除肉眼可见的肿 瘤对于控制肿瘤局部复发十分重要。研究表明,手 术次数对预后有明显影响,三次以上手术的患者预后更差。
2.2.1 手术治疗前专科临床评估
手术前专科临床评估包括既往治疗情况的回 顾、目前疾病状态和重要器官功能的评价,这些是决 定再次手术与否和手术范围的基础。结构性病灶是 再次手术的靶病灶,因此对外科医生来说,术前影像 学检查是最重要的评估内容,需明确是否存在结构 性病灶并定位病灶。

【注释】
a. 手术前评估内容及考虑:外科手术治疗主要针对能够经影像学检查识别的结构性复发病灶,通常通过FNA明确诊断后、进行手术。决定手术前,应了解既往手术、肿瘤分期以及喉返神经、甲状旁腺功能等情况,同时,还应结合患者的年龄、合并症以及甲状腺癌全身播散情况,权衡并告知患者再次手术的风险和获益,制定合理的手术方案。若患者有更严重威胁生命的合并症、甲状腺癌已经全身广泛播散或局部病灶无法切除时,应慎重决定是否实施针对局部持续/复发及转移病灶的再手术。若其仅为缓解局部严重并发症的姑息性手术,此类手术应尽量缩小手术范围、控制手术并发症的发生。

【注释】
a. 无周围组织侵犯的中央区病灶:约1/3的术后病人甲状腺床区可以发现结节,其中结节较小(<11mm)的病人仅有少部分(<10%)在随诊中出现结节增大,且最终病理证实为甲状腺乳头状癌的比例亦很低(<5%);而在以病灶≥6~10mm作为再手术标准时,其病灶控制率仍可达到98%。因此,对于甲状腺床区较小的病灶,可以密切随访,当其出现增大时再进行手术;以病灶≥8mm作为分界,既可以避免漏掉可能会进展的病灶,又能在FNA穿刺诊断、手术中定位病灶时有较大的把握。在决策手术时,还应考虑以下因素:病灶的位置(是否邻近重要结构),Tg的倍增时间(<1年和可能<3年),是否呈18F-FDG PET显像阳性,既往手术范围、并发症(甲旁减、喉返神经麻痹),原发病灶是否为恶性程度高的亚型等情况。
b. 无周围组织侵犯的颈侧区病灶:研究表明,超声怀疑颈侧区有可疑转移淋巴结的患者,在多年的随诊过程中仅约9%出现淋巴结长径增长>5mm。因此,对于颈侧区较小(<10mm)的病灶,仍可密切随访。但若颈侧区持续/复发或转移淋巴结邻近颈总动脉,应早期给予干预,以免肿瘤增大包绕颈总动脉可能使患者失去手术机会。
2.2.3 病灶侵犯周围重要结构的局部持续/复发及转移病灶的外科治疗策略
Prm-DTC病灶相对有较高的机会可能粘连、侵犯周围的重要结构,如喉、气管、食管、颈血管和重要的神经,如喉返神经、迷走神经、交感神经、膈神经、臂丛神经等。对于此类病灶的手术切除范围一直存在争议,但是切除肉眼可见的肿瘤对于控制肿瘤局部复发十分重要,也有利于延长患者生存。研究显示,局部晚期DTC患者行R0(完全切除且镜下切缘阴性)、R1(镜下切缘阳性)切除时,5年疾病特异性生存率分别为94.4%、87.6%,而R2(肉眼可见病灶残留)切除时生存率明显下降,5年疾病特异性生存率仅为67.9%。手术决策时必须权衡手术并发症、重要结构的功能丧失和肿瘤局部控制、病灶复发或持续存在带来的问题、总生存获益方面的利弊。

【注释】
a. 喉返神经受累:在侵犯周围重要结构的甲状腺癌中,约33%~61%有喉返神经受侵。有研究提示喉返神经受累不是生存的独立影响因素,而且与切除神经相比,残留微量的病变并未增加局部复发率、降低生存率;但是,残留较多肿瘤可能会导致将来更大范围的再手术。所以,根治性切除仍是手术的基本目标。当然,决定手术方式时应考虑对侧喉返神经功能情况、疾病是否有远处转移等情况,以权衡手术风险和获益。术中行神经切除后,若可能应立即行喉返神经修复重建。研究表明,神经修复重建者有更好的发音、通气状态。
b. 气道/消化道(喉气管/食管)受累:甲状腺癌死亡病人中超过半数都与气道梗阻和出血有关。研究报道,3.6%~22.9%的甲状腺癌手术病人有气管或喉的受累,0.5%~1.5%存在气管腔内病变。食管受累多是侵及至肌层、少有黏膜的侵犯。气道/消化道受累患者的手术方式可以从肿瘤的剔除、气道/食管壁部分切除、节段切除,到广泛的食管/气管/喉切除,有多种不同的手术方式。手术的决策、实施应由有经验的专科医生进行。对于侵犯到气管腔内的病灶,常采用节段性切除、端端吻合方法重建气道,不能端端吻合者可采用自体血管化皮瓣及肌皮瓣方法修复气道。在病灶侵犯至食管腔内的病人中,切除大范围侵犯的病灶后亦需重建修复食管,可采用自体血管化皮瓣及肌皮瓣方法进行修复,切除局部侵犯的病灶后可直接对位缝合修补管腔;当病灶仅侵至食管肌层时,通常可在黏膜下解剖、切除病灶,不需要食管重建。采取食管/气管/喉部分切除或节段切除术时,有可能保证足够的切除范围、减少肿瘤残留,又能避免更广泛切除带来的严重并发症,通常手术后需要辅以131I、放疗等措施。这类局部已侵犯上呼吸道和上消化道者,其转归决定于是否能完整切除肿瘤灶并保留患者相关生理功能。
c. 颈血管受累:DTC严重侵犯颈部血管的情况罕见;而由于转移淋巴结造成颈内静脉受累的情况最多见。研究显示,双侧颈内静脉梗阻至少会导致2%的死亡发生。

【注释】
a. 术中喉返神经监测:再手术中,努力降低手术并发症的发生十分重要。文献报道,再次手术时暂时性喉返神经损伤的发生率为1.5%~22.2%,永久性喉返神经损伤的发生率为0.3%~6.4%。喉返神经监测在此类手术中对于减少神经损伤、增加手术安全性有重要价值。
b. 喉返神经损伤修复:手术方式包括喉返神经减压术、端端吻合术、游离神经移植术、舌下神经颈袢或迷走神经吻合术等。对于术后发现声带麻痹、诊断神经损伤者,一般可在前次手术后4~6个月手术探查、二期修复。
c. 术中辨识、保留或移植甲状旁腺:文献报道,再次手术时暂时性甲状旁腺损伤的发生率为6.5%~46.3%,永久性甲状旁腺损伤的发生率可达9.5%。术中应仔细辨识、原位保留甲状旁腺,并仔细检查切除的标本寻找可能切除的甲状旁腺;对于不能原位保留的甲状旁腺应经术中冰冻病理确认后进行移植(可移植在对侧的胸锁乳突肌中)。

【注释】
a. DTC孤立性肺转移的患者可考虑手术切除,肺转移瘤切除术已被确定为孤立肺转移患者治愈的选择。但迄今为止,对于报告肺转移瘤切除术治疗DTC患者的研究较少。Porterfield等对48名(包括5名髓样癌患者)行甲状腺癌肺转移瘤切除术,结果发现肺转移瘤切除术死亡率较低,术后5年总体生存率为60%。另一项研究包含了43例DTC肺转移行肺转移瘤切除术的患者,结果显示5年肿瘤特异性生存率为84%,10年肿瘤特异性生存率为59%。行R0切除的患者5年生存率甚至可达100%,10年生存率为77%,而肿瘤未能完全切除者5年生存率、10年生存率分别为62%、22%。
b. 骨转移病灶可手术治疗的指征包括:①持续疼痛;②孤立性骨转移;③对其他治疗的不敏感;④存在或高危因素的病理性骨折和截瘫;⑤明显的神经受累。Bernier等回顾性研究了109例骨转移DTC患者,其中24例(22%)患者完全切除转移病灶,60例(55%)患者部分切除病灶,其他患者未接受任何手术治疗,其中位生存时间分别为6.2,4.2和2.5年(P <0.05)。通过多变量分析显示,完整的骨转移手术是提高生存率的独立预后指标,但这仅适用于年龄较小(45岁以下)的患者。Orita等报道手术患者5年生存率为60%,而未手术患者仅为37%。针对完全切除与减压手术效果进行比较,Demura等研究发现手术的5年总体生存率为74%,10年为25%;其中全部椎间盘切除术(TES)后5年生存率为90%,而减压手术后5年生存率为63%,差异无统计学意义;但减压手术后局部复发率为57%,平均41个月后需要进一步手术治疗,而全部椎间盘切除术(TES)后复发率仅为10%,差异有统计学意义。
c. 手术是脑转移病灶的首选治疗方式;特别对于孤立转移灶和肿瘤负荷大导致中枢神经系统并发症的患者而言,手术不仅可以去除转移病灶,还可以解除威胁生命的颅内并发症。Chiu等报道手术切除DTC脑转移灶患者的中位疾病特异性生存期为22个月,而未接受手术的患者生存期仅为3.6个月(P <0.01)。类似研究也证实:手术切除大脑转移灶可以使患者获得更长生存期(与非手术干预患者生存期相比分别是20.8个月与2.7个月),其中接受了肉眼可见病灶切除的患者、接受了部分切除的患者和未手术患者生存期分别为18.7个月、25.5个月和2.7个月。
d. 当转移性胰腺病灶是孤立癌灶时,转移灶的切除能够将五年生存率提高到31%。但是,由于胰腺切除术后并发症和死亡率的发生率较高,手术前应认真评估。患者选择标准如下:①原发肿瘤类型预后良好;②肿瘤原发灶控制良好;③孤立性转移灶;④患者可以耐受胰腺切除术。
来自DTC的孤立性、可切除的肝转移极少出现。孤立性DTC的肝转移灶应考虑手术切除——解剖节段性切除术,为更长时间的生存提供可能。
2.3
131I治疗
131I治疗是DTC术后的重要辅助治疗手段之一,显著降低了高危DTC人群的复发转移及死亡风险。对于摄碘性转移性高危DTC患者,131I治疗可显著提高其总生存率及疾病特异性生存率。
经过前期131I治疗后,若动态评估提示疾病得到有效控制,可考虑重复进行131I治疗,并结合131I累积剂量权衡患者获益及风险,以确定131I治疗及随访频度。


【注释】
a. 全面掌握患者病史及既往治疗史是把握患者病情进展、指导诊疗最关键的一步,应全面、细致询问并记录。伴随疾病病情的自然变化及其对历次治疗措施所作出的不同反应,会使得患者的复发及肿瘤相关死亡风险随时间不断发生改变。
b. 131I治疗前应停用左旋甲状腺素(L-T4)至少2~4周。TSH会因停用L-T4后体内甲状腺激素水平下降而反馈性升高,但值得注意的是,远处转移性DTC因其肿瘤组织的甲状腺激素异位分泌可能影响TSH的反馈性升高甚至出现下降,因此,需密切关注这类患者的TSH变化,避免延长停药时间反致TSH下降、影响131I治疗疗效。L-T3可作为左旋甲状腺激素(L-T4)的替代药物用于TSH替代及抑制治疗,其优势在于131I治疗或诊断性扫描前可将停药时间缩短至2周左右,缩短停药时间有助于缓解患者甲状腺功能减退症状并减少对复发或转移病灶刺激。
c. 注射重组人促甲状腺激素(rhTSH)升高TSH水平目前仅在ATA中低危DTC患者的清甲及辅助治疗中考虑使用,对于ATA高危患者、包括持续/复发及转移性患者尚无足够临床证据支持其应用。但对于因身心疾病不能耐受甲状腺功能减退的患者和停用L-T4后TSH升高无法达标者也可考虑使用rhTSH。
d. 低碘饮食(饮食碘摄入量<50g/d)可增加131I在摄碘转移灶中的摄取量和半衰期,但远期治疗获益尚无明确证据。含碘制剂和药物中的稳定性碘可增加体内碘负荷,在131I治疗前应避免使用;已使用的,应停用并间隔相应时间;检测尿碘或尿碘肌酐比及血清碘可辅助判断碘负荷状态。
e. 诊断性全身显像的临床意义见下表

f. 131I治疗前可行颈部和/或胸部平扫CT评估病灶。如因病情需要行增强CT检查,为避免含碘造影剂的使用对病灶131I摄取的影响,应间隔1~2个月待尿碘降低时再考虑131I全身显像或131I治疗。
g. 18F-FDG PET/CT不常规应用于131I治疗前评估,其临床应用适应证见下表:
h. PTC原发灶的BRAFV600E基因突变及TERT启动子突变与远处转移灶的摄碘能力下降有关,因此,对于存在远处转移的PTC患者,预先检测BRAFV600E等基因突变情况,可辅助预测患者远处转移灶的131I摄取、治疗效果及预后。
131I摄取、治疗效果及预后。
2.3.2 131 I治疗策略
对于无法行手术切除的prmDTC病灶,如经131 I治疗前评估具有摄碘能力,可行131 I治疗。

【注释】
a. 131I治疗剂量有三种方法可以确定,包括:经验治疗剂量、吸收剂量计算治疗剂量和根据血液中辐射剂量计算治疗剂量。目前尚无前瞻性研究说明何种确定治疗剂量的方法为最佳,现临床最常用的为经验性治疗剂量确定法。对于青少年、高龄患者(70岁以上)及肾功能轻中度受损患者应酌情减少131I剂量。其中,70岁以上患者最大耐受剂量不能超过150 mCi。儿童及青少年DTC患者需根据体质量或体表面积来调整清甲治疗的131I剂量。
b. 局部持续/复发或转移可发生于甲状腺床、颈部软组织和淋巴结,对于无法手术的患者,在病灶摄取131I的前提下,131I是有效治疗方法之一。有研究提示,针对伴有腺外浸润和淋巴结转移的DTC患者,较高的初始131I治疗剂量(>50mCi)使其无复发生存时间明显长于<50mCi组(121个月 vs 25个月);同时,相对高剂量的131I治疗(150mCi)亦会使高危风险分层DTC患者的疾病复发率降低;有研究探索了个体化131I剂量与其治疗疗效之间的关系,结果提示,基于组织病理学特征、刺激性Tg以及Dx-WBS结果个体化调整131I治疗剂量后,更多伴有局部转移的患者(88%)在单次131I治疗后即可获得完全缓解。此外,近期针对术后、131I治疗后局部淋巴结复发并经二次侧方清扫术后患者的研究提示,二次术后131I辅助治疗有助于延长抑制性Tg≥1ng/ml的患者的无进展生存期。这些研究提示,131I治疗前精细化评估及个体化剂量实施可能更有助于降低DTC患者潜在的复发风险并提高prmDTC的131I治疗疗效。
c. 肺转移患者的131I治疗决策应综合权衡以下因素:①转移灶的大小:可分为可被胸片检测到的大结节(macronodular)或可被CT检测到的微小结节(micronodular)以及低于CT分辨率的病变(即131I-WBS可见肺内浓聚而CT等影像学无阳性发现)。②病灶的亲碘性(avidity for RAI)及对之前131I治疗的疗效反应。③病灶的稳定性评估。伴有微小肺转移灶的摄碘性患者,由于其对131I治疗反应好并极有可能达到完全缓解,因此,针对这部分患者,如明确其转移灶可继续摄碘,则可重复131I治疗,重复的时间间隔为6~12个月。相反,伴有多发大结节转移者预后较多发小结节差。有研究显示,131I治疗后第一年肺内转移性大结节性病灶生长速度是预后的独立预测因子。对伴有大结节的肺转移灶患者,经评估之前的131I治疗,具有获益者可考虑重复治疗,有关其治疗时间间隔尚存争议。有关肺转移患者的131I治疗剂量,常采用经验性治疗,针对肺微转移灶常采用100~200mCi(70岁以上患者100~150mCi),亦可以48h时体内滞留剂量80mCi及对骨髓的吸收剂量限值200cGy的剂量计算法。放射性肺炎和肺纤维化是高剂量治疗罕见的并发症,针对肺转移灶呈弥漫性摄碘的患者,建议采用基于体内滞留剂量及骨髓受照射剂量给予131I剂量。怀疑肺纤维化者应建议进一步的肺功能检查,肺纤维化的出现常是制约患者后续131I治疗的关键因素。
d. 中轴骨为DTC骨转移好发部位,其中颈椎转移最常伴发骨不良事件。孤立、有症状的骨转移灶应优先考虑完全性外科手术切除,特别是病情进展缓慢的患者。不能手术切除的病灶依次可以考虑其他局部治疗如括131I治疗、外照射等,或亲骨性系统治疗,如双膦酸盐药物治疗等。虽然131I很难将骨转移灶治愈,但大部分患者经过治疗后病情稳定,部分患者的转移病灶数量可减少甚至消失,对摄碘的骨转移灶采取131I治疗可以给患者带来生存获益,尤其是以骨转移为DTC首发症状、不伴有骨外转移、累积治疗剂量较高的患者。
e. 外科手术切除和外照射治疗是脑转移的主要治疗手段。不管转移灶是否摄碘,都应当首先考虑外科手术。131I是治疗脑转移的方法之一,但131I治疗后可引起肿瘤周围组织的水肿,特别是脑内多发转移或肿瘤体积较大时,脑水肿症状明显,严重者可出现脑疝,威胁患者生命。因此,在给予131I治疗时应同时给予糖皮质激素,并密切观察脑水肿病情的变化,给予相应的治疗。
f. 对于sTg≥10ng/ml而各种影像学检查尚未发现明确病灶者,可考虑行经验性131I治疗。若此类患者在经验性131I治疗后,全身显像阳性、病灶缩小和(或)Tg水平下降,可考虑重复131I治疗;但如治疗后131I全身显像仍未见明确病灶、Tg无明显下降者,则不再建议再次131I治疗。

【注释】
a. 131I治疗剂量有三种方法可以确定,包括:经验治疗剂量、吸收剂量计算治疗剂量和根据血液中辐射剂量计算治疗剂量。目前尚无前瞻性研究说明何种确定治疗剂量的方法为最佳,现临床最常用的为经验性治疗剂量确定法。对于青少年、高龄患者(70岁以上)及肾功能轻中度受损患者应酌情减少131I剂量。其中,70岁以上患者最大耐受剂量不能超过150 mCi。儿童及青少年DTC患者需根据体质量或体表面积来调整清甲治疗的131I剂量。
b. 局部持续/复发或转移可发生于甲状腺床、颈部软组织和淋巴结,对于无法手术的患者,在病灶摄取131I的前提下,131I是有效治疗方法之一。有研究提示,针对伴有腺外浸润和淋巴结转移的DTC患者,较高的初始131I治疗剂量(>50mCi)使其无复发生存时间明显长于<50mCi组(121个月 vs 25个月);同时,相对高剂量的131I治疗(150mCi)亦会使高危风险分层DTC患者的疾病复发率降低;有研究探索了个体化131I剂量与其治疗疗效之间的关系,结果提示,基于组织病理学特征、刺激性Tg以及Dx-WBS结果个体化调整131I治疗剂量后,更多伴有局部转移的患者(88%)在单次131I治疗后即可获得完全缓解。此外,近期针对术后、131I治疗后局部淋巴结复发并经二次侧方清扫术后患者的研究提示,二次术后131I辅助治疗有助于延长抑制性Tg≥1ng/ml的患者的无进展生存期。这些研究提示,131I治疗前精细化评估及个体化剂量实施可能更有助于降低DTC患者潜在的复发风险并提高prmDTC的131I治疗疗效。
c. 肺转移患者的131I治疗决策应综合权衡以下因素:①转移灶的大小:可分为可被胸片检测到的大结节(macronodular)或可被CT检测到的微小结节(micronodular)以及低于CT分辨率的病变(即131I-WBS可见肺内浓聚而CT等影像学无阳性发现)。②病灶的亲碘性(avidity for RAI)及对之前131I治疗的疗效反应。③病灶的稳定性评估。伴有微小肺转移灶的摄碘性患者,由于其对131I治疗反应好并极有可能达到完全缓解,因此,针对这部分患者,如明确其转移灶可继续摄碘,则可重复131I治疗,重复的时间间隔为6~12个月。相反,伴有多发大结节转移者预后较多发小结节差。有研究显示,131I治疗后第一年肺内转移性大结节性病灶生长速度是预后的独立预测因子。对伴有大结节的肺转移灶患者,经评估之前的131I治疗,具有获益者可考虑重复治疗,有关其治疗时间间隔尚存争议。有关肺转移患者的131I治疗剂量,常采用经验性治疗,针对肺微转移灶常采用100~200mCi(70岁以上患者100~150mCi),亦可以48h时体内滞留剂量80mCi及对骨髓的吸收剂量限值200cGy的剂量计算法。放射性肺炎和肺纤维化是高剂量治疗罕见的并发症,针对肺转移灶呈弥漫性摄碘的患者,建议采用基于体内滞留剂量及骨髓受照射剂量给予131I剂量。怀疑肺纤维化者应建议进一步的肺功能检查,肺纤维化的出现常是制约患者后续131I治疗的关键因素。
d. 中轴骨为DTC骨转移好发部位,其中颈椎转移最常伴发骨不良事件。孤立、有症状的骨转移灶应优先考虑完全性外科手术切除,特别是病情进展缓慢的患者。不能手术切除的病灶依次可以考虑其他局部治疗如括131I治疗、外照射等,或亲骨性系统治疗,如双膦酸盐药物治疗等。虽然131I很难将骨转移灶治愈,但大部分患者经过治疗后病情稳定,部分患者的转移病灶数量可减少甚至消失,对摄碘的骨转移灶采取131I治疗可以给患者带来生存获益,尤其是以骨转移为DTC首发症状、不伴有骨外转移、累积治疗剂量较高的患者。
e. 外科手术切除和外照射治疗是脑转移的主要治疗手段。不管转移灶是否摄碘,都应当首先考虑外科手术。131I是治疗脑转移的方法之一,但131I治疗后可引起肿瘤周围组织的水肿,特别是脑内多发转移或肿瘤体积较大时,脑水肿症状明显,严重者可出现脑疝,威胁患者生命。因此,在给予131I治疗时应同时给予糖皮质激素,并密切观察脑水肿病情的变化,给予相应的治疗。
f. 对于sTg≥10ng/ml而各种影像学检查尚未发现明确病灶者,可考虑行经验性131I治疗。若此类患者在经验性131I治疗后,全身显像阳性、病灶缩小和(或)Tg水平下降,可考虑重复131I治疗;但如治疗后131I全身显像仍未见明确病灶、Tg无明显下降者,则不再建议再次131I治疗。
【注释】
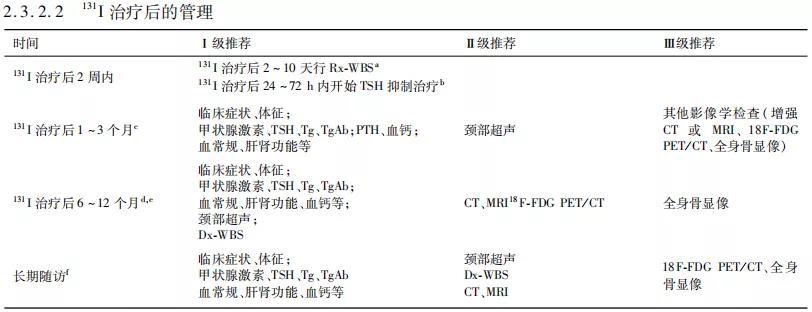
a. 131I治疗后2~10天行Rx-WBS可进一步明确病灶的摄碘能力,有利于对DTC进行再分期,指导持续/复发及转移性DTC后续治疗方案的制定。
b. 131I治疗前停用L-T4治疗的DTC患者,在131I治疗后24~72 h内开始进行L-T4抑制治疗。高龄或伴有基础疾病者补充L-T4的剂量宜逐步增加。参看2.4.1。
c. prmDTC经131I治疗后1~3个月开始需定期随访,通过询问患者临床症状、进行体格检查以及检测血清甲状腺激素、TSH、Tg、TgAb水平以及血常规、肝肾功能等指标,及时了解患者是否存在131I治疗后短期不良反应,及时予以处置,并及时了解TSH、Tg变化,调整甲状腺素剂量,将TSH控制至相应的抑制水平,确保TSH抑制治疗疗效。必要时加做颈部超声监测局部复发病灶或转移性淋巴结经131I治疗后的短期变化。
d. 131I治疗后6~8个月需进行第2次随访,此次随访目的除了调整甲状腺素剂量外,还要进行疗效评估。此次疗效评估一般需在停服L-T4 2周以上时进行,通过比较治疗前后血清学指标(sTg、TgAb)以及影像学指标(颈部超声、Dx-WBS、CT、MRI等)的变化,动态综合评估病灶进展情况,决定下一步诊治措施。若Tg、TgAb持续下降,影像学检查提示病灶缩小、减少,Dx-WB显示病灶减少、浓集范围缩小或程度减淡,则治疗有效,可重复进行131I治疗,直至病灶消失或无反应;但如果进展为碘难治性DTC(radioiodine refractory differentiated thyroid cancer,RAIR-DTC),则应终止131I治疗。RAIR-DTC的定义如下:
在无外源性碘负荷干扰的情况下,TSH刺激状态(>30mIU/L)时,出现下列情形之一即可界定为RAIR-DTC:
①转移灶在清甲成功后的首次131I治疗后全身显像中即表现为不摄碘,致其无法从后续的131I治疗中获益。
②原本摄碘的功能性转移灶经131I治疗后逐渐丧失摄碘能力。
③部分转移灶摄碘,而部分转移灶不摄碘。
④摄碘转移灶在经过多次131I治疗后虽然保持摄碘能力但仍在1年内出现病情进展。
e. 经治疗后动态评估,终止后续131I治疗的指征包括:①经治疗后达到ER(参见3.1);②进展为RAIR-DTC;③伴有严重心血管疾病、严重肝肾功能障碍以及其他严重并发症(如粒细胞缺乏、严重全血细胞减少等)。
f. 131I治疗后若达到ER,则可继续TSH抑制治疗,进入长期随访阶段,随访间隔时间为6~12个月,若病情稳定,可逐渐延长随访间隔时间。在长期随访中,以监测血清TSH、Tg、TgAb水平变化为主,监测Tg水平,因TgAb增高将影响Tg的监测,因此TgAb可疑增高者可监测TgAb的变化,如抑制性 Tg或TgAb水平持续可疑增高,应行寻找可能存在的复发或转移病灶,重新评估患者病情决定下一步治疗策略。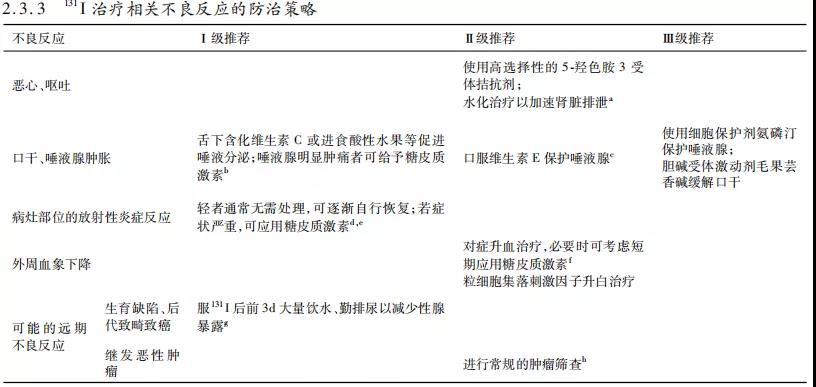
【注释】
a. 131I治疗DTC后常出现恶心、呕吐等胃肠道症状,多于服131I后48h内逐渐自行缓解。研究表明,131I治疗剂量在5.55GBq或更高时,胃肠道反应的发生则更为普遍。轻症患者常无需特殊处理,症状较重者可考虑使用甲氧氯普胺、昂丹司琼等5-羟色胺3受体拮抗剂等;水化治疗以加速肾脏排泄等。
b. 131I治疗后唾液腺损伤的发生率与累积治疗剂量呈正相关。舌下含化维生素C或进食酸性水果可加速唾液的排出,降低131I在腺体内滞留的时间。服131I后出现唾液腺明显肿痛的患者可给予糖皮质激素以减轻症状。针对可能出现的唾液腺损伤,在每次131I治疗前可考虑采用唾液腺功能显像对其进行评估。
c. 有研究显示,服用不同剂量的维生素E对DTC术后131I治疗患者的唾液腺摄取及排泌功能的改善程度有差异,剂量较大组保护作用更明显
d. 如DTC转移灶数量较多、范围较大时,为避免或减轻辐射所致的炎性反应,在131I治疗的同时可考虑应用糖皮质激素。
e. 131I治疗DTC脑转移灶时,应同时给予糖皮质激素,以减少或预防脑水肿的发生。
f. 部分患者在131I治疗后可发生一过性骨髓抑制。来自我国的研究提示,131I治疗后DTC患者一周内外周血中白细胞、中性粒细胞呈先升高后降低趋势,大剂量清灶治疗后淋巴细胞呈下降趋势;在首次131I治疗后1个月出现一过性全血细胞下降,6个月后逐渐恢复。血象下降明显者,如低于正常水平,则需要辅以对症升血治疗。
g. 目前,尚无前瞻性大样本研究分析多次131I治疗对患者性腺的短期和长期影响。131I治疗后前3d大量饮水、勤排尿可有效减少性腺暴露。目前也没有足够的随访资料分析131I治疗后对后代生长发育和恶性肿瘤患病率及生存率的影响。
h. 有关131 I治疗后继发恶性肿瘤的发生率研究证据有限,其中有报道显示经131I治疗后患者的白血病发生率高于未行131I治疗患者。尽管接受高累积剂量(如超过22.2GBq)的131I治疗有增加罹患继发恶性肿瘤的风险,但考虑到患病风险极低,故患者仅需接受符合其年龄及性别特征的常规肿瘤筛查即可。
2.4 TSH抑制治疗

【注释】
a. 对于尚存分化功能的甲状腺癌细胞,TSH可通过与其表达的TSH受体结合刺激其生长,因此,抑制TSH水平有利于控制疾病进展。而如果肿瘤分化程度低、不再表达TSH受体,则其生长、增殖并非依赖于TSH的作用,对此类患者,即便将TSH 抑制到很低的水平,仍难以减缓病情进展,故仅需进行甲状腺激素替代治疗。TSH抑制治疗用药首选L-T4口服制剂,早餐前空腹顿服L-T4最利于维持稳定的TSH水平。干甲状腺片中甲状腺激素的剂量和T3/T4的比例不稳定,可能带来TSH波动,因此不建议在长期抑制治疗中作为首选。近期的荟萃分析显示,对于DTC术后TSH抑制合并吸收不良的患者,LT4液性制剂可能比片剂效果更佳。但国内尚无L-T4液性制剂。L-T4起始剂量需结合患者年龄和伴发疾病情况——年轻患者可足量起始;50岁以上的患者如无心脏病及其倾向,初始剂量50g/d;如患者有冠心病或其他高危因素,初始剂量为12.5~25g/d,甚至更少,增量更缓、调整间期更长,并严密监测心脏状况;L-T4终剂量的确定有赖于血清TSH的目标和监测结果。既往认为,TSH存在日节律,但近期的研究表明,在LT4抑制治疗剂量类似的情况下,DTC患者上午与下午采血检测TSH并无显著性差异。这可能有助于DTC患者提高复诊和随访的便捷性。
b. 初治期通常指持续/复发及转移性甲状腺癌接受手术、放射性碘等治疗手段后的1年内。持续/复发及转移性甲状腺癌患者在此阶段中归属于肿瘤复发风险高危的群体,研究显示他们可从TSH抑制至<0.1 mU/L中明显获益,表现为无病生存率显著提高,但更大强度的TSH抑制(<0.03 mU/L)未带来更多获益。鉴于TSH抑制治疗带来的亚临床甲状腺毒症存在副作用风险(详见2.4.2),特别在有绝经后女性、心动过速、>60岁、骨质疏松、心律失常或伴发其他严重疾病等的人群中,副作用风险为中高危级别,此时抑制治疗不宜一味强行追求< 0.1mU/L,而应兼顾副作用风险,将TSH控制至接近达标的最大可耐受程度。
c. 随访期通常指持续/复发及转移性甲状腺癌接受手术、放射性碘等治疗手段后的1年之后。经过治疗后,部分持续/复发及转移性甲状腺癌患者的肿瘤复发风险可能会发生变化,因此TSH抑制治疗的目标并非一成不变。通过动态监测评估患者对治疗的反应:如果疗效满意,意味患者从复发风险高危降至低危,则TSH抑制目标可放宽至正常范围的低值;而如果生化疗效不佳甚至结构性疗效不佳,则意味患者仍有高危复发风险,需结合副作用风险将TSH抑制到较低的水平。由于甲状腺癌患者的生存期往往较长,动态监测评估往往需要持续终生,而TSH抑制治疗目标也应当随着患者对治疗的反应情况及时做以调整。

【注释】
a. 当TSH长时间被抑制到低于正常下限(即亚临床甲状腺毒症)、特别是<0.1mU/L时,可能带来TSH抑制治疗的不良反应,主要表现在对心血管系统和绝经后女性骨骼系统的影响。一项样本量较大的回顾性队列研究发现,经过平均18.8年的随访,DTC术后TSH控制<0.1mU/L的患者各类CVD风险均显著增加,但CVD相关死亡率却更低。这可能与DTC患者术后随访更积极、CVD的防治更及时和生活方式改善有关。对于DTC术后的绝经后女性,经过6年的L-T4抑制治疗,TSH低于0.5mU/L组的脊柱骨折风险高达44.6%。此外,近期有研究提示,亚临床甲状腺毒症对神经系统认知功能可能产生负面作用,但还需大样本、高质量的研究数据进一步证实。因此,TSH抑制治疗目标的设定应兼顾副作用风险,并在动态随访和评估中及时调整,并督促患者规律复诊,以求早期预防、早期诊治以减少副作用发生。
b. 对需要将TSH抑制到低于TSH正常下限的DTC患者,评估治疗前基础心脏情况;定期监测心电图,必要时行动态心电图和超声心动图检查;定期进行血压、血糖和血脂水平监测,必要时可测定颈动脉内膜中层厚度。TSH抑制治疗期间,有心血管系统不良反应(特别是老年患者),如静息心率超过90次/分,和/或伴发心血管疾病的DTC患者,应使用â受体阻滞剂对症治疗。TSH抑制前或治疗期间发生心房颤动者,应专科就诊给予规范化治疗。有心脏基础疾病或心血管事件高危因素者,应针对性地给予地高辛、血管紧张素转换酶抑制剂或其他心血管药物治疗,并适当放宽TSH抑制治疗的目标。
c. 对需要将TSH抑制到低于TSH下限的DTC患者(特别是绝经后妇女),评估治疗前基础骨矿化状态并定期监测:根据医疗条件酌情选用血清钙/磷、24小时尿钙/磷、骨转换生化标志物和BMD测定。由于长期亚临床甲亢是绝经后女性OP的危险因素,因此绝经后DTC患者在TSH抑制治疗期间,应接受OP初级预防:确保钙摄入1000~1200mg/d,补充维生素D 400~600 IU/d。用于OP防治时,维生素D剂量为800~1200IU/d。发生OP者,应专科就诊并酌情联合其他干预治疗药物(如双膦酸盐类、降钙素类、雌激素类、甲状旁腺激素、选择性雌激素受体调节剂类等)。
2.5
外照射治疗
对于持续/复发及转移性DTC患者,外照射有利于局部区域控制。对整体治疗可以起到积极的辅助和补充作用。当有肉眼可见、无法手术的局部残留或复发肿瘤,或位于关键部位无法手术的远处转移,均可考虑外照射治疗,尤其在肿瘤不摄碘或碘治疗效果差出现碘难治性状态时。
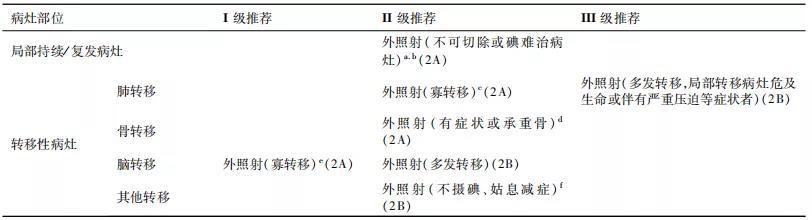
【注释】
a. 局部持续/复发病灶主要包括甲状腺床复发和颈部淋巴结转移。若病灶无法手术切除且摄碘,则131I 治疗和外照射均为有效的治疗手段。若病灶不摄碘,或在 131I 治疗后仍有残留,或其他治疗手段无效时,外照射治疗是重要的局部治疗选择之一。
b. 最优的外照射范围和剂量仍有争议。关于照射范围主要有两方面意见:①小野照射:主要包括甲状腺床复发灶或残存肿瘤区。②大野照射:包括甲状腺床复发灶和区域淋巴引流区。常规分割参考剂量:①大体肿瘤区(gross target volume,GTV,主要包括复发或残存肿瘤区、转移淋巴结区):60~70Gy,建议在保证安全的前提下,外照射给予足够高的剂量;②临床靶区(clinical target volume,CTV,主要包括亚临床灶):50~60Gy。在制定放疗计划时,不但要考虑靶区剂量的覆盖,同时考虑正常组织的耐受量以避免严重的并发症。调强放疗技术具有安全、有效、副作用小等优势,可作为放疗技术首选。
c. DTC 肺转移时,外照射主要适用于:①寡转移(寡转移的定义现尚无统一标准,通常认为转移灶数量在1~5个以内);②多发转移灶或大结节病灶,经过系统治疗或 131I 治疗后仍有残留病灶;③不摄碘的肺转移灶;④局部转移病灶危及生命或伴有严重压迫等症状者。对于寡转移病灶,立体定向放射治疗在保证充足生物剂量的前提下,可获得不错的临床疗效,但对于弥漫性多发肺转移灶,外照射只做为备选治疗手段。
d. 对于骨转移患者,外照射主要适用于有局部疼痛症状或严重骨质破坏的承重骨转移病灶。外照射可以有效缓解疼痛症状、减少及延缓病理性骨折等事件的发生,提高生活质量。对于孤立、有症状的转移灶,外照射还可以作为外科手术切除后的补充治疗,特别是一些位于关键部位、手术无法完全切除的病灶。
e. 脑转移的情况有些特殊,由于131I 治疗可引起肿瘤周围组织的水肿,因此,外照射和外科手术是脑转移的主要治疗手段。且不论转移灶的数量、大小及是否摄碘,外照射均可应用。脑转移的专病死亡率高达67%,但文献报到手术完全切除后其中位生存期可达 12.4 个月,随着放疗技术的发展,尤其是立体定向放射治疗也可获得与手术近似的疗效。但对于多发颅内转移或肿瘤体积大脑水肿症状明显时,应同时加强脱水降颅压等辅助治疗,必要时先行手术辅助降颅压。
f. 其他部位远处转移,外照射主要适用于肿瘤不摄碘或 131I 治疗效果差出现碘难治性状态时的姑息治疗。可以减轻局部压迫或疼痛等症状,提高患者生存质量。
g. 远处转移的外放射剂量、分割无统一意见。可以采用大分割短疗程,也可以采用常规分割。大分割治疗有明显的生物学和经济学优势,与新型治疗手段联合可能有潜在临床获益,尚需进一步研究证实。
h. 外照射相关不良反应主要包括急性期反应和晚期损伤,常见的有急性黏膜、皮肤反应、喉水肿、吞咽困难和颈部纤维化等。纵隔转移放疗可能产生放射性脊髓炎、放射性肺炎,而骨盆转移放疗可能产生放射性骨髓抑制、放射性肠炎等。在给予较高剂量的外照射治疗时,可通过积极的护理支持治疗、合理缩小照射范围、使用三维或调强外照射等技术有利于提高转移灶的局部控制,和降低治疗不良反应的发生率。
2.6
系统性治疗
RAIR-DTC的生物学特征呈现较大异质性,需对患者病情及进展趋势全面评估的基础上制定治疗策略。对于无症状、稳定或缓慢进展的患者通常采用每3~6个月定期随访的策略;部分患者在根治后的12~14个月内即出现RECIST标准的疾病进展,专家建议将这部分患者定义为进展性RAIR-DTC,包括以下任一情形:①局部晚期;②其他部位转移;③有症状或威胁生存。并建议对不适合局部治疗的进展性RAIR-DTC进行系统性治疗。
2.6.1.1 分子靶向治疗策略
施行分子靶向治疗前,应考虑以下因素:①RAIR-DTC患者自然病程可从几个月到几年不等;②目前的研究证据主要展示了无进展生存期(progression free survival,PFS)的延长;③分子靶向药物可能出现药物相关不良反应,并可能对生活质量(quality of life,QoL)有不同程度的影响;④存在耐药可能,且后续治疗手段疗效有限。

【注释】
a. 索拉非尼是难治性甲状腺癌分子靶向治疗领域内第1个完成全球多中心随机对照Ⅲ期临床试验的靶向药,也是全球首个被FDA批准用于治疗进展性局部晚期或转移性RAIR-DTC的分子靶向药物。2017年3月获得中国食品药品管理委员会批准用于治疗进展性RAIR-DTC,成为中国首个获批用于治疗进展性RAIR-DTC的分子靶向药物。在药物使用方法上,大多数临床试验采用每天2次,每次400毫克索拉非尼口服。近期,韩国一项临床研究在真实世界评估了索拉非尼治疗RAIR-DTC的有效性和安全性,该研究显示的索拉非尼治疗RAIR-DTC的PFS与DECISION研究相一致。针对国外学者根据副作用严重程度较为普遍地进行剂量调整的报道,国内有学者报道了应用低剂量索拉非尼治疗RAIR-DTC的初步经验。研究发现,每天2次,每次200mg索拉非尼口服的方法也获得了良好的疗效,且副作用相对较轻,提高了患者的依从性并降低了医疗费用。
b. 仑伐替尼是继索拉非尼之后,于2015年2月13日获得FDA批准用于治疗进展性局部晚期或转移性RAIR-DTC的第二个分子靶向药物。仑伐替尼的获批是基于一项全球多中心随机对照Ⅲ期临床研究(SELECT研究)结果。该研究显示,与安慰剂相比,仑伐替尼显著延长进展性局部晚期或转移性RAIR-DTC患者的mPFS(18.3月 vs.3.6月,HR=0.21,99%CI:0.14-0.31,P<0.001),同时显著提高ORR(64.8%vs.1.5%,OR=28.87,95%CI:12.46-66.86,P<0.001)。预设亚组分析数据显示,仑伐替尼显著延长老年患者(>65岁)的mOS(未达到 vs.18.4个月,HR=0.53,95%CI:0.31-0.91,P=0.020)。目前,仑伐替尼用于中国放射性碘131难治性分化型甲状腺癌患者的一项多中心、随机、双盲、安慰剂对照试验正在进行中,截至2019年2月,已完成所有患者入组。此外,仑伐替尼已于2018年9月4日经中国国家药品监督管理局(NMPA)批准,用于治疗此前未接受过系统治疗的不可切除的肝细胞癌患者。
c. 参加临床试验的时机:①对于局部进展或转移的RAIR-DTC,当RECIST标准判定为疾病进展,尤其是经过目前批准的药物或手段治疗后疾病仍持续进展的患者,或无法负担标准治疗时可考虑参加临床试验;②患者存在BRAF、PPARã等肿瘤相关基因变异,可考虑参加针对这些特定靶点的临床试验;③对于无症状、稳定的转移性DTC,除非证据显示临床试验的药物有极大的可能性达到完全缓解或可延长生存,否则不予考虑。
d. 甲状腺癌相关靶向治疗药物临床研究设计及疗效见下表:
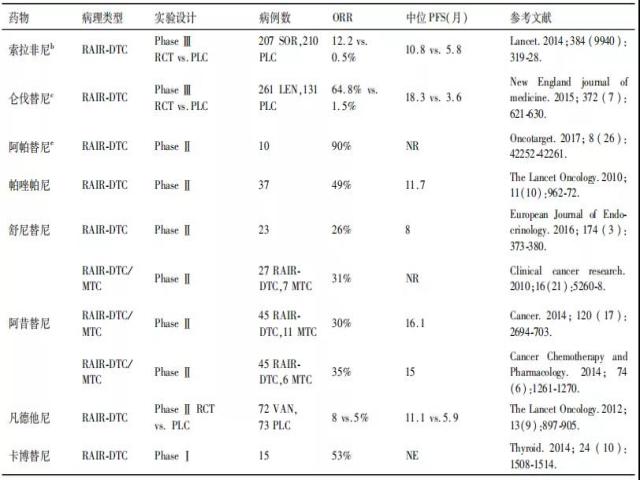
注:RCT:随机对照临床实验;PLC:安慰剂;NR:未报道;NE:无法评估;RAIR-DTC:放射性碘难治性分化型甲状腺癌;MTC:甲状腺髓样癌;VAN:凡德他尼;SOR:索拉非尼;LEN:乐伐替尼
e. 一项单臂前瞻性临床试验探索了甲磺酸阿帕替尼治疗进展性碘RAIR-DTC中的疗效、安全性及剂量比较,研究初步提示其可安全用于RAIR-DTC,且在8周治疗中即出现明确的血清学及影像学反应;在6个周期的随访中,每日500mg剂量较750mg组毒副反应轻、疗效相近。
2.6.1.2 分子靶向治疗不良反应及处理策略
分子靶向治疗相关不良反应非常普遍,可能导致药物减量甚至停药,极个别病例甚至发生药物毒性相关性死亡。常见不良反应包括皮肤毒性、高血压、胃肠道毒性、蛋白尿、疲乏、促甲状腺激素抑制障碍或甲状腺功能受损等。
治疗过程中出现的不良反应,建议多学科会诊(MDT),采取积极的治疗措施,目的是保护重要脏器功能,提高生命质量,同时将靶向药物的效应最大化。如果不良反应程度较轻,重要器官功能良好,应尽可能维持靶向药物的应用,以获得靶向药物的最大暴露,从而获得最大疗效,最终实现患者生存获益;如果出现G3~4不良反应,或者重要器官受损,应及时停药或者减量,待不良反应消失或者减弱后再从低剂量开始或者重新开始应用,以保证治疗安全。具体处理原则如下:
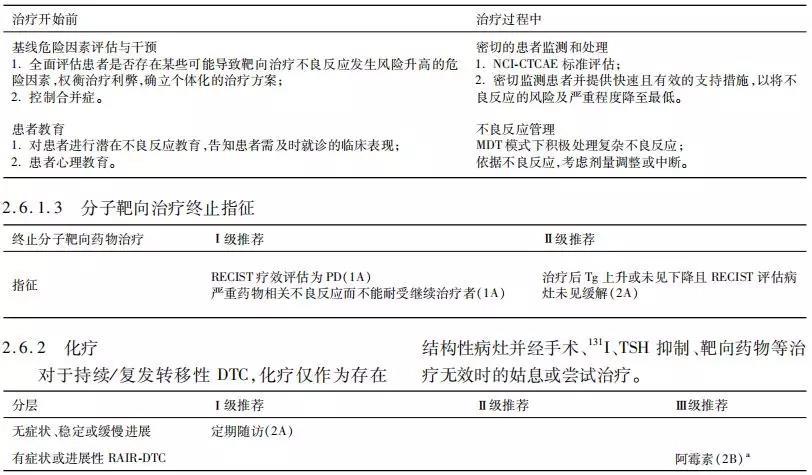
a. 化疗是晚期甲状腺癌的唯一系统性治疗手段,而阿霉素是美国FDA唯一批准的化疗药物。阿霉素单药治疗是常用的治疗方案,随机研究显示联合其他化疗药物虽然增加了肿瘤缓解率,但并没有改善生存。对于 TKIs 治疗不敏感的RAIR-DTC,化疗可能有一定疗效,有研究显示吉西他滨联合奥沙利铂方案对其的有效率达57%,但因样本量较小,仍需进一步验证。
2.7
其他治疗
2.7.1 消融治疗
消融治疗包括热消融和化学消融。前者包括射频(RFA)、微波、激光;后者包括酒精经皮注射。2001年RFA首次应用于DTC复发灶的治疗并取得良好效果,目前prmDTC消融治疗的适应证包括以下三种情况:经规范的外科治疗或RAI治疗后,仍存在孤立病灶;外科手术风险较高;患者拒绝手术。消融病灶控制在3~4个以内,大小控制在2cm以内,消融安全而且有效。
2.7.2125I粒子植入治疗
125I粒子植入治疗为不能再次手术、131I治疗不可控及不适合靶向治疗的持续或复发病灶提供了一种可选择的手段。有研究表明其可以快速控制转移淋巴结大小和血清Tg水平。
3.疗效评估
患者的复发及肿瘤相关死亡风险随时间不断地发生改变,应基于对患者既往治疗史的掌握并结合随访过程中获得的最新血清学、影像学结果,实时动态评估其复发风险及临床转归,这一评估反映了患者对相应治疗的反应及疾病随时间的自然转归,即可预测复发风险亦可预测死亡风险,是决策后续治疗及随访方案的重要依据。2015年美国甲状腺学会指南将动态评估结果分层归纳为以下4种,分别为疗效满意(excellent response,ER)、疗效不确切(indeterminate response,IDR)、生化疗效不佳(biochemical incomplete response,BIR)以及结构性疗效不佳(structural incomplete response,SIR),用于描述治疗后任一时间点的临床转归情况。
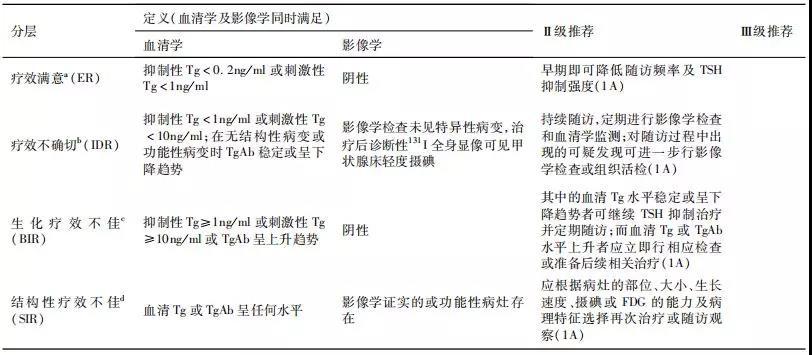
【注释】
a. 疗效满意(ER)患者复发率1%~4%;死亡率<1%。
b. 疗效不确切(IDR)患者长期随访过程中15%~20%出现结构性病变;余者非特异性疾病改变维持稳定或消失;死亡率<1%。
c. 生化疗效不佳(BIR)患者至少30%自然转归为无瘤生存状态;20%经治疗后转归为无瘤生存状态;20%发展为结构性病变;死亡率<1%。
d. 结构性疗效不佳(SIR)患者即使经过治疗,仍有50%~85%处于疾病持续状态;局部转移者死亡率11%;远处转移者死亡率50%。
e. 无瘤生存状态(no evidence of disease,NED):指末次随访时无疾病证据。
本指南编写组成员
组 长 林岩松
副组长 陈立波 郭 晔 黄慧强
特别鸣谢:赵玉沛院士、姜玉新教授、赵家军教授对本指南的指导。
编写专家委员会(按姓氏汉语拼音排序)(*为执笔人)
包建东 江苏省原子医学研究所江苏省江原医院
陈 革 北京协和医院基本外科
陈立波* 上海交通大学附属第六人民医院核医学科
崔亚利 哈尔滨医科大学附属肿瘤医院核医学科
丁 勇* 中国人民解放军总医院第五医学中心核医学科
关海霞* 中国医科大学附属第一医院内分泌科
郭 晔* 同济大学附属东方医院肿瘤科
高再荣* 华中科技大学同济医学院附属协和医院核医学科
黄慧强 中山大学肿瘤防治中心肿瘤内科
黄 蕤* 四川大学华西医院核医学科
黄 韬 华中科技大学同济医学院附属协和医院乳腺甲状腺外科
侯晓荣* 北京协和医院放疗科
何霞云* 复旦大学肿瘤医院放疗科
李 梅* 北京协和医院内分泌科
李少华 南京市第一医院核医学科
李小毅* 北京协和医院基本外科
李雪娜 中国医科大学附属第一医院核医学科
李玉军 青岛大学附属医院病理科
李 超* 四川省肿瘤医院头颈肿瘤外科
梁智勇* 北京协和医院病理科
罗瑜昆 中国人民解放军总医院超声科
林承赫* 吉林大学第一医院核医学科
林岩松* 北京协和医院核医学科
吕 静* 青岛大学附属医院肿瘤科
柳 卫* 江苏省人民医院核医学科
刘志艳* 山东大学齐鲁医院病理科
陆克义* 山西医科大学第一医院核医学科
马庆杰* 吉林大学中日联谊医院核医学科
牛丽娟* 中国医学科学院肿瘤医院超声科
孙文海 青岛大学附属医院甲状腺外科
王 峰 南京市第一医院核医学科
王 颖* 中山大学附属第五医院核医学科
王任飞* 天津医科大学总医院核医学科
王玉龙 复旦大学附属肿瘤医院头颈外科
王卓颖* 上海交通大学附属仁济医院头颈外科
魏 枫 内蒙古科技大学包头医学院第一附属医院内分泌科
徐书杭* 江苏省中西医结合医院内分泌科
夏 宇 北京协和医院超声医学科
杨爱民* 西安交通大学第一附属医院核医学科
张 彬* 北京大学肿瘤医院头颈外科
张 波* 中日友好医院超声医学科
张 广* 吉林大学中日联谊医院甲状腺外科
张 弘 中山大学孙逸仙纪念医院核医学科
张 力 北京协和医院肿瘤科
郑向前* 天津医科大学肿瘤医院甲状腺颈部肿瘤科
审阅专家委员会(按姓氏汉语拼音排序)
安 锐 华中科技大学同济医学院附属协和医院核医学科
房居高 首都医科大学附属北京同仁医院耳鼻咽喉头颈外科
樊友本 上海市第六人民医院普外科
高 明 天津医科大学肿瘤医院甲状腺颈部肿瘤科
郭朱明 中山大学肿瘤防治中心头颈外科
黄 钢 上海交通大学医学院附属仁济医院核医学科
嵇庆海 复旦大学附属肿瘤医院头颈外科
蒋宁一 中山大学孙逸仙纪念医院核医学科
匡安仁 四川大学华西医院核医学科
李 方 北京协和医院核医学科
李思进 山西医科大学第一医院核医学科
李亚明 中国医科大学附属第一医院核医学科
刘绍严 中国医学科学院肿瘤医院头颈外科
孙 辉 吉林大学中日联谊医院甲状腺外科
单忠艳 中国医科大学附属第一医院内分泌科
谭 建 天津医科大学总医院核医学科
田 文 中国人民解放军总医院普通外科
汪 静 空军军医大学(第四军医大学)西京医院核医学科
王 铁 首都医科大学附属北京朝阳医院核医学科
邢小平 北京协和医院内分泌科
徐震纲 中国医学科学院肿瘤医院头颈外科
张福泉 北京协和医院放疗科
朱精强 四川大学华西医院甲状腺乳腺外科
秘 书
李 娇 李 丽 李 慧 张英杰 赵 腾
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论