[导读] 中华预防医学会妇女保健分会乳腺保健与乳腺疾病防治学组;中国实用外科杂志 2016 Vol.36(7) : 755-758
非哺乳期乳腺炎(non-puerperal mastitis,NPM)是一组发生在女性非哺乳期、病因不明、良性、非特异性炎症性疾病,包括乳腺导管扩张症(mammary duct ectasia,MDE)/导管周围乳腺炎(periductal mastitis,PDM)、肉芽肿性小叶乳腺炎(granulomatous lobular mastitis,GLM)。近年来该病发病率呈明显上升趋势,虽然是一组良性疾病,但常规抗生素治疗效果不佳,多次手术后仍易复发,脓肿反复破溃形成窦道、瘘管或溃疡,严重影响生活质量,对广大女性身心健康造成伤害。
MDE/PDM与GLM 有着相似的临床表现,但治疗方案截然不同,预后有别,加强这两种疾病的分类诊断对临床治疗策略的选择有重要指导意义,但目前临床医师对该病认识不统一,诊疗过程相当混乱。为规范NPM 的诊断和治疗,中华预防医学会妇女保健分会乳腺保健与乳腺疾病防治学组撰写了《非哺乳期乳腺炎诊治专家共识(讨论稿)》,随后在威海、哈尔滨、北京等地组织会议,并邀请多位国内专家集体讨论,对于证据不足的争议问题,采用专家投票方式表决,最终形成建议或共识,并根据反馈意见再予以修订及完善,以供临床医师工作中参考。本共识旨在帮助临床医师为NPM 病人选择当前相对较好的诊治方案。在临床实践中,医师应参考治疗原则和新进展并结合病人具体病情进行个体化处理。
目前,引起该病的确切因素仍不明确。MDE/PDM 发病的危险因素主要包括乳管阻塞、细菌感染、吸烟史(包括二手烟)、乳头内陷等[1-3]。虽然没有确凿证据,但是专家仍然倾向GLM 是一类自身免疫相关的疾病,其发生还与泌乳因素、感染因素(尤其是kroppenstetii 棒状杆菌感染)相关,其他可能的因素还包括创伤、体内激素水平、口服避孕药物、种族差异等[4-6]。
NPM 缺乏诊断的金标准,主要结合临床表现、组织病理学和辅助检查进行综合分析,在排除乳腺结核和特异性肉芽肿性病变的基础上作出诊断。
2.1 临床表现
MDE/PDM发病可以影响各年龄段的成年女性,而GLM 通常发生在生育期女性,尤其是妊娠后5 年内。该类疾病临床主要表现为乳腺肿块和乳头内陷、乳头溢液、乳腺疼痛,其中乳腺肿块在慢性病变基础上可继发急性感染形成脓肿,终末期脓肿破溃可形成乳腺瘘管、窦道或者溃疡,经久不愈[7-9]。
2.2 组织病理学检查
组织病理学检查是NPM 分类诊断和确诊的主要依据,取材方法推荐空芯针穿刺活检(CNB),不建议行细针穿刺细胞学检查。MDE/PDM 镜下可见乳腺导管高度扩张,囊腔内充满粉红色颗粒状浓稠物质;扩张导管周围可见淋巴细胞、浆细胞和中性粒细胞浸润。GLM最主要的特征表现为以乳腺小叶单位为中心的非干酪样肉芽肿,呈多灶性分布,大小不等,伴或不伴微脓肿[10-11]。
2.3 辅助检查项目
2.3.1 推荐检查项目
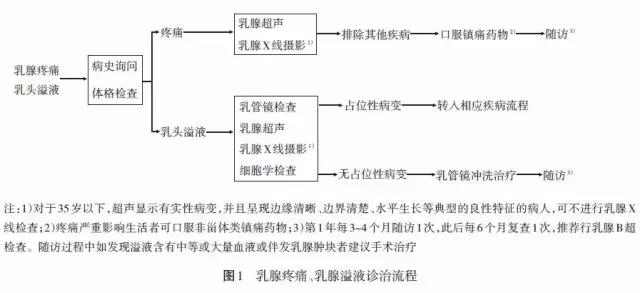
对所有疑诊为NPM 的病人,乳腺超声是首选的影像学检查方法[12]。乳腺X 线摄影适用于乳腺肿块、乳头溢液、乳腺皮肤异常、局部疼痛或肿胀的病人,对于35 岁以下,超声显示典型良性特征的病人,可不行该检查。另外,对怀疑NPM 的病人应积极留取病原学标本,通过镜检或细菌培养的方法寻找病原微生物存在的证据,有条件者可行核酸测序鉴定未知病原菌[13-14]。对于炎症急性期的病人还应监测血常规,尤其注意其白细胞总数和分类的变化。
2.3.2 可选择的检查项目
无急性炎症表现的乳头溢液病人可选择乳管镜检查,检查中注意与导管内乳头状瘤、纤维囊性腺病和导管原位癌(ductal carcinoma in situ,DCIS)相鉴别。细胞学检查因取材量小且病理学来源不清楚,可作为NPM 初步诊断参考,但不应作为最终诊断依据。磁共振成像(MRI)对NPM 的诊断及鉴别意义不大,且检查费用高,可作为判断病灶的性质、范围以及评估治疗效果及随访的影像学检查手段之一[15],不建议作为NPM 的常规检查项目。
2.3.3 其他检查项目
如C-反应蛋白(CRP)、红细胞沉降率(ESR)等炎症指标,IgG、IgM、IgA,抗核抗体谱等免疫指标,催乳素(PRL)等内分泌指标,风湿系列等。开展此类项目的检查,有助于明确NPM 的病因,找出更经济、更合理有效的诊治方法。
3.1 治疗原则
3.1.1 使用广谱抗生素控制急性炎症反应
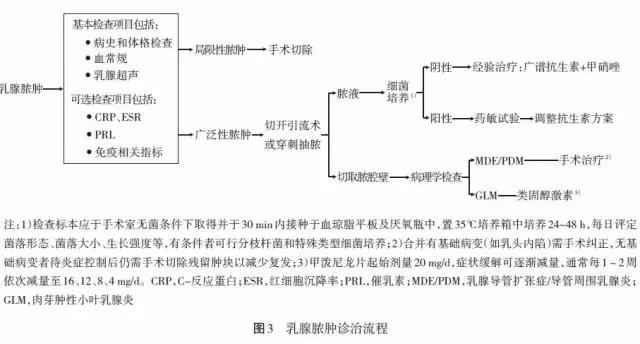
在未知感染菌种和药敏结果之前,采用大剂量联合广谱抗生素治疗;获得药敏结果后,依药敏结果选用敏感的抗生素。但专家组并不认为非急性期的病人需长期接受广谱抗生素治疗。
3.1.2 预防NPM复发
重视个体化诊疗,根据病理学类型选择合适的药物,结合病变特点选择最适宜的手术方式。
3.1.3 最大程度地保证乳房美观,改善生活质量
手术切除的范围与美观应在不同术式中体现,治疗过程中应注意对药物不良反应的监测并及时调整用药方案。
3.2 MDE/PDM 的治疗方案
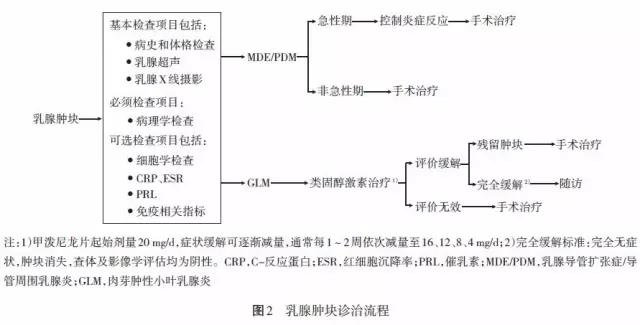
目前,MDE/PDM 的治疗仍以外科手术为主,局限性的肿块和外周型病灶可直接行肿块或区段切除手术治愈。在病变急性期应使用广谱抗生素联合甲硝唑控制炎症反应,手术宜在无明显急性炎症表现、肿块稳定且局限时进行。手术原则是必须完整充分切除病灶,术中应注意彻底切除所有肉眼可见的病变组织,尽可能保证阴性切缘,否则容易复发。
对于单发或多发较小的肿物可行肿块切除术,周围型肿块、药物治疗效果不佳肿物残留者可行乳腺区段切除术。对于已形成小的单发脓肿者,专家组推荐试行穿刺抽吸[16],脓肿较大、多房脓肿以及反复穿刺抽吸效果不佳者须行切开引流术,合并有基础病变(如乳头内陷)应手术纠正。而对于少数弥漫性病变,严重乳腺瘘管、窦道或者溃疡的病人,可行单纯乳房切除术,但要慎重选择。美容要求高的病人可Ⅱ期行乳房重建或假体植入术。
基于考虑存在非结核分枝杆菌(nontuberculous mycobacteria,NTM)感染[17],对反复发作形成窦道、病理学检查确诊为MDE/PDM 的病人采用抗分枝杆菌治疗已成共识,但目前普遍缺少明确的病原学证据,因此,仍处于探索阶段。治疗方案可选择异烟肼(300 mg,1 次/d)、利福平(450mg,1 次/d)、乙胺丁醇或吡嗪酰胺(750 mg,1次/d)[18]。并根据细菌亚群和药敏试验调整用药[19]。平均疗程为9~12 个月,抗分枝杆菌治疗对于没有基础病变的MDE/PDM 病人有较好的疗效,部分病人可因此免于手术,对于有多个严重乳腺瘘管或窦道,并与皮肤严重粘连形成较大肿块者,可以避免乳腺切除。治疗期间应注意监测药物性肝损害、听力下降、视力下降、高尿酸血症等不良反应。
3.3 GLM 的治疗方案
目前GLM 的治疗以类固醇激素治疗为主。激素的给药剂量按泼尼松0.75 mg/(kg·d)计算,一般甲泼尼龙片起始剂量20 mg/d,症状缓解可逐渐减量,通常每1~2 周依次减量至16、12、8、4 mg/d,直至症状完全缓解或稳定。多数专家认为应先用激素缩小病灶,然后再手术,不但可切除病灶、减少复发,而且可保持乳房的美观[20]。手术原则、手术时机及手术方式的选择同MDE/PDM。对于肿块局限者单纯的类固醇激素治疗可有效地避免手术且具有更好的美容效果[21]。
类固醇激素治疗过程中应注意不良反应,主要包括皮质功能亢进综合征(葡萄糖耐受不良、肥胖、骨质疏松及骨坏死等)、感染加重、诱发或加剧胃十二指肠溃疡等。
难治性NPM 常表现为单个或多发乳腺脓肿,形成窦道及瘘管,也可累及皮肤和皮下形成溃疡,多次治疗后仍反复发作,迁延不愈。对于此类病人仍应先获取病理学诊断,对病理学诊断明确的MDE/PDM 病人,可先尝试给予三联抗分枝杆菌药物,待病变局限或者瘘管闭合后视情况行肿物切除或瘘管切除术以减少复发。对病理学类型明确的难治性GLM 病人,可使用免疫抑制剂,推荐使用甲氨蝶呤(methotrexate,MTX)[22-23]。MTX 的剂量及使用疗程尚未统一,文献推荐在7.5~20.0 mg/周不等,每天须联合应用口服叶酸,预防出现叶酸缺乏综合征,治疗过程中还应注意复查MTX 引起的间质性肺炎。待病灶缩小或稳定后联合手术治疗。部分病人病理学诊断不典型,MDE/PDM 与GLM 鉴别困难,可多部位取材重复病理学检查,仍不能明确者可试行抗分枝杆菌联合类固醇激素治疗。对于多个瘘口或者瘘口与乳腺皮肤粘连严重形成较大包块者以及上述药物治疗效果不佳者,在充分征得病人及家属同意后可行单纯乳房切除术,美容要求较高的病人可Ⅱ期行乳房再造或假体植入术。
NPM 病因不明,临床过程复杂多变,全面认识其病理发展过程是诊治的关键,从而可根据该病不同的发展阶段和临床病理特点,采取相应的治疗对策。NPM 诊治专家共识制定是为了规范医疗工作,在临床应用中不能将临床诊疗模式化,应根据病人的病情、不同的需求、进行个体化的处理,并不断完善诊治流程,从而进一步提高诊治水平。
非哺乳期乳腺炎诊治流程见图1~4。

《非哺乳期乳腺炎诊治专家共识》
编写委员会
参与讨论专家(按姓氏汉语拼音顺序):曹旭晨,陈杏初,崔树德,段学宁,范志民,郭晓光,何建军,黄韬,蒋宏传,姜军,江泽飞,金锋,李波,厉红元,李晓曦,刘健,刘巍,刘荫华,刘运江,毛大华,马秀芬,欧阳涛,孙强,唐金海,田富国,王俊鹏,王宁,王颀,王殊,王翔,徐兵河,薛付忠,尉承泽,余之刚,张建国,郑莹,邹天宁
执笔者:周飞,刘璐,余之刚
(2016-03-20 收稿)

















共0条评论