[导读] 作者:慧海拾穗
胃肠道恶性肿瘤的免疫标志物评价(一)
摘要
与其他器官系统一样,免疫组织化学(IHC)可作为多种肿瘤性和非肿瘤性疾病的辅助诊断工具,包括感染、炎症状况的调查和胃肠道肿瘤分类。此外,IHC还可用于检测胃肠道癌的多种预后和预测性分子生物标记物。文献《An Update on the Role of Immunohistochemistry in the Evaluation of Gastrointestinal Tract Disorders》综述强调IHC在整个胃肠道常见诊断方案中的应用。主要讨论了IHC在胃肠道恶性肿瘤诊断中的应用,如腺癌与鳞状细胞癌,低分化恶性肿瘤的诊断与鉴别诊断,以及对罕见的胃肿瘤(产生α-甲胎蛋白的癌)和SWI/SNF复合物缺陷性癌的评估。最后,还对原发部位不明的神经内分泌肿瘤进行定位以帮助临床治疗,以及对HPV驱动的肛门肿瘤和IHC在基底样肛门肿瘤诊断中的作用进行了综述。
来源不明的神经内分泌肿瘤的定位
神经内分泌细胞遍布胃肠道,表现出内分泌、神经和上皮的某些组合特征。曾经被认为是在迁移到目的地之前从神经嵴产生的,现在的证据表明它们是从局部内胚层分隔产生的。这有着重要的后果,因为它允许IHC将位点特异性转录因子用于肿瘤起源的定位。高分化神经内分泌肿瘤(WDNET)的临床表现从惰性到侵袭性不等。相反,差分化神经内分泌癌(PDNEC)是高度侵袭性的病变,在分子水平上与WDNETs有很大区别。因此,美国癌症联合委员会的最新版本在分级和分期方面将WDNET从差分化神经内分泌癌中分离出来。肝脏是转移性WDNET最常见的部位。即使在转移发生后,定位原发灶也是有用的。例如,胃肠道的WDNETs会引起纤维化反应,使附近的肠道发生梗阻、缺血和穿孔的危险。原发性肿瘤切除及局部淋巴结转移可预防这些并发症,提高生存率。也有证据表明,一些孤立性肝转移患者可以从原发性肿瘤的外科切除和肝切除术中获益。各种常规和核放射技术可用于定位原发部位。在一项123例肝脏WDNET的研究中,最常见的原发灶是胰腺(35%),其次是小肠(27%)、结肠/直肠(12%)和肺(4%)。胃、肾和甲状腺的转移很少见。在成像技术和内窥镜检查相结合后,约20%的原发部位无法识别。因此,病理学家进行IHC以确定NET的原发部位是有价值的。CDX2和TTF-1是两种应用广泛的标记物,它们有助于定位原发部位。CDX2在约90~100%的空肠和90~100%的阑尾中表达。它在胃(15%)、十二指肠(30%)、胰腺(16%)和直肠(29%)WDNETs中的表达少见。重要的是,由于CDX2在肺WDNETs中的表达少见(3%),它有助于排除肺原发性WDNETs。TTF-1特异性强,但对肺原发病变不完全敏感。TTF-1在胃胰腺WDNETs中多为阴性,但在约30%~63%的肺WDNETs中呈阳性。因此,TTF-1阳性基本上证实了肺起源,同时排除了大多数其他原发部位。然而,缺乏TTF-1表达在这方面的信息量要少得多。最后,TTF-1在甲状腺髓样癌中也呈阳性,但这些癌不太可能以未知来源的转移出现。
鉴于胰腺是WDNETs转移到肝脏的最常见的起源部位,目前已经有大量的工作来鉴定胰腺WDNETs的特异性标记物。可能有用的免疫标记包括PAX8和Islet 1。Islet 1是参与胰岛细胞胚胎发生的转录因子。它与胰岛素基因的一个增强区结合,因此由所有非肿瘤性胰腺内分泌细胞表达。Islet 1在75~90%的胰腺WDNETs中阳性表达。在肠腔内,它在大多数十二指肠网、结肠和直肠NETs中表达,但在回肠WDNETs中很少表达。因此,有人认为,由Islet 1、CDX2和TTF-1这3个标记组成的套餐可以帮助确认胰腺、回肠和肺的转移性病变。不幸的是,Islet 1在这种特殊的诊断方案之外的作用有限,特别是在胰腺外差分化神经内分泌肿瘤如肺小细胞神经内分泌癌和Merkel细胞癌中也呈阳性,以及一些分化良好的神经内分泌肿瘤,如甲状腺髓样癌或副神经节瘤/嗜铬细胞瘤。Islet 1的表达不局限于胰腺高分化神经内分泌肿瘤,但也常见于胰腺外来源的高分化和差分化神经内分泌肿瘤。因此,肝脏中Islet 1阳性高分化NET最有可能是胰腺NET转移。然而,在极少数情况下,起源可能位于甲状腺(髓样癌)或肾上腺(嗜铬细胞瘤)。在这些病例中,检测降钙素和CEA有助于正确的鉴别诊断。PAX8是胰腺WDNETs的另一个有前景的标记物。PAX是一个转录因子家族,对肾脏、甲状腺、Müllerian和Wolffian导管的发育起重要作用。因此,类似于其他转录因子,如CDX2和TTF-1,这些器官发生的肿瘤表达PAX8。然而,已经证明PAX8也标记胰岛和胰腺WDNETs。早期报告显示PAX8在35~88%的胰腺WDNETs中呈阳性,而在回肠肿瘤中基本呈阴性。PAX8在起源于肺(0%~23%)和胃(10%~22%)的WDNETs中不常见,但更常见于来自十二指肠(100%)、胸腺(62%)、甲状旁腺(80%)和直肠(79%)的肿瘤。因此,肝脏中的WDNET,即CDX2-、TTF-1-、PAX8+,说明来自胰腺或十二指肠的可能性大。在这些WDNETs中PAX8表达的初步研究之后,Lorenzo及其同事的一份有趣的报告显示了对比结果。通过定量RT-PCR,他们未能检测到PAX8在内分泌胰腺中的表达。他们的结论是胰岛细胞上的PAX8免疫组化标记代表了PAX家族其他成员的交叉反应,特别是PAX6。在大多数实验室和几乎所有先前的免疫组化研究中使用的PAX8抗体是针对相对保守的N-末端结构域的多克隆兔抗体(prointech,Chicago,IL)。Lorenzo等人开发了针对PAX8特异性表位的小鼠单克隆抗体,发现它没有标记胰岛细胞。尽管用多克隆抗体标记可能最终不能代表“真正的”PAX8表达,但它仍然可以用于WDNETs的诊断。关于IHC在PDNEC定位中的应用文献报道有限。在临床上,不太重要的是定位原发部位,因为无论原发部位如何,使用铂类药物进行化疗通常都是必要的。此外,TTF-1和CDX2在PDNEC中的表达似乎与肺和肠的起源没有很好的相关性,正如它们在WDNETs评估中的那样。例如,TTF-1在食管(71%)、膀胱(39%)、前列腺(83%)和胃肠道(21%)的神经内分泌癌中常呈阳性。少数研究表明CDX2在PDNEC中的表达与肠道起源无关。Erickson等人发现,只有20%的结肠小细胞癌CDX2阳性。相反,Bari等人发现27%的肺神经内分泌癌CDX2阳性。因此,如果这种区别在将来具有临床意义,则需要用其他方法来代替现有的PDNECs原发部位定位的方法。
肛门肿瘤的免疫组织化学评价
(一)p16在鳞状上皮内病变分级中的应用
在文献中已经探索了多种生物标记物来帮助鳞状上皮内瘤变的分级。最广泛的研究是p16,它的积累意味着病毒驱动的细胞增殖。事实上,下生殖道鳞状上皮术语项目( LAST项目)在2012年发布的正式指南中包含了p16,该项目旨在统一HPV驱动的肛门生殖器鳞状上皮病变的术语,推荐鳞状上皮内病变分为两级:低级别上皮内病变(LSIL)和高级别上皮内病变(HSIL)。LSIL表示短暂性HPV感染,而HSIL则表示病毒DNA整合到宿主基因组中,促进肿瘤进展。总的来说,p16在82%的HSIL中呈阳性,而在LSIL中仅为7%,因此p16是区分两者的一个有用的生物标志物。p16阳性模式对肛门不典型增生的分型有重要意义。鳞状上皮强而弥漫的块状染色支持HSIL的诊断。更具体地说,LAST指南指出p16阳性是“基底细胞层的持续强核或核+细胞质染色,向上延伸至少涉及上皮厚度的三分之一。”局灶性或斑片状染色是非特异性的,可见于反应性上皮改变、移行上皮和LSIL。LAST项目在4种情况下推荐p16 IHC:(1)当鉴别诊断为HSIL和非肿瘤性类似病变时,如未成熟鳞状上皮化生、萎缩、修复性上皮改变和不相干的切片;(2)如果形态学改变模棱两可,介于明确的高级别病变和明确的低级别病变之间;(3)当病理医生在鉴别诊断之间存在诊断分歧时,包括高级别病变;(4)当形态学显示为LSIL,但丢失高级别病变的风险增加时,特别是当患者有HSIL史或其他高危细胞学诊断ASC-H、AGC(NOS)和ASCUS伴HPV 16的病史。很少有报告评估了LAST术语对HPV相关肛门病变和临床结果的影响。为了验证最后一条建议,即可疑病变应该用p16染色,Albuquerque等人评估了92个组织学特征在LSIL和HSIL(肛门上皮内瘤变2)之间不明确的肛门病变。在这个队列中,31个病灶(34%)p16阴性,因此降为LSIL。这些病变在短期随访中均未发展为HSIL或恶化。p16阳性者行消融治疗,无随访。这项研究似乎验证了p16的最后建议,但需要更大的队列来验证这一结论。
(二)基底样肛门肿瘤的免疫组织化学评价
肛管SCCs是肛管及肛周最常见的肿瘤。它们通常表现为基底样形态。在靠近肛周的病变中,鉴别诊断包括基底细胞癌(BCC)。尽管在这个区域很少见,但它们显示出与基底样鳞癌重叠的形态学特征。两者都显示深染的卵圆形细胞巢,淡染的嗜酸性到嗜碱性细胞质,周围核栅栏状,核分裂象多少不一。肿瘤的位置有助于区分两者。肛管鳞状细胞癌起源于肛管或肛缘/肛周(定义为肛管周围5cm的区域),而BCC则起源于肛缘皮肤。很少,BCC可以作为一个毗连的肿块伸入肛管。在这种情况下,很难区分BCC和SCC。Patil等人评估肛门区9例BCCs和15例基底细胞样SCCs的免疫组化差异。他们发现Ber-EP4、BCL2和p16的表达对这两个疾病的鉴别诊断最有帮助(图6)。Ber-EP4在BCC中阳性率为100%,在SCC中阳性率为40%。BCL2在BCC中阳性率为100%,在SCC阳性率为33%。弥漫性p16在93%的SCC中表达,而在0%的BCC中表达。形态学上,肛周位置、人工牵拉的存在和非典型核分裂象的缺乏也是优先支持BCC而不是SCC的特征。
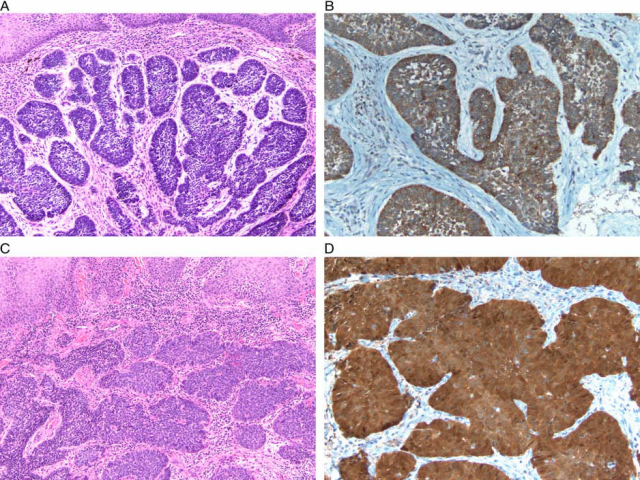
图6 肛门基底细胞癌和鳞状细胞癌:由嗜碱性细胞巢组成的肿瘤,鳞状上皮下有周围的栅栏和收缩伪影,与基底细胞癌(A)一致。这些细胞对BER-EP4(B)呈阳性反应。肛门鳞状细胞癌(C)中p16(D)呈弥漫阳性














共0条评论