[导读] 整理:肿瘤资讯;来源:肿瘤资讯
随着影像学检查手段的完善和分子检测的发展,非小细胞肺癌患者的诊断和治疗不仅需要考虑临床病理特征和常见驱动基因的检测,更需要通过影像学检查将患者按照不同的复发风险分组、针对性地制定手术方案或术后辅助治疗方案,也需要寻找现新型的分子基因靶点、进一步完善非小细胞肺癌这一异质性极强的恶性肿瘤的诊治模式。2019年,陈海泉教授团队连续在肿瘤学界期刊Journal of Thoracic Oncology上发表多篇文章,为上述问题提供了更新的思路。

肺癌的特殊临床亚型——部分实性小结节[1]

研究背景
随着近年来高分辨CT检查技术的提高和日益普及,肺内结节的诊断率不断增加。根据2017年Fleischner SoCIety发表的指南,依据薄层CT扫描上呈现的肺结节密度,将亚实性肺结节分为纯磨玻璃样结节(pure ground glass nodules, pGGNs)(仅仅有磨玻璃样成分)或者部分实性肺结节(part-solid nodules, PSNs)(包含磨玻璃样成分和实性成分)。既往的研究报道显示,病灶大小和实性成分的比例是影响无疾病生存期(DFS)和总体生存期(OS)的预后因素。2017年,Matsunaga等人的研究指出,实性肿瘤比例(即实性部分占整个肿瘤大小的比例,consolidation-to-tumour ratio,CTR)以0.5为分界值,肺结节CTR大于0.5的患者,其肿瘤侵犯淋巴管或血管的风险更高,且无复发生存期(RFS)更差。也有研究得出相反的结果,即无论CTR值、肿瘤最大径或者肿瘤实性成分的大小,都不能预测部分实性肺癌患者的OS。也就是说,目前,部分实性肺肿瘤(PSNs)尚无准确的临床定义和分类标准。为了回答这个临床问题,陈海泉教授团队开展了该研究。
研究方法
入组患者:
陈海泉教授团队回顾性分析了2008年1月至2014年12月期间、就诊于复旦大学附属肿瘤医院、接受了完全性手术切除的肺部小结节患者。入组标准为根据第八版TNM分期标准、病理诊断为IA期肺癌的患者。排除标准包括:1)病理诊断为良性、非典型腺样过度增生结节;2)同时性发现多原发的亚实性和纯磨玻璃样结节;3)未在复旦大学上海肿瘤中心接受薄层CT扫描或者影像学检查不完善的患者。
影像学及病理学检查:
实性肿瘤比例(consolidation-to-tumour ratio,CTR)的定义依据是:薄层CT扫描的各个层面上,其中实性成分的最大径占整个肺结节病灶最大径的比例。如果为纯磨玻璃样结节,CTR为0;部分实性肺结节,其范围在0和1之间;实性肺结节,其CTR为1。
术后病理诊断依据IASLC标准,将肺结节诊断为原位癌、微小浸润性腺癌、浸润性腺癌。其中,浸润性腺癌的诊断进一步依据其占比最高的主要病理亚型,分为贴壁样、腺泡样、乳头状、微乳头状、或实性为主型肺腺癌。
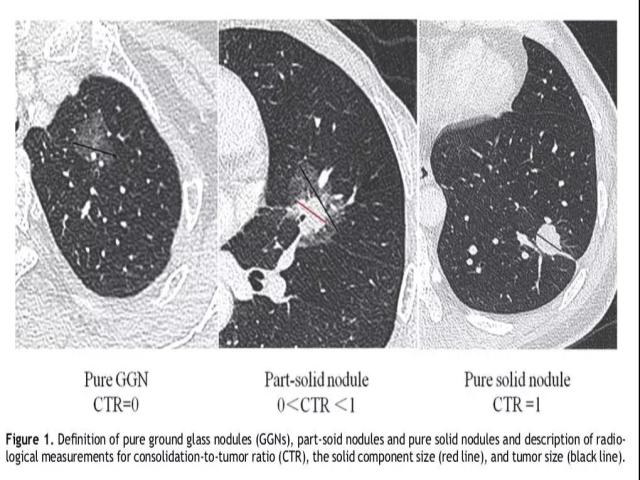
研究结果
基线资料:
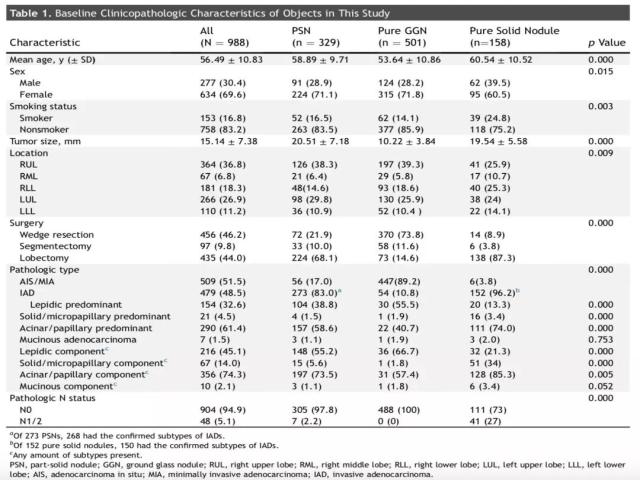
团队共回顾性筛选了来自1212例患者的1339个肺结节。其中,75位患者的85个肺结节诊断为良性病灶,46例患者的62个肺结节诊断为非典型腺样过度增生(AAH),17例患者诊断为同时性多原发的亚实性和纯磨玻璃样结节、共计38个肺结节,另外163位患者未在复旦大学上海肿瘤中心接受薄层CT扫描或者影像学检查不完善。最终,来自911例患者的988个肺结节纳入本研究的分析,包括329个部分实性肺结节、501个纯磨玻璃样肺结节、以及158个纯实性肺结节。(详细基线资料见表1)
部分实性肺结节患者中,非吸烟者占83.5%,高于纯实性肺结节患者中的非吸烟者比例(75.5%)(p = 0.003)。部分实性肺结节的中位肿瘤直径为20.51 ± 7.18 mm,显著大于纯磨玻璃样结节(10.22 ± 3.84 mm) (p < 0.001),但与纯实性肺结节的直径相当(19.54 ± 5.58 mm)(p = 0.066)。
部分实性肺结节患者中,贴壁样为主型肺腺癌患者的比例,显著高于实性肺结节患者(38.8% versus 13.3%)(p < 0.001);相应地,部分实性肺结节中,实性或者微乳头状生长方式为主型肺腺癌的比例,显著低于实性肺结节患者(1.5% versus 3.4%)(p < 0.001)。
部分实性肺结节的特征:
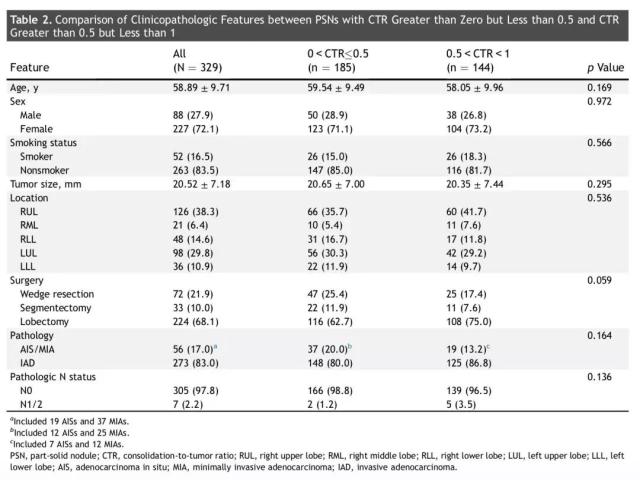
研究中一共纳入329例部分实性肺结节患者进行分析。以CTR值0.5为分界点,0 < CTR < 0.5的部分实性肺结节有185个,0.5 < CTR < 1的部分实性肺结节有144个。(其临床特征详见表2)大部分临床特征在两组中无统计学差异。但是,0 < CTR < 0.5的部分实性肺结节患者中,有两例证实有淋巴结转移(1.2%);在0.5 < CTR < 1的部分实性肺结节患者中,5例患者存在淋巴结转移(3.5%)。
生存分析:
入组患者的中位随访期为42.22个月。入组的911例患者中,其中5例无随访数据,81例患者出现疾病复发(8.89%),36例患者死亡(3.9%)。根据研究定义的肺癌相关的无复发生存期(LCS ~ RFS),5年无复发生存率为88.30%(95% CI: 85.31% ~ 90.71%),5年总体生存率为94.87%(95% CI: 92.39% ~ 96.56%)。
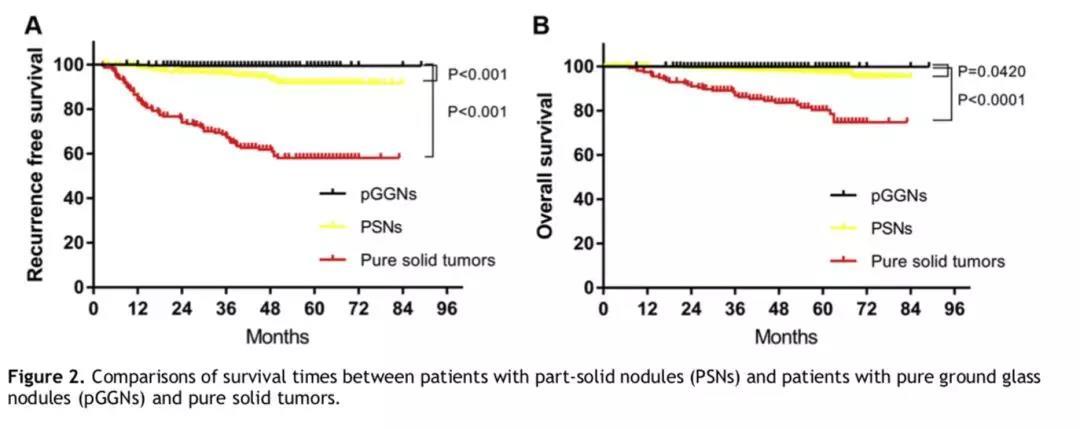
根据纯磨玻璃样结节、部分实性结节和纯实性结节三个分组的分析,部分实性肺结节患者的5年LCS-RFS率(91.74% [95% CI: 87.15% ~ 94.74%]),低于纯磨玻璃样结节组(99.43% [95% CI: 98.25% ~ 99.82%])(p < 0.001),但又优于实性肺结节组(58.08% [95% CI: 49.33% ~ 65.77%]) (p < 0.001)。同样地,部分实性肺结节患者的5年肺癌相关的总体生存率(LCS-OS)(98.13% [95% CI: 95.52% ~ 99.23%]),显著低于低于纯磨玻璃样结节组(100% [p = 0.042]),优于实性肺结节组(80.27% [95% CI: 72.27% ~ 86.19%]) (p < 0.0001)。(详见图2)
部分实性肺结节患者的生存分析:
0 < CTR < 0.5以及0.5 < CTR < 1的部分实性肺结节,其5年肺癌相关的RFS率和OS率均无显著差异。0 < CTR < 0.8以及0.8 < CTR < 1的部分实性肺结节,也无生存差异。(详见图3)
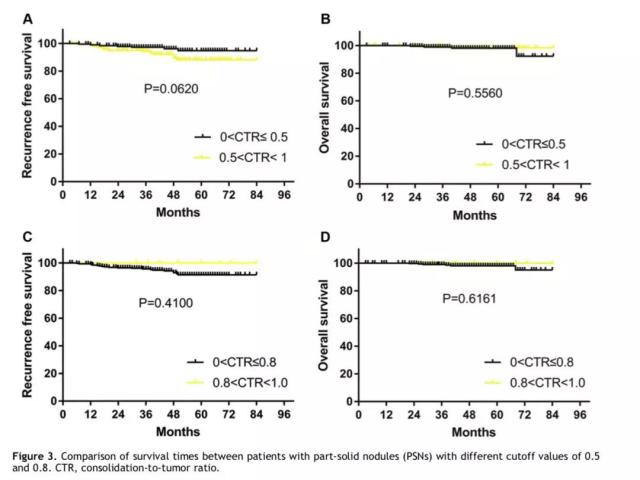
肿瘤大小对生存期的影响:
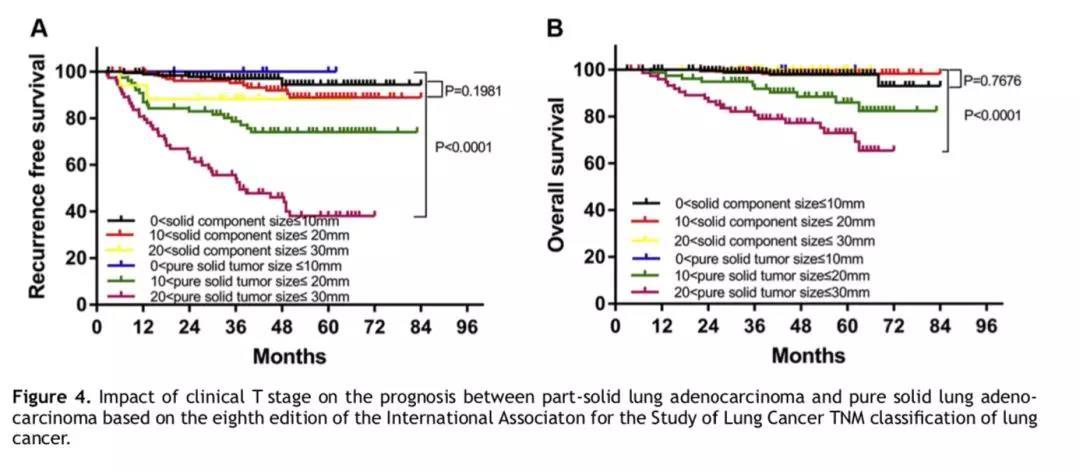
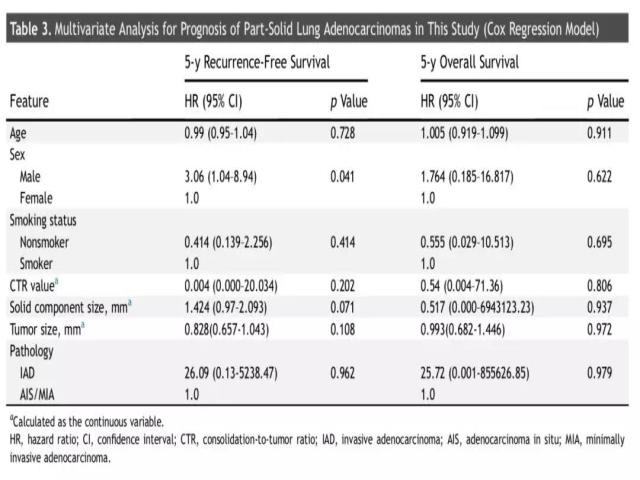
研究者分析了TNM分期中肿瘤大小对生存期的影响。由图4可以看出,即便T分期诊断相同(cT1b和cT1c),部分实性肺结节患者的5年LCS RFS和OS率均优于纯实性肺结节患者。由此可见,肿瘤大小仅能影响纯实性结节患者的预后,但是实性成分的大小并不能预测部分实性肺结节患者的生存获益。Cox回归模型分析也显示(表3),CTR值、实性成分大小均不能预测部分实性肺结节患者的5年LCS RFS和OS率。
接着,研究者针对部分实性肺结节患者、进行了Logistic回归模型的分析。结果显示,CTR值越高(OR = 12.90, 95% CI: 1.85 ~ 90.04, p = 0.010)、实性成分越大(OR = 1.45, 95% CI: 1.28 ~ 1.64, p = 0.000)、 肿瘤越大(OR = 1.23, 95% CI: 1.14 ~ 1.31, p = 0.000),其病理诊断为浸润性肺腺癌的可能性就越高。
研究结论及讨论:
陈海泉教授团队的这篇文章详细分析了部分实性肺结节的临床病理特征,并认为部分实性肺结节比实性肺结节发生淋巴结转移的风险更低。但是,CTR值、实性成分大小或者肿瘤大小,均不能有效预测部分实性肺结节患者的生存预后,说明部分实性肺结节患者可能是一个特殊的亚型,对于小于2cm的肿瘤,临床上可以考虑亚肺叶手术切除。
中国肺癌人群中的新型基因突变检测[2]

研究背景
近年来,肺腺癌的靶向治疗治疗,主要针对相应的驱动基因突变而选择合适的药物,比如EGFR敏感突变、ALK基因融合等。同时,随着检测技术手段的发展,越来越多的罕见突变基因被发现,比如NTRK、NRG1、FGFR、EGFR、MET、BRAF以及ERBB2融合等。但是,约有16.7%的肺腺癌患者不存在常见的驱动基因改变,导致其治疗方案的选择较为局限。
一般来讲,肺腺癌的多个驱动癌基因改变很少共存,所以,不存在常见驱动基因异常的肺腺癌患者,有可能存在一些其他新型的驱动基因改变。基于既往的研究报道,陈海泉教授团队采取了一种基于RNA的二代测序手段,检测不存在常见驱动基因改变的肺腺癌患者的14种已知的肺腺癌融合基因改变。
研究方法
入组患者:
研究者收集了2007年10月至2015年1月期间、就诊于复旦大学附属肿瘤医院、接受了完全性手术切除的患者的冰冻肺腺癌组织。术前接受过新辅助治疗的患者未纳入该研究。
检测方法:
提取的DNA和RNA进行驱动基因的检测。首先,RT-PCR和Sanger测序用于分析如EGFR (18~22外显子)、 HER2 (18~21外显子)、 KRAS (2~3外显子)、BRAF (11~15外显子)、MET (13~15外显子)等基因;其次,基于定量RT-PCR的融合基因检测方法,用于检测ALK、ROS1以及RET基因的易位。同时,对已有报道融合形式的FGFR1/2/3和NRG1融合基因进行了检测;最后,采用多重RT-PCR以及FISH,确认上述基因的检测结果。
此外,锚定多重PCR和采用ArcherDx FusionPlex试剂盒的定向二代测序,用于检测其他新型融合基因的检测(比如EGFR、 KRAS、 BRAF,、MET、 ALK,、RET、ROS1、NRG1,、FGFR1/2/3、NTRK1/2/3)。
研究结果
基线资料:
研究者首先分析了1681例肺腺癌患者的9个常见驱动基因突变以及融合基因改变,即EGFR、KRAS、HER2、BRAF、MET、ALK、RET、ROS1以及FGFR基因。通过图1的筛选过程,最终有255例(15.2%)患者为常见驱动基因突变阴性的肺腺癌。其中,有足够的肿瘤组织和RNA标本送检NGS的肺腺癌标本有177个。(详细基线资料见表1)
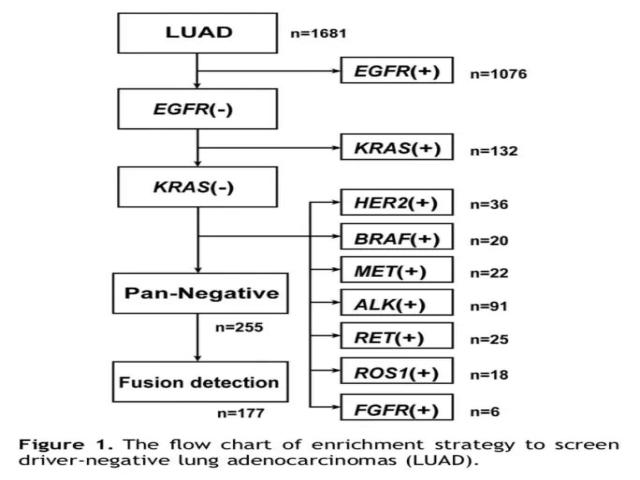
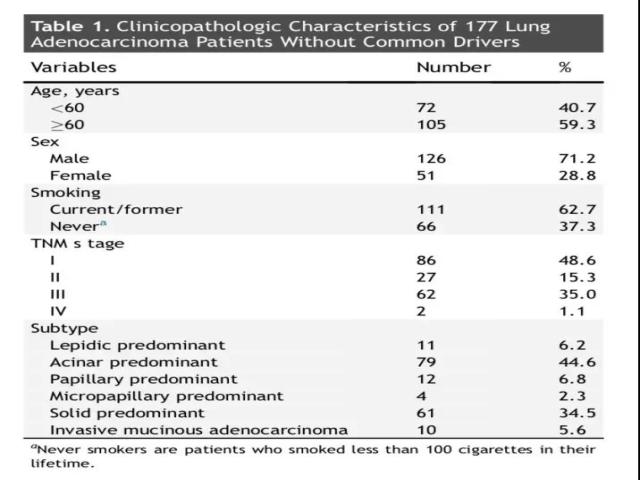
新型融合基因靶点的分析:
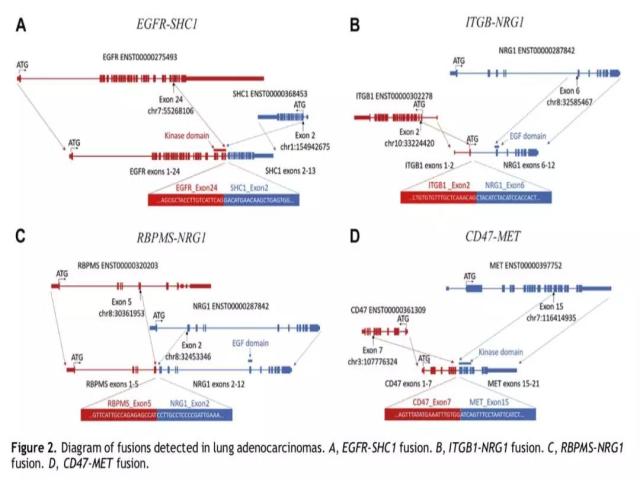
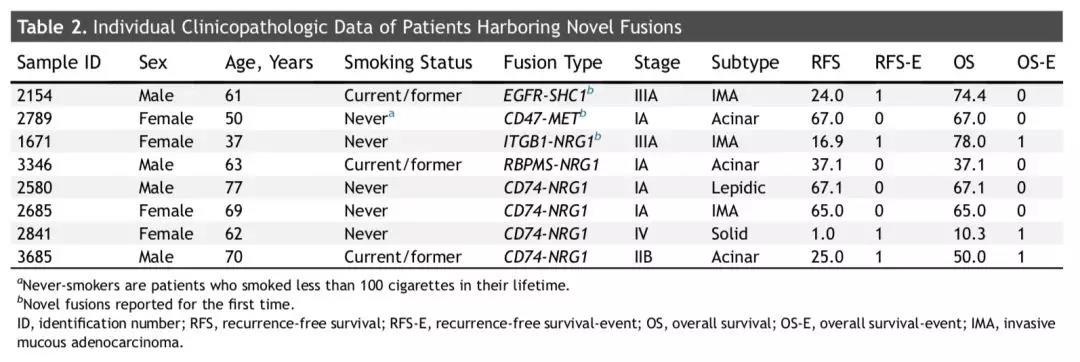
常见驱动基因阴性的177例患者中,共检测出8例患者存在其他融合基因改变(4.5%),包括6例 NRG1 基因融合 (其中,4例为CD74-NRG1融合,1例为 ITGB1-NRG1融合,另外1例为RBPMS-NRG1融合)、1例EGFR基因融合(即EGFR-SHC1基因)、1例MET融合(CD47-MET基因) (详见图2)。在上述检测到的融合基因改变中,有三个融合基因为本研究首次报道,即ITGB1-NRG1基因融合、EGFR-SHC1基因融合、CD47-MET基因融合。
结合肺腺癌的病理亚型来看,这8例患者中,3例患者为浸润性黏液性肺腺癌,3例为腺泡样生长方式为主型肺腺癌。此外,5例为非吸烟患者,另外3例为吸烟者。(详见表2)
研究结果及讨论
该研究通过采用RNA 靶向二代测序技术,全面检测了常见驱动基因阴性的肺腺癌中新型融合基因改变的发生率,并发现这些融合基因多发生在NRG1、EGFR以及MET基因。其中,NRG1融合基因的发生率最高。
实性和部分实性小结节的预后影响因子[3]

研究背景
迄今为止已经有多项研究显示,肺结节的磨玻璃样成分(GGO,ground-glass opaCIty)可以预测非小细胞肺癌患者的预后。但是,目前尚无研究表明磨玻璃结节的非小细胞肺癌和实性肺癌的预后因子有哪些不同。根据肺癌的病理诊断标准,肺癌可以分为原位腺癌(AIS)、微小浸润性肺腺癌(MIA)、浸润性肺腺癌(IAD)。影像学表现为磨玻璃样成分的肺结节中,大约10%的最终病理诊断为原位腺癌或者微小浸润性肺腺癌,且极少出现疾病复发。但是,关于磨玻璃样成分的I期浸润性肺癌却鲜有报道,这些患者有哪些临床病理特征呢?这些特征是否与患者的生存预后相关?陈海泉教授团队针对这些问题,回顾性分析了大样本数据。
研究方法
入组患者:
研究者回顾性收集了2008年4月至2015年12月期间、就诊于复旦大学附属肿瘤医院胸外科、接受了根治性手术切除且病理诊断为I期非小细胞肺癌的患者。大部分患者接受了肺叶切除术,所有患者均接受了系统性淋巴结清扫。排除标准:1)病理诊断为原位腺癌或者微小浸润性肺腺癌;2)术前接受过新辅助治疗。患者的其他相关临床资料也纳入分析。
影像学及病理学评估:
实性肿瘤比例(consolidation-to-tumour ratio,CTR)定义为薄层CT扫描的横截面上实性成分的最大径占整个肺结节病灶最大径的比例。如果为纯磨玻璃样结节,CTR为0;部分实性肺结节,其范围在0和1之间;实性肺结节,其CTR为1。术后病理诊断依据IASLC标准,将肺结节诊断为原位癌、微小浸润性腺癌、浸润性肺癌。其中,浸润性腺癌的诊断进一步依据其占比最高的主要病理亚型,分为贴壁样、腺泡样、乳头状、微乳头状、或实体亚型为主肺腺癌。
研究结果:
基线资料:
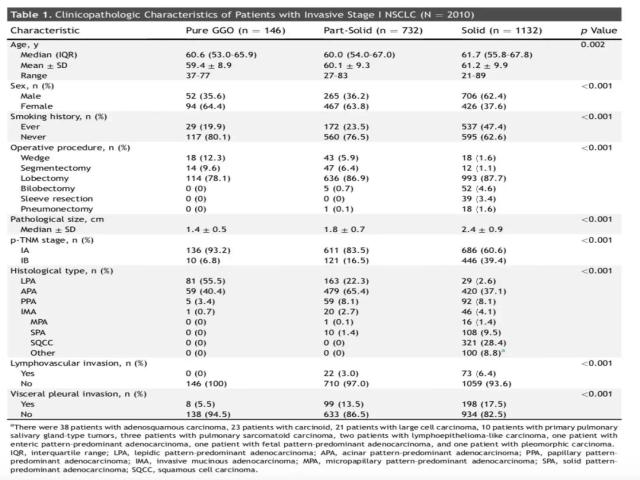
共计2010例患者入组。其中,146 (7.3%) 例患者为纯磨玻璃样结节组,732 (36.4%) 例患者为部分实性肺结节组,1132 (56.3%)例患者为实性肺结节组。(详见表1)三组患者的年龄、性别、手术方式、肿瘤大小、病理TNM分期、病理亚型、是否淋巴脉管侵犯等临床特征方面有统计学意义(p < 0.05)。纯磨玻璃结节组和部分实性肺结节组的非吸烟患者比例高于实性肺结节组。病理诊断中,贴壁样生长方式为主型肺腺癌,在纯磨玻璃样结节组、部分实性结节、实性肺结节组分别为81 (55.5%)例、163 (22.3%) 例、29 (2.6%)例。所有的肺鳞癌均为实性肺结节组
入组患者的中位随访时间为47.7个月(32.0~63.9)。323例患者出现疾病复发。IA期患者中,5年无复发生存率为80.3%,5年总体生存率为88.2%。
GGO成分的预测价值:
纯磨玻璃样结节组、部分实性结节组、实性肺结节组的三组患者,其5年无复发生存率分别为100%、87.6%、73.2%,三组间有统计学差异。5年总体生存率仅在部分实性肺结节组和实性肺结节组中有统计学差异,分别为94.9%、83.4%,纯磨玻璃结节组的5年总体生存率为98.5%。(详见图2)
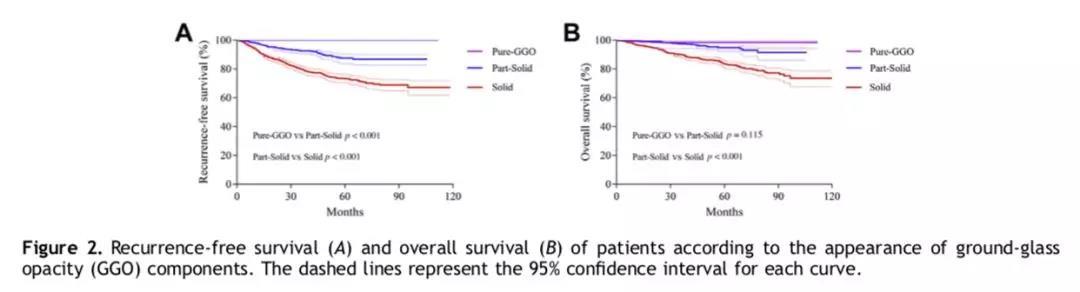
Cox比例风险模型显示,I期非小细胞肺癌的无复发生存相关的独立预后因素包括年龄(危险比HR = 1.012,p = 0.036)、磨玻璃样成分(HR = 0.426,p < 0.001)、肿瘤大小(HR = 1.348, p < 0.001)、病理类型(p = 0.024)、淋巴脉管浸润(HR = 1.638, p = 0.011)、胸膜侵犯(HR = 1.366, p = 0.022)。(详见表2)
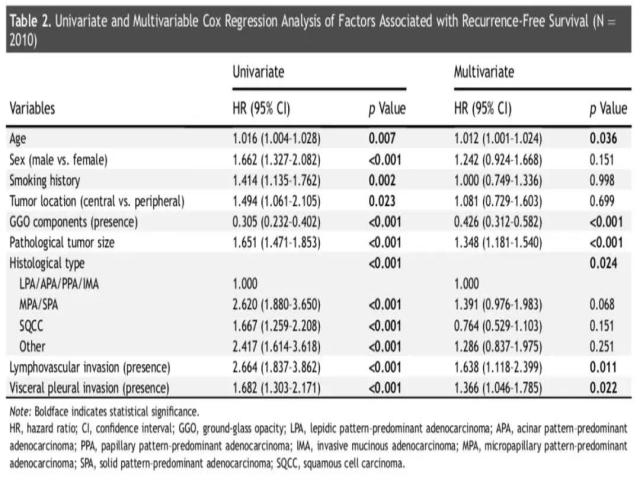
部分实性肺结节和实性肺结节:预后因子有哪些差异?
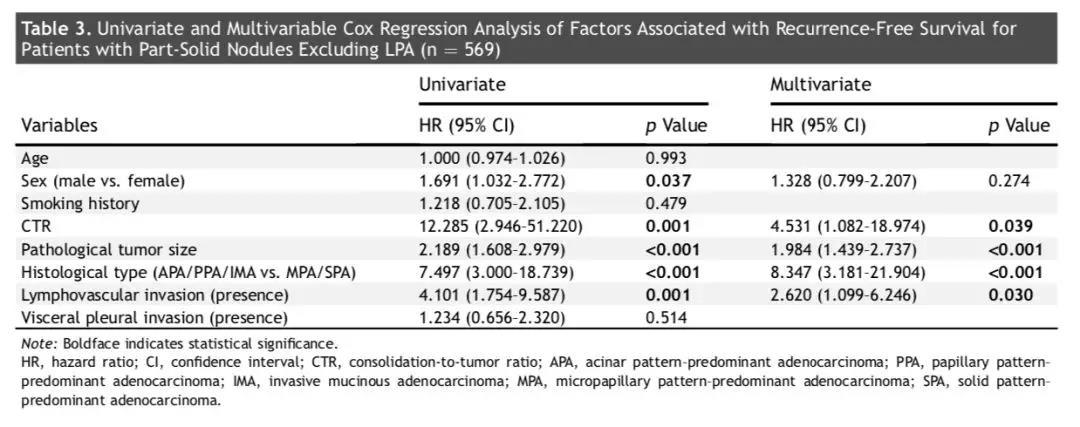
贴壁样生长方式为主型肺腺癌的5年无复发生存率为100%。为了更好地分析部分实性肺结节和实性肺结节的不同预后因子,贴壁样生长方式为主型肺腺癌未纳入该部分的分析。由表3的单因素分析可知,性别男性(HR = 1.691, 95% CI: 1.032~2.772, p = 0.037)、CTR值较高 (HR =12.285, 95% CI: 2.946~51.220, p =0.001)、肿瘤大小 (HR =2.189, 95% CI: 1.608~2.979, p < 0.001)、病理亚型(微乳头状或实性生长方式为主型肺腺癌 vs 贴壁样/腺泡样/乳头状生长方式为主型以及浸润性粘液腺癌)(HR = 7.497, 95% CI: 3.000~18.739, p < 0.001)、淋巴脉管侵犯 (HR =4.101, 95% CI: 1.754~9.587, p =0.001)是较差无复发生存率的影响因素。
表3的多因素分析结果显示,CTR值较高(HR = 4.531, 95% CI: 1.082~18.974, p = 0.039)、肿瘤直径越大 (HR = 1.984, 95% CI: 1.439~2.737, p < 0.001)、主要病理亚型为微乳头状或实性生长方式(对比贴壁样/腺泡样/乳头状生长方式为主型以及浸润性粘液腺癌:HR = 8.347, 95% CI: 3.181~21.904, p < 0.001)、淋巴脉管侵犯(HR = 2.620, 95% CI: 1.099~6.246, p = 0.030),是无复发生存较差的独立预测因素。
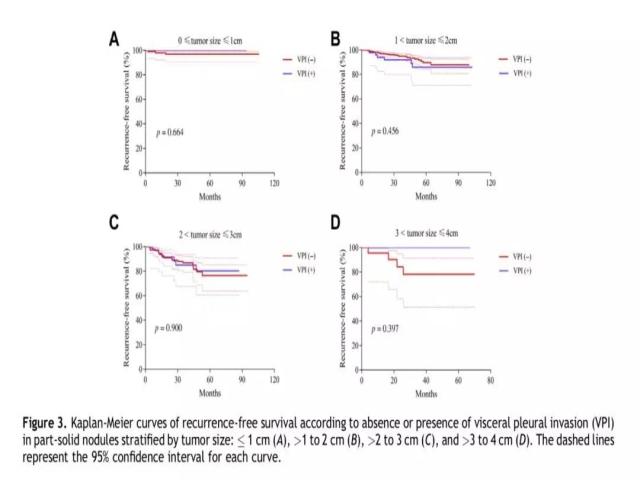
本研究表明,胸膜浸润与否在磨玻璃结节组中并不是预后因子 (HR = 1.234, 95% CI: 0.656~2.320, p = 0.514)。随后,研究者将部分实性肺结节按照肿瘤直径进行了分组,即<1cm、1~2cm、2~3cm、3~4cm共四个亚组,再分析胸膜浸润与否对临床预后的影响。生存分析结果显示,四个亚组中,无论是否存在胸膜浸润,其无复发生存均无统计学差异(p = 0.664、p = 0.456、p = 0.900、p = 0.397;图3)。
同样地,针对实性肺结节患者的无复发生存,其单因素和多因素Cox回归分析详见表4。年龄较大(HR = 1.016, 95% CI: 1.003~1.029, p = 0.015)、肿瘤直径越大 (HR = 1.226, 95% CI: 1.073~1.401, p = 0.003)、淋巴脉管侵犯(HR = 1.725, 95% CI: 1.141~2.609, p = 0.010)、胸膜浸润(HR = 1.545, 95% CI: 1.168~2.043, p = 0.002)是影响无复发生存的因素。多因素分析表明,年龄较大(HR = 1.014, 95% CI: 1.001~1.027, p = 0.030)、肿瘤直径较大 (HR = 1.188, 95% CI: 1.038~1.361, p = 0.013)、淋巴脉管侵犯(HR = 1.421, 95% CI: 1.071~1.885, p = 0.015)可以独立地预测患者的预后。
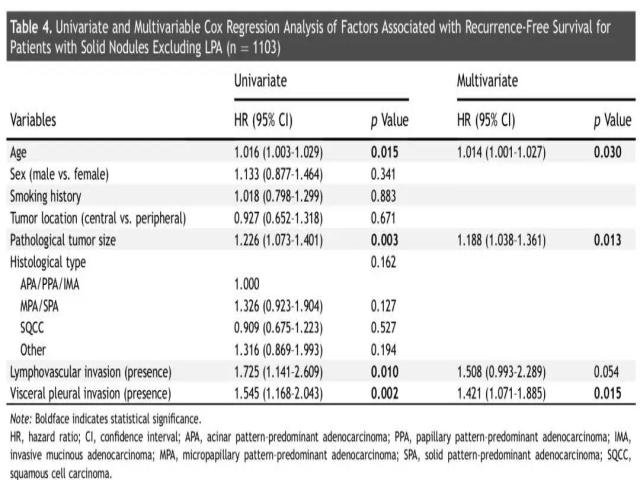
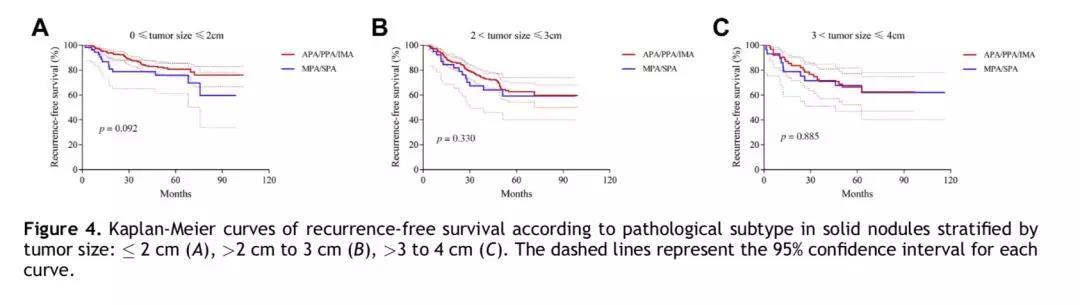
本研究表明,腺癌亚型在实性结节组中并不是预后因子(p = 0.162)。根据肿瘤直径的大小,实性肺结节组的患者被分为三组,即0~2cm、2~3cm、3~4cm。但是,三个亚组中,主要病理亚型为微乳头状或实性生长方式,对比贴壁样/腺泡样/乳头状生长方式为主型以及浸润性粘液腺癌,其无复发生存均无统计学差异(p = 0.092,p = 0.330, p = 0.885;图4)。
研究结论及讨论:
磨玻璃样成分的存在与否,能够预测I期非小细胞肺癌患者的无复发生存;部分实性肺结节患者的预后优于纯实性肺结节患者,但不如纯磨玻璃样肺结节的患者;淋巴脉管侵犯和病理亚型对部分实性肺结节和实性肺结节患者临床预后的影响截然不同。胸膜浸润与否在亚实性结节组无预后价值,腺癌亚型在纯实性结节组亦无预后价值。第九版的非小细胞肺癌TNM分期需要将本研究的结果纳入参考。
参考文献
1. Ye T, Deng L, Wang S et al. Lung AdenocarCInomas Manifesting as Radiological Part-Solid Nodules Define a SpeCIal Clinical Subtype. Journal of ThORaCIc Oncology 2019; 14(4):617–627.
2. Pan Y, Zhang Y, Ye T et al. Detection of Novel NRG1, EGFR, and MET Fusions in Lung AdenocarCInomas in the Chinese Population. Journal of ThORaCIc Oncology 2019. doi:10.1016/j.jtho.2019.07.022.
3. Fu F, Zhang Y, Wen Z et al. Distinct Prognostic FactORs in Patients with Stage I Non–Small Cell Lung Cancer with Radiologic Part-Solid OR Solid Lesions. Journal of ThORaCIc Oncology 2019. doi:10.1016/j.jtho.2019.08.002.



































共0条评论