[导读] 编译整理:强子
美国病理学家协会(College of American Pathologists,CAP)官方期刊《Archives of Pathology & Laboratory Medicine》就某些病种以《Resident Short Review》栏目的方式刊发过相关文章。这类文章针对性强,阐述详尽,对于年轻病理医师的学习极有帮助。本期我们选择其中一期关于分化型外阴上皮内瘤变(differentiated vulvar intraepithelial neoplasia,dVIN)的文章进行编译,希望有助于各位病理同仁对该病变的了解和掌握。
概述
外阴鳞状细胞癌的癌前病变主要有两种病理机制,一种是人乳头状瘤病毒相关者,称之为经典型或普通型外阴上皮内瘤变(usual-type vulvar intraepithelial neoplasia,uVIN);另一种与人乳头状瘤病毒无关者,称之为分化型或单纯型外阴上皮内瘤变(differentiated vulvar intraepithelial neoplasia,dVIN)。前者与高危型人乳头状瘤病毒有关,而后者可能与炎性皮肤病有关。
首例dVIN是1961年报道的,当时称之为单纯型上皮内癌;1977年开始称之为分化型、以突出其单纯型分化性组织学特征。经过50余年研究,目前已经明确该病变是一种与人乳头状瘤病毒无关的高级别异型增生,可很快进展为外阴鳞状细胞癌。
临床特征
最近30余年,uVIN和dVIN的发病率均增加。相比uVIN来说,dVIN患者年龄一般稍大,平均68岁。dVIN的临床表现与硬化性苔藓、慢性单纯性苔藓有一定重叠。临床一般表现为单灶病变,而uVIN则多表现为多灶病变。大体一般为灰白色、褪色性病变,表面粗糙,或凸起性结节。临床多有慢性炎症性皮肤病的背景。dVIN患者病灶周围常见外阴鳞状细胞癌、或曾有外阴癌的病史。
组织病理学表现
即使富有经验的专业妇科病理医师,有时也很难明确病变是否为dVIN。不过,有研究表明经针对相关诊断标准进行专门培训后,则诊断的一致性大大升高。如临床高度可疑dVIN而病变表现不典型,则建议由富有经验的专业妇科病理医师做出诊断。
如其名字-分化型外阴上皮内瘤变所示,该病变为基底层上方鳞状细胞异常高分化、或反常成熟(paradoxical maturation)。与uVIN相反,dVIN一般并无全层的异型性,仅在基底层、副基底层(上皮的下2/3)有中度至重度的细胞学异型性。

图1. 分化型外阴上皮内瘤变;显著异型仅限于基底层及副基底层;上方表皮有角化不全及嗜酸性粒细胞浸润。右图示基底层具有异型性,病变中细胞核具有多形性,可见细胞间桥。
诊断dVIN最常用的组织学标准有:基底层具有非典型核分裂,基底层细胞具有异型性,可见显著核仁,有角化不全,表皮突拉长、相互吻合。但目前并不明确是否需有上述全部组织学改变才可诊断dVIN。相关研究表明,专家公认仅基底层细胞具有异型性这一点可视为有诊断价值,而其他组织学表现则支持这一诊断。
基底层非典型是指细胞核增大、细胞核轮廓不规则、基底层增生、染色质粗糙或细胞核呈空泡状、显著程度不等的核仁、散在核分裂(尤其非典型核分裂)。角化不全则是指单个细胞具有成熟异常,表皮深层常伴异常角化。也可出现明显的细胞间桥、表浅处具有胞质嗜酸性的未成熟细胞。
从实际诊断角度来说,大部分dVIN都会表现为下述四种组织学表现中的一种,也可混合存在:(1)基底层显著异型性,伴硬化性苔藓或慢性单纯性苔藓;(2)伴慢性单纯性苔藓的基底层增生;(3)细胞成熟缺陷(单个细胞胞质增多、胞质出现异常角化);(4)表皮下三分之一出现海绵状水肿或棘层松解。了解这些不同的组织学表现,有助于识别dVIN。
偶有dVIN可表现为基底样特征,如细胞核异型性超出基底层、结构紊乱、均一的基底样未分化角质细胞。这种情况下可类似uVIN,但不表达p16、人乳头状瘤病毒检测阴性,p53突变型表达。
辅助检查
uVIN的诊断中,辅助检查的意义明确并可排除其他类似病变。作为高危型人乳头状瘤病毒感染检测的替代指标,几乎100%的uVIN中免疫组化p16为阳性,且其阳性结果为连续的弥漫性、强阳性,细胞核和/或胞质着色。基底层应有着色,且阳性表达至少累及表皮全层的1/3。与此相比,dVIN中仅有不足17%的病例表现为弱的、非连续性p16着色,且局限于表皮下层。
80%以上的dVIN由于具有TP53突变,因此免疫组化p53为突变型着色;而人乳头状瘤病毒相关的uVIN中则一般为野生型。dVIN中p53的着色一般为基底层强阳性(90%以上的基底层细胞着色)并向基底层上延伸;周围正常上皮中10%以下的基底层细胞呈斑片状着色,且不向基底层上延伸。dVIN中p53染色还可表现为细胞核着色完全缺失。
由于p53免疫组化着色形式表现不一,且硬化性苔藓、慢性单纯性苔藓中也可出现p53阳性着色,而这些病变同时又会和dVIN有形态学上的相似性,因此dVIN中免疫组化指标应用还有一定局限性。总体来说,需紧密结合形态学表现、并严格把握p53和p53的免疫组化着色判读,才能尽可能准确的做出明确诊断。
Ki-67可用于鉴别dVIN和反应性改变、正常上皮、uVIN。正常上皮及反应性改变时,基底层及副基底层Ki-67阴性或局灶弱阳性;dVIN时基底层及紧邻基底层处Ki-67阳性比例稍增加,而uVIN时则为全层阳性。硬化性苔藓、慢性单纯性苔藓中Ki-67可出现局灶阳性。
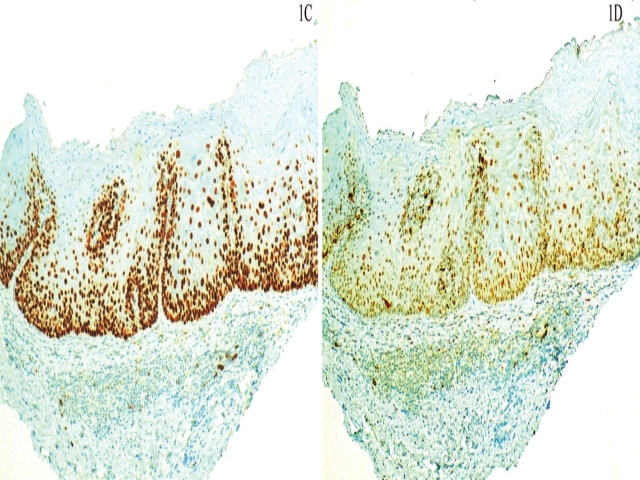
图2. (左)dVIN中,基底层、副基底层细胞p53呈细胞核强阳性着色,提示有TP53基因突变;(右)dVIN中,基底层及紧邻基底层处细胞Ki-67阳性细胞数量轻度增加。
其他标记物用于dVIN诊断的相关研究正在进行中,尚需大规模病例验证。最近有研究称CK17可用于dVIN、uVIN、硬化性苔藓、慢性单纯性苔藓的鉴别:dVIN病例中93%会表现为弥漫性、中等程度阳性至强阳性,70%为全层或基底层上方的着色;uVIN中则无弥漫阳性病例。硬化性苔藓、慢性单纯性苔藓病例中虽然分别有63%、29%出现弥漫性中等程度阳性至强阳性,但着色细胞局限于表皮上半部分。因此CK17可能有助于鉴别,尤其小活检标本中可能作用更大。
治疗和预后
VIN的治疗目的在于阻止外阴鳞状细胞癌的发生、缓解相关症状、保留正常的阴道解剖结构及功能。由于大部分dVIN临床并无特异性改变,或无法与背景中的慢性炎症性改变鉴别开来,因此临床应对可疑病变进行活检、根据病理结果实施相应治疗。
已有研究表明,dVIN相比uVIN来说,进展为外阴鳞状细胞癌的风险较高(32.8% VS. 5.7%),且所需时间相对更短(22.8个月 VS. 41.4个月)。鉴于dVIN有较高的误诊率,因此其实际进展风险可能比这个数据还要高。
如活检证实为dVIN,则建议首诊手术切除、而不要进行消融或药物治疗,术后定期随诊。鉴于dVIN周围可能会并存外阴鳞状细胞癌,因此需对相关病变及标本进行仔细评估。
点击下载英文文献
参考文献
Jin C, Liang S.Differentiated Vulvar Intraepithelial Neoplasia: A Brief Review of Clinicopathologic Features[J].Archives of pathology & laboratory medicine,2018.
DOI:10.5858/arpa.2018-0019-RS















共0条评论