[导读] 编译整理:强子
乳腺梭形细胞病变的诊断及鉴别诊断是临床病理难点之一,其中形态学无明确上皮分化的梭形细胞化生性癌、无典型分叶状结构的恶性叶状肿瘤鉴别更是困难。广泛取材是我们病理医师明确诊断的重要手段,但有时候会因穿刺活检及条件所限等,无法准确找出导管原位癌成分、或典型叶状结构。免疫组化可辅助鉴别,如梭形细胞广泛表达细胞角蛋白则支持化生性癌的诊断,但也有叶状肿瘤中间质成分斑片状表达角蛋白或p63、p40的报道。
新加坡中央医院(Singapore General Hospital)病理专家Joe Yeong、Puay Hoon Tan等曾对乳腺纤维上皮性病变的基因组学进行研究,结果表明约60%的纤维腺瘤和叶状肿瘤会有MED12基因的突变,同时叶状肿瘤会有TERT、RARA基因表达的改变。在这一研究基础上,他们提出了一个包括16个乳腺纤维上皮性病变常见突变基因的检测方案,并在一例诊断疑难的病例中进行了验证。相关文章已发表在《Pathology》杂志。
病例展示
患者女性,55岁,右侧乳腺进展期肿瘤、并右肺转移、左侧腰部软组织转移。肿瘤直径7cm,首次活检诊断为高级别恶性肿瘤。镜下瘤细胞为高级别恶性表现,呈上皮样-梭形,排列为巢状及片状,少许硬化间质。细胞核呈中等至显著多形性,核分裂每10个高倍视野达13个。未见明显上皮性成分或导管原位癌成分。
组织学考虑需鉴别梭形细胞化生性癌、恶性叶状肿瘤。免疫组化结果显示,肿瘤细胞不表达MNF16、AE1/AE3、CK14、34βE12、ER、PR、HER2;斑片状表达p63;结合上述结果,病理诊断倾向于梭形细胞化生性癌。

图1. 治疗前活检标本病理所见。瘤细胞呈上皮样至梭形,细胞核具有显著多形性,大量核分裂。高级别的恶性细胞呈片状排列。免疫组化p63斑片状阳性,34βE12阴性。
根据上述诊断,患者接受了9个周期含铂的一线化疗方案;不过,原发肿瘤、肺部结节及腰部转移灶的体积均有增大,同时乳腺肿瘤出现了出血及疼痛。再次活检后,进行了右乳姑息性切除、腋窝淋巴结清扫,镜下特点与首次活检表现类似,同时可见广泛坏死、恶性梭形细胞及巨细胞残余、可见治疗反应。病理仍诊断为高级别恶性肿瘤;不过上皮样-梭形肿瘤细胞的多形性更为显著,细胞核空泡状、不规则并伴显著核仁,混有显著恶性表现的巨细胞。重复免疫组化,ER、PR、HER2、AE1/AE3、MNF16、CAM5.2、GATA3、CK5/6、CK14、EGFR、34βE12、CD34、Bcl2均未见表达;恶性细胞中约5%-10%出现p63的强阳性;这些结果也支持化生性癌的诊断。

图2. 化疗后切除标本病理所见。肿瘤呈梗死表现,局灶仍有高级别恶性梭形细胞残余,镜下表现为不同程度的多形性,细胞核梭形或卵圆形,深染;免疫组化p63斑片状着色,不表达CD34、bcl-2。
不过,免疫组化过程中同时发现有β-catenin、MED12的表达;尽管目前已知梭形细胞化生性癌、恶性叶状肿瘤均可有β-catenin的表达,但基因突变所致MED12蛋白表达与这两者的关系还不完全清楚。患者不再进行系统化疗;近期复诊,仍有寡转移(oligometastatic),肺部及左侧腰部转移灶保持稳定。

图3. 化疗后切除标本,免疫组化β-catenin在胞质着色、MED12在细胞核着色。
进一步研究
对于本例,在石蜡包埋肿瘤组织中进行前述包括16个基因在内的突变检测,结果查见MED12基因2号外显子突变,而前期研究表明该突变仅见于乳腺纤维上皮性病变;同时可查见其他癌相关的基因如RB1、TERT、TP53等突变,也支持是恶性叶状肿瘤的诊断。鉴于这些结果,临床及患者考虑对乳腺病灶进行可能有望根治的乳腺切除术、对两处转移灶也进行根治性切除。
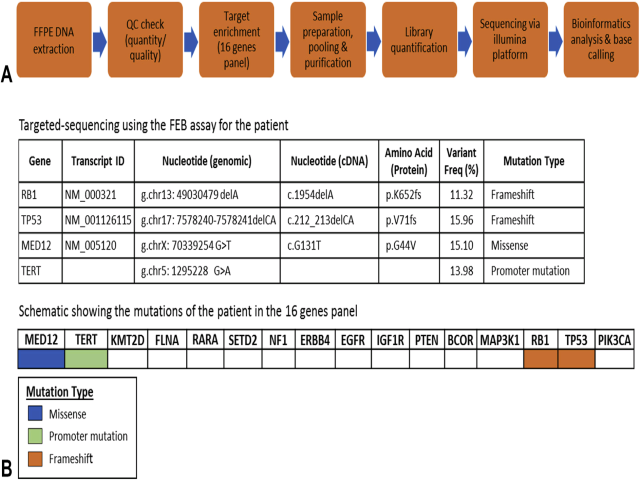
图4. 本文中含16个基因的突变检测方案具体流程。
回溯患者治疗过程,对含铂的一线化疗方案耐药可能也提示该肿瘤并非化生性癌。恶性叶状肿瘤的治疗一般按照肉瘤方案进行,但全身化疗对转移性恶性叶状肿瘤的效果尚不清楚。
本文中病例为恶性梭形细胞构成的进展期乳腺肿瘤,形态学及免疫组化虽然做出了倾向于化生性癌的诊断,但按照化生性癌治疗后效果欠佳。基因突变分析结果支持为叶状肿瘤。不过,一方面该基因检测的敏感性、特异性尚需更多病例验证,另一方面具体到本文病例,也还需进一步临床观察证实。
点击下载英文文献
参考文献
Yeong J,Thike AA,Young Ng CC,et al.A genetic mutation panel for differentiating malignant phyllodes tumour from metaplastic breast carcinoma[J].Pathology,2017,49(7):786-789.
DOI:10.1016/j.pathol.2017.07.011

















共0条评论