[导读] 作者:扫地僧一听 来源:扫地僧一听
幽门腺瘤(gastric pyloric gland adenomas,PGA)是一种罕见的胃幽门腺分化的肿瘤,多见于胃,也见于十二指肠、食管、胆囊、胆管和直肠。在胃中,PGA占所有胃息肉的2.7%。尽管胃PGAs在老年女性自身免疫性胃炎(AIG)中更为常见,但在家族性腺瘤性息肉病(FAP)、Lynch综合征或幼年性息肉病综合征中也可发现。据报道PGA与腺癌的关联率在12%~47%之间。
组织学上,PGA由紧密排列的管状腺体(偶有囊性扩张)组成,周围排列着立方到低柱状细胞,基底核呈圆形,胞浆嗜酸性,呈毛玻璃状。这些细胞没有顶端黏蛋白帽,这有助于区分PGA与胃小凹型腺瘤(FEA)。PGA可以用胃幽门腺分化标志物进行标记,包括MUC6和MUC5AC,但MUC6的表达是诊断较为特异的标志物,因为小凹型腺瘤MUC5AC阳性,MUC6阴性。然而,如果病变中存在大量的主细胞和壁细胞,那么也很难将PGA与泌酸腺腺瘤(oxyntic gland adenoma,OGA)区分开来,OGA与PGA一样具有弥漫性MUC6表达。
在早期的研究中,PGA被分为三类:无传统组织学的异型增生者、低级别异型增生(LGD)者和高级别异型增生(HGD)者。无异型增生的PGAs由均匀的管状腺体组成,周围有一层小而圆的细胞核,无明显异型性,而低级别PGAs腺体形状不规则,细胞核延长,细胞轻度异型性。高级别PGAs的特征是结构改变,包括背对背的腺体和嵴状结构,核密集,核扩大程度更大,核极性丧失,核仁扩大和/或色素沉着。
Won-Tak Choi等人收集了7个不同的机构中57名患者的67例胃PGA做为研究对象。此研究将所有PGAs分层为两层:LGD(n=28)或HGD(n=39例)。换句话说,所有PGAs,包括那些没有常规组织学异型增生的PGAs,被认为至少有LGD,而HGD的特征是结构和/或严重的细胞学异常。
根据免疫组化将所有病例进一步分为三种类型:
(i) “混合型”在深部腺体中MUC6和MUC5AC均有不同的表达,且在肿瘤腺体中MUC6的表达量在20%~>90%之间;
(ii) “纯幽门腺型”弥漫性MUC6表达,MUC5AC表达局限于浅表小凹上皮;
(iii)“小凹优势型”表现为弥漫性MUC5AC表达,≤10%的深部腺体表达MUC6。
组织学上,大多数PGAs呈管状结构(61.2%),其次为管状绒毛状结构(35.8%,图1C),少见绒毛状结构(3.0%)。
图1 ▼
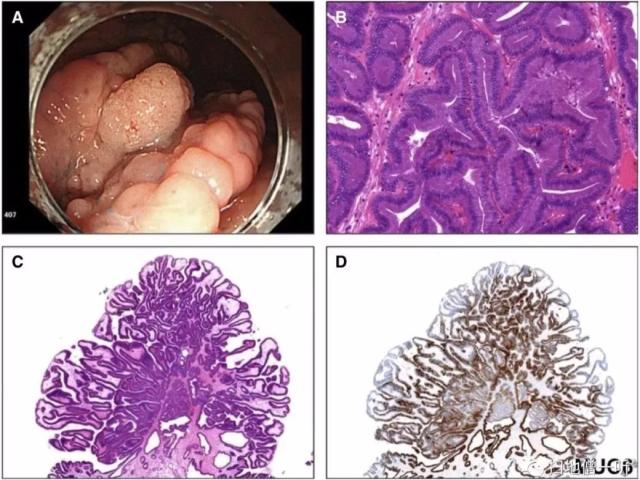
▲图1:PGA
A、内镜显示FAP患者胃体表面覆盖多个胃底腺息肉,背景为息肉样病变(中心)。
B、低级别PGA由紧密包裹的幽门型腺体组成,内含立方至低柱状细胞,细胞核圆形,胞浆嗜酸性;
C、管状绒毛状结构;
D、MUC6免疫组化在大多数肿瘤腺体中均有较强表达。
大多数PGAs(61.2%)表达MUC6和MUC5AC,MUC6表达在肿瘤腺体占20%~ >90%之间(混合型;图2)。纯幽门腺类型占25.4%的病变(图3),而只有3%的病变是小凹优势型(图4)。小凹优势型是HE染色形态类似于典型的PGA,没有小凹分化的形态学证据,但MUC6表达仅限于≤10%的肿瘤腺体。混合型在HGD(78.6%)中比LGD(48.7%)多见(P=0.013),而纯幽门腺型在LGD(33.3%)中比HDG(14.3%)多见(P=0.077)。
图2 ▼

▲图2:混合型PGA伴HGD和腺癌
A、PGA伴HGD表现为背靠背腺形成、核拥挤、色素沉着、核极性丧失;
B、MUC6免疫组化阳性表达,证实PGA诊断;
C、MUC5AC免疫组化在肿瘤腺体中共同表达;
D、腺体的星型表现为侵袭性腺癌侵犯固有肌层的病灶。
图3 ▼
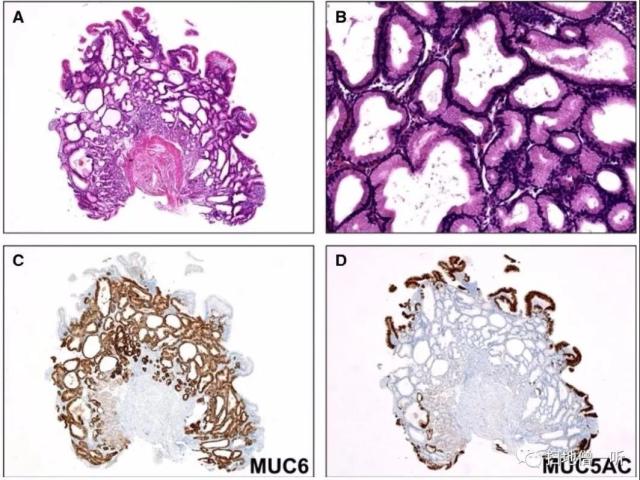
▲图3:单纯幽门腺型(PGA)
A、PGA低倍见大小不同的小管;
B、PGA高倍见紧密排列的管状腺体,内衬长方体细胞,基底核圆形,胞浆嗜酸性,无顶端黏蛋白帽;
C、MUC6免疫组化在病灶内呈弥漫性强表达;
D、MUC5AC免疫组化染色仅显示浅表小凹上皮。
图4 ▼
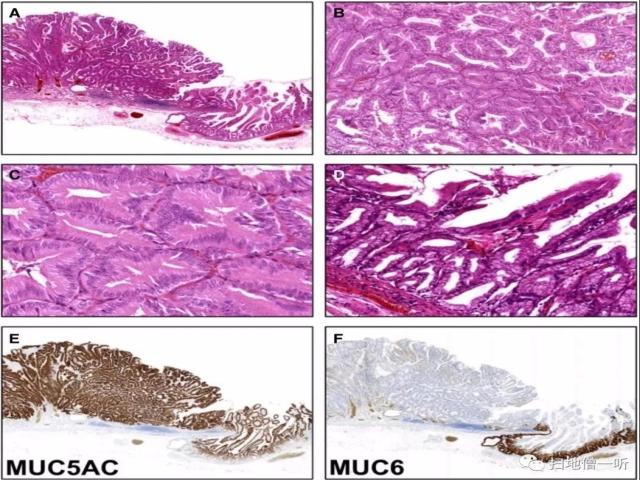
▲图4:小凹优势型PGA
A,肿瘤病变为典型的紧密排列的管状腺体,有明显的幽门腺分化;
B, C,高倍放大,显示管状腺体内衬立方到低柱状细胞和嗜酸性细胞质。注意顶端黏蛋白帽的缺失提示小凹分化;
D、高倍放大见深部局灶性幽门腺成分;
E、MUC5AC 弥漫性阳性;
F、MUC6免疫组化显示深部肿瘤腺体局灶性染色阳性。
综上所述,PGA是一种罕见的肿瘤,关于其临床病理特征、免疫组化模式、自然进程、特别是进展为HGD或腺癌的危险因素以及临床管理方面的信息仍有限。
约有20%~48%的PGAs发生在AIG的背景下,与AIG相关的HGD高于LGD;
PGA符合LGD-HGD-adenocarcinoma的癌化途径,有相当数量的PGAs表现出HGD的特征,并可能发展为腺癌;
HGD或腺癌的发病风险随着病变大小的增加而增加;
HGD的发生率与AIG的存在、管状绒毛结构和混合免疫表型有关;
PGAs在可能的情况下建议切除,特别是增大或表现出HGD特征;
内镜或手术切除后PGAs的局部总复发率小于10%。
附:病例报道
——幽门腺腺瘤PGA,病变内伴有部分小凹上皮样腺瘤
80岁女性,胃镜检查发现胃肿瘤,为进一步诊疗转至本院。10年前成功根除Hp。胃镜提示胃体中段大弯侧有一个20mm的扁平隆起病灶(图1.1-a)。M-NBI显示不规则微血管结构,包括重复不规则吻合的闭环血管(图1.1-b)。此外,病变表面局部可见小孔结构。M-NBI进一步显示,小孔结构呈规则的边缘隐窝上皮,起源于腺体导管的深部(图1.1-b)。
图1.1 ▼

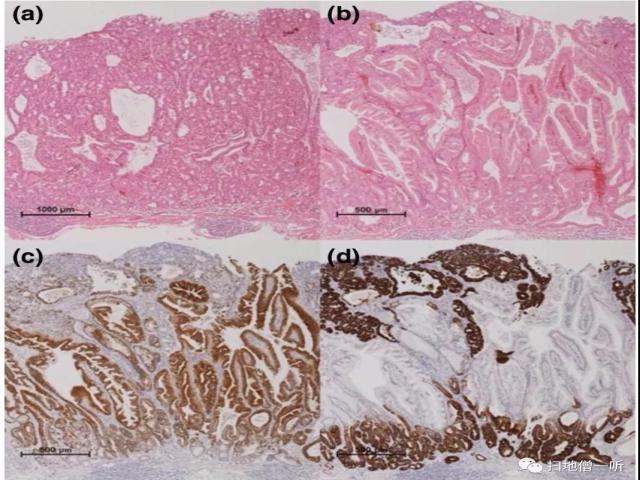
活检标本示胃管状腺瘤。内镜黏膜下剥离术(ESD)剥离。组织学上,肿瘤细胞呈幽门腺样形态,形成小导管。免疫组化显示肿瘤细胞MUC6阳性(图2.1-a,d)。这些结果与幽门腺腺瘤(PGA)一致。PGA成分部分分化为黏膜深层小凹上皮型腺瘤(FEA),MUC5AC阳性(图2.1-b,c)。虽然小凹的表面大部分被幽门腺成分所覆盖,但部分小凹暴露在黏膜表面,与内镜下观察到的小孔结构相对应。幽门腺瘤是一种罕见的胃腺瘤亚型。在本例中,FEA的表层主要被幽门腺组分所覆盖。这可能是由于深黏膜层的小凹成分与干细胞分化,并在PGA成分内向上生长所致。此外,本文推测这一发现代表了向小凹型成分分化后的早期现象。
图2.1 ▼
讨论思考:
幽门腺瘤(PGA)很难与小凹型腺瘤(FEA)和泌酸腺腺瘤(OGA)鉴别。在这方面,MUC6和MUC5AC的免疫组化染色是有帮助的。MUC6的表达是PGA更特异的标志物,因为无论是小凹型腺瘤还是PGA都能表达MUC5AC。虽然当病变表现为纯幽门腺型表达模式(MUC6+,MUC5AC-)时,尤其是主细胞和壁细胞缺失时,PGA的诊断是有信心的,但大多数PGAs表现为MUC6和MUC5AC混合表达的混合型。混合型对区分PGA和OGA非常有用,后者的特征是MUC6呈弥漫性阳性,MUC5AC呈阴性(当然如果是胃底黏膜型,鉴别又有一定困难)。由于关于OGA的发病机制和自然历史(即良性和高分化癌)存在一些争议,在进一步的信息研究发表之前,这种区分可能是必要的。研究表明,混合型PGA在HGD比在LGD中更常见,而纯幽门腺型在LGD比在HGD中更常见。MUC5AC的表达与肠型和小凹型的胃异型增生的高级别形态有关。MUC5AC占优势(小凹型)的病变应被识别,因为其性质和生物学是不确定的。MUC6阳性在多大程度上将病变定义为PGA仍是一个有争议的问题。
参考文献:























共0条评论