[导读] 编译:李爱华 隋红梅;审校:张师前
前言
上皮性卵巢癌(EOC)是女性生殖系统最致命的癌症,预计2018年美国有2.2万例新发病例,1.4万患者死亡,大多数患者最终会复发。一般来讲,根据无治疗间期(TFI)将患者划分为铂敏感(最后一剂铂至复发时间≧6个月)或铂抵抗(复发间期<6个月),随着对EOC认识的深入,该分类系统可能需要调整。
Alvarez等[1]首先对这传统模式提出质疑,原因有二:首先,EOC治疗后监控手段不统一,血清CA-125和先进的影像学技术比传统的症状/体检更加灵敏,既往归类为铂敏感的患者可能应归入铂耐药,被排除在铂治疗或临床试验之外;其次,对EOC发病分子机制的深入研究也更新了人们对铂类化疗和靶向治疗的认识[2]。可见,传统的治疗方案似乎不再适用新形势的变化,于是GOG提出使用新的命名法来描述疾病的进程[3],根据最后一剂铂(TFIp)、最后一剂非铂(TFInp)或生物制剂(TFIb)对TFI进行重新界定。本文回顾了有关二次肿瘤细胞减灭术(CRS)、分子特征及治疗应用、与铂类化疗的联合方案、维持治疗的依据等最新数据,讨论了当前新的治疗策略面临的挑战,以及正在进行的一线治疗试验探索。
二次肿瘤细胞减灭术
对于初次治疗后复发的患者,首先需要考虑的是否需要二次手术干预。多个回顾性队列研究表明:如果CRS能够达到完全切除,生存率会增加[4-7]。DESKTOP OVAR试验回顾性分析了267名患者的人口统计学、CRS及治疗情况,完全切除肿瘤者OS显著延长(45.2个月vs 19.7个月),残留灶大小影响OS,R0、初次手术无残留、腹水量<500ml是独立预后因素[5]。DESKTOPII前瞻性提出了评分系统,预测“阳性”的患者完全切除率为75%[5,8];DESKTOP III[9]将“阳性”的患者随机分为二线化疗组或CRS联合化疗组,尽管手术组OS数据有待完善,但PFS明显改善(19.6个月vs 14个月, HR: 0.66 CI 0.52-0.83 P <0.0001),手术组肿瘤完全切除率达72%,两组毒性均可耐受。GOG213试验[10]将适合CRS的患者随机分为手术联合化疗组和单纯化疗组,适应症包括:一线化疗达到CR、无肠梗阻迹象或需要肠外营养、没有不可切除的癌性病变或实质性器官病变。其主要目的为是评估贝伐单抗联合紫杉醇和卡铂做为一线治疗及维持治疗对OS的影响,以及CRS对OS的影响;67%的患者达到完全切除,尽管如此,CRS对OS的负面影响较为明显,中位OS为53.6个月,并非65.7个月(HR¼1.28;0.92–1.78)[11],对于较少转移患者的亚组分析也没有证实手术获益[12]。
尽管DESKTOP III的最终结果还未得到,但两项研究结果在PFS上结论非常一致:GOG 213研究中完全切除组与化疗组相比中位PFS为21.4 个月vs 16.5个月(HR¼0.68),与DESKTOP III结论相似。但既然复发病灶完全切除,PFS结果却难以解释。因此,DESKTOP III研究结果非常重要,如果证实了GOG 213 中OS的结论,CRS可能被放弃。
分子特征
肿瘤分子分析能够从理论上预测抗癌治疗的效果,这些基因突变可通过二代测序或免疫组化技术来测定。总体来讲,实体肿瘤的挑战,特别是EOC中驱动基因突变的精确定位是靶向治疗成功的关键,其他方面还有:肿瘤空间和时间的异质性、过多的路径、分子识别困难、治疗药物需要经监管机构批准及临床验证等。
2.1. BRCA突变 多聚(ADP -核糖)聚合酶抑制剂(PARPi)针对g ors BRCA突变进行的分子治疗是为EOC量身定制的靶向治疗范例,推荐所有EOC患者检测BRCA,可为患者提供重要的预后信息,便于治疗计划的制订。目前,大多数医生推荐gBRCA检测,肿瘤组织检测因突变逆转可出现假阴性,结果不太可靠[13]。随着肿瘤检测和高通量面板检测日臻完善,依赖于特定的基因改变的靶向治疗不仅仅局限于BRC。SOLO-1结果证实BRCA突变患者一线化疗后给予PARPi、olaparib维持化疗,PFS得到明显改善,因此,检测BRCA突变将成为标准方法,这种分子特征在复发性EOC中应予以关注[14]。
2.2 同源重组缺陷 在PARPi探索过程中有一个重要发现,就是除BRCA外,遗传或表观遗传的改变可通过同源重组途径阻止双链DNA损伤修复,从而影响PARPi的敏感性,同源重组缺陷(HRD)患者应优先选择竞争性PARPi和非PARPi方案。目前面临的临床难题是对于复发性EOC患者能否选择PARPi或贝伐单抗维持治疗?另外,研究发现BRCA野生型和HRD阴性者应用PARPi治疗也有统计学意义,但影响的程度不如BRCA或HRD阳性队列。因此,对于无DNA修复缺陷的患者有无更好的治疗策略?目前,PARPi应用唯一有效的生物标志物是g或sBRCA突变,但可能随着研究结果而发生改变。
治疗方案
3.1 化疗 对于应用铂类化疗的复发性EOC患者,需考虑以下方面:具体实施、毒副作用、单药或双药联合、疗效(见表1)。与铂类为基础的方案相比,其他化疗药物没有优势,这在MITO 8研究中得到了验证。MITO 8研究对象为TFIP 6-12个月的患者,随机分为铂类化疗组和非铂类化疗组,研究终点为OS,非铂类化疗没有生存获益(21.8个月vs 24.5个月;HR¼1.38;95%CI0.99-1.94;P¼0.06)[15]。
Trabectedin是一种来源于海洋松茸的新的细胞毒性药物,作为DNA小槽结合物,可导致双链DNA断裂。脂质体阿霉素(PLD)联合trabectedin用于治疗TFIp 6-12个月的EOC患者[16-18],发现单用PLD 4个月PFS明显改善。ORCHID III试验评价了复发性EOC患者PLD联合trabectedin与单独PLD治疗的疗效(NCT01846611),但该试验因无效而提前终止,结果未公布。INOVATYON(NCT01379989)III期随机试验针对TFIp 6-12个月EOC患者,对比trabectedin+PLD与卡铂+PLD的疗效,试验正在进行中。
3.2维持治疗 EOC治疗后最终会进展,积极处理非常必要[20]。维持治疗有两种含义:同药维持和换药维持,评估同药维持治疗的研究通常设计为化疗联合生物治疗,采用生物治疗维持到疾病进展或确定的时间[10, 21,22]。相比之下,换药维持是在诱导化疗出现预期反应后执行新方案,即在4-6程铂类化疗后改用新的药物[23-26]。另外,许多维持治疗试验允许在CR与部分“PR”后启动维持方案,也可以说是PR治疗后的策略“转换”,并不是最纯粹的维持治疗,在该状况下患者最终进展,通常规定继续治疗至进展或不可接受的毒性,试验设计要求OS为观察终点,以评价是否最终获益。
一些维持治疗的药物及方案已有报道,包括抗血管生成(AA)和PARPi,疗效确切;肿瘤免疫制剂,如抗程序性细胞死亡蛋白-1 (PD-1)或抗程序性细胞死亡配体-1 (PD-L1)的相关研究正在进行中。
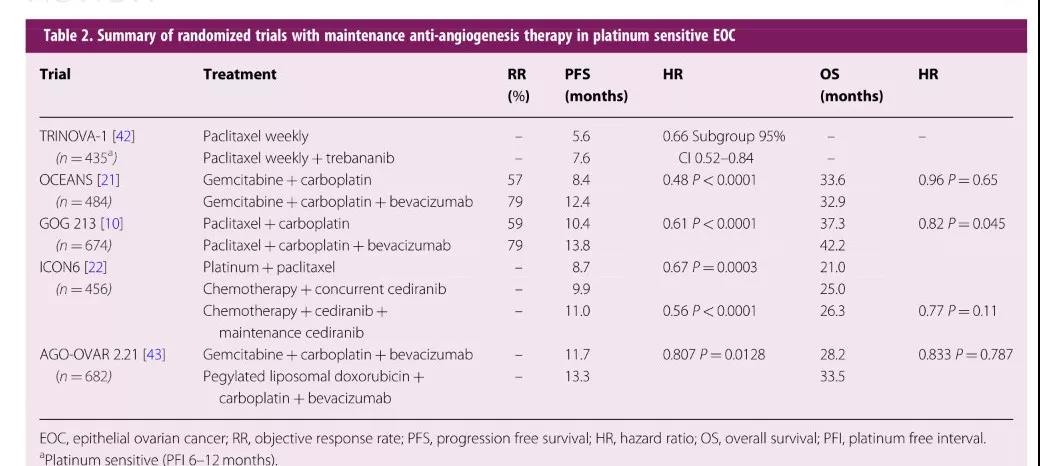
3.3抗血管生成治疗 有关肿瘤血管生成驱动因子与EOC结局的关系已被充分论证[27-41]。表2显示了AA药物在大型前瞻性随机试验中的研究结果[10,21,22,42,43],针对VEGF亚型(如贝伐单抗)或其受体(如西地拉尼)的药物研究逐渐深入,一种新型的AA制剂Trebananib维持治疗的试验正在进行中[42]。目前,卡铂、贝伐单抗(同时用药和维持用药)联合吉西他滨或PLD的结果对比显示:PFS分别为11.7个月vs 13.3个月(HR¼0.807,95%CI 0.681–0.956,P¼0.0128),PLD组OS有改善趋势(HR¼0.833,95%CI 0.680–1.022)。因此,对于选择铂类化疗的复发性EOC患者,首推PLD/卡铂联合贝伐单抗方案。
3.4 PARPi方案 目前五种PARPi正在临床应用或研究中:奥拉帕尼、尼拉帕尼、卢卡帕尼、塔拉帕尼和维利帕尼。PARPi单药维持治疗和用于复发性EOC治疗的临床试验正在进行中。尽管三个随机III期(NOVA、SOLO2、ARIEL3)试验和一个II期(Study 19)试验在设计、入选标准、患者群体和评估方法方面均有差异,但PARPi用于维持治疗的结果却完全一致,这些患者首先接受铂类诱导化疗,如果治疗有反应,则随机分配至PARPi组和安慰剂组,在随机分组前不需要完成全部诱导化疗,对诱导化疗稳定者被排除,归类为贝伐单抗的研究中。ARIEL3的独特之处在于从试验中收集达到客观缓解(ORR)的患者,这些患者均有可测量的病灶,和预期一致,BRCA突变者应用卢卡帕尼获得部分缓解(38%)。
回顾这些有关维持治疗及III期临床试验结果,对于选择铂类化疗的复发性EOC患者 PARPi和AA方案均可选择,疗效观察正在进行中,但迄今为止仅GOG-0213证明OS获益。其他试验将评估其中一种或两种药物与肿瘤免疫制剂(如抗PD-1/PD-L1或CTLA-4抑制剂)组合的疗效,例如:ICON 9(NCT0327717)是一项有关复发性EOC的随机III期试验,试验对象为接受铂类化疗达到PR或CR的患者,随机分为奥拉帕尼单药组或奥拉帕尼联合西地尼布组,主要终点是PFS,次要终点包括OS、副作用、健康相关生活质量和PFS2,分层分析包括HRD,但不是入组标准。
3.5肿瘤免疫制剂方案 联合贝伐单抗或PARPi成为复发性EOC治疗的新标准,铂类仍然是改善患者PFS(两者均可)和OS(贝伐单抗)的药物选择,免疫治疗似乎有潜在价值,但免疫治疗与化疗和其他新型药物的最佳组合方案尚未确定。
免疫逃逸是癌症的共同特征[44,45],超过50%的EOC患者诊断即可检测到肿瘤浸润淋巴细胞(TILs),是肿瘤免疫药物有效作用靶点,TILs存在与否也影响预后[46]。由于EOC携带广泛的基因突变[47],其对于免疫检查点抑制剂的反应比较局限,复发性铂耐药EOC患者单药治疗的反应率仅11%~25%[48-50]。
免疫检查点抑制剂与其他药物的组合可能提高受试药物治疗反应的有效性和耐久性,药物组合包括:致使DNA损伤的分子制剂、化疗药物和AA。与化疗方案的组合充分利用了药物对于免疫系统的互补作用,化疗可调节树突状细胞,增强MHC1在肿瘤细胞上的表达,导致免疫原性细胞死亡;当同时使用铂和紫杉烷两种药物时,小鼠模型中TILS比例增加[51,52]。AA联合免疫疗法也有理论基础,VEGF是一种高效免疫抑制分子,直接和间接抑制T细胞功能,刺激调节性T细胞,抑制树突状细胞的功能,诱导肿瘤异常血管增生,并减少肿瘤T细胞的运输[44, 53–57]。AA联合免疫疗法治疗非鳞状非小细胞肺癌(NSCLC)的安全性和有效性已得到证实,IMpower150将IV期NSCLC患者随机分为:卡铂、紫杉醇及联合atezolizumab维持治疗组及卡铂、紫杉醇联合贝伐单抗维持治疗组,结果显示联合atezolizumab和贝伐单抗组PFS均有改善(HR ¼ 0.617; 0.517–0.737; P <0.0001),OS的结果也一样(HR ¼0.780;0.636–0.956; P ¼ 0.0164),不论PD-L1状况如何,所有患者均获益,但PD-L1高表达者获益明显 (HR ¼ 0.44 for PD-L1 high,0.50 for PD-L1 low, and 0.77 for PD-L1 negative) [58];ATALANTE (GINECO-OV236b/NCT02891824)纳入复发性EOC患者,是一项III期随机试验,分为铂类化疗、贝伐单抗和安慰剂组,安慰剂维持治疗,铂类化疗、贝伐单抗、atezolizumab,贝伐单抗和atezolizumab维持治疗直至进展,主要终点是PFS,次要终点包括后续治疗时间或死亡时间、总OS和安全性,该研究正募集患者,预计2023年会有结果。
3.6 PARPi联合化疗 PARPi联合化疗难度较大,均需要调整剂量。Oza对比了铂敏感复发性卵巢癌患者应用紫杉醇+卡铂联合奥拉帕尼与单独化疗的疗效,骨髓抑制严重,卡铂需减少到AUC 4,奥拉帕尼减少至200 mg bid,两组ORR无明显差异,但奥拉帕尼维持治疗组PFS明显改善[59]。即使单一药物化疗联合PARPi也很困难,骨髓毒性严重,限制了PARPi或化疗药物的使用[60-63]。
3.7取代铂的非细胞毒性治疗 许多PARPi被单独用于复发性EOC的治疗,适应证是g或s BRCA突变患者。奥拉帕尼是第一个获批的用于gBRCA突变EOC患者的3线治疗,对PSR患者ORR(n¼ 137)为33%,ORR为45%,56%的患者在治疗后6个月无进展[64]。基于两个大型开放标记试验(Study 10和ARIEL2)数据,卢卡帕尼是第二个被批准的用于复发性EOC的PARPi[65-67],适应证同前,结果显示卢卡帕尼的ORR为54%[66]。ARIEL-2试验旨在识别PARPi潜在获益的其它“类BRCA”肿瘤,这些“类BRCA”肿瘤ORR可达30%,中位PFS为7.1个月,随后这些患者进入ARIEL-3试验行维持治疗,汇总后进行分层分析[67]。QUADRA II期临床试验(开放标记,单臂)共纳入463例复发性EOC患者,接受3种方案治疗,评估尼拉帕尼(300 mg po qd)的治疗效果,主要研究终点是HRD阳性的EOC患者的ORR,结果证实单药尼拉帕尼治疗HRD阳性患者ORR为29%,反应时间(DOR)为9.2个月[68]。
目前尚未解决的问题是铂类化疗与PARPi的效果优劣。对于gBRCA突变的EOC患者,II期随机试验的结果表明奥拉帕尼单药较PLD的ORR高,PFS无差异,尽管尚未达到主要优势终点,PLD在gBRCA 患者中的疗效已高于预期[69]。目前SOLO3 (奥拉帕尼)和ARIEL4 (卢卡帕尼)(NCT02282020,NCT02855944)这两个试验正在进行,比较PARPi单药与医生推荐化疗方案的疗效。
3.8靶向药物的联合应用 越来越多的数据表明:许多单一靶向药物不足以达到持久疗效,原因在于靶向治疗存在先天性、获得性和适应性抵抗[70],PARPi也不例外,部分g或sBRCA突变的肿瘤对PARPi没有反应,即使BRCA突变的肿瘤,PARPi单药治疗中位缓解持续时间(DOR)仅8个月[64, 67, 71, 72],支持PARPi为适应性抵抗。因此,探索PARPi联合治疗具有重要意义。
PARPi联合AA的理论依据在于:AA可导致乏氧,促进HRD发生,在肿瘤微环境中发生合成致死[73],这是一种不同于BRCA突变的PARPi敏感机制。PARPi联合贝伐单抗或西地尼布的第一阶段试验已顺利完成[73,74],奥拉帕尼联合西地尼布的II期研究数据显示:无论BRCA状态如何,联合治疗组较奥拉帕尼单药PFS明显改善(17.7个月vs 9.0个月),在BRCAwt状态组,联合治疗获益最大[75]。一项II期随机试验(Otova,NCT03117933)正在进行中,旨在比较铂耐药EOC患者紫杉醇周疗、奥拉帕尼、奥拉帕尼/西地尼布的疗效,也包括TFIp <12个月的患者。相关III期临床试验也已经启动,评估以下结合的疗效:(i)复发性EOC联合治疗与标准铂类化疗的比较(NRG-GY004)(ii)复发性EOC联合治疗与非铂类化疗的比较(NCT02446600; NCT02889900)。奥拉帕尼联合贝伐单抗在I期试验已进行研究,显示出良好的疗效,毒性可耐受[73]。PAOLA-1试验(NCT02477644)正在探索该方案用于维持治疗的效果。卢卡帕尼联合贝伐单抗维持方案正在进行I期试验,随后进行MITO25II期试验(NCT03462212)。在I期研究中尼拉帕尼联合贝伐单抗可达到50%的反应率[76],AVANOVA2试验(NCT02354131)将评估三种方案对复发性EOC患者PFS的影响:尼拉帕尼单药、贝伐单抗联合尼拉帕尼、贝伐单抗和尼拉帕尼序贯用药,该研究正在招募患者。
肿瘤免疫制剂(抗PD-1和PD-L1)与PARPi或AA联合作为维持治疗或二联/三联治疗也备受关注,目前正在研究中。
讨论
复发性EOC患者的治疗方案正在发生变化。首先,基于GOG 213的最新数据,再次CRS的作用受到了质疑,在等待DESKTOP III试验结果期间,必须仔细考虑手术的价值。第二,虽然化疗的地位在过去十年中保持稳定,维持治疗和取代传统化疗的新疗法正在研究中,其适应证取决于分子特征或遗传亚群。因此,对于复发性EOC应确认肿瘤的分子特征和基因组学,诊断时确认最为理想。
对于铂治疗后复发患者的维持治疗,AA和PARPi均可选择,但随着初始治疗药物适应证的变化,复发患者的用药也应随之改变,如FDA批准在EOC初始治疗中选择贝伐单抗,使用前仍然需要考虑贝伐单抗对后续治疗的影响[77]。同样,对于gBRCA患者SOLO1推荐奥拉帕尼用于维持治疗,也会影响复发患者的治疗[78,79]。与贝伐单抗不同,目前还没有PARPi先前暴露后再使用的数据。可见,复发患者的治疗选择可能更加复杂,比如患者在使用PARPi后复发,或者使用PARPi时复发,后续维持治疗PARPi是否仍有必要?使用方面有无区别? 正在进行的OREO随机III期试验(NCT03106987)旨在回答这些问题,该研究纳入PARPi维持治疗后进展或复发、对铂类药物治疗有反应的患者,进行奥拉帕尼或安慰剂维持治疗,对于BRCA阳性者,作者建议对于既往未使用PARPi者,可选择PARPi维持治疗,除此之外,选择治疗方案时必须考虑患者的临床因素(如疾病分布、体能状况、累积毒性等)、分子特征和既往治疗史。
随着对EOC分子认识的不断深入,新的治疗方法不断涌现,其中包括PD-1/PD-L1免疫调节剂,可能在复发性EOC治疗中发挥作用。尽管JAVELIN Ovarian 100 (晚期EOC III期随机试验)比较了化疗、化疗后Avelumab维持治疗、Avelumab联合化疗及Avelumab维持治疗2年以上的疗效,在中期分析中因未达标而提前终止,其它联合免疫调节剂的多项研究仍在进行中[80]。
因此,在这种瞬息变化的环境下,不应仅仅根据“铂敏感”和“铂耐药”决定复发性EOC患者的治疗方案,应参考患者分子和基因组特点进行多步骤个体化治疗,探索最佳治疗方案。在生物标志物不明的情况下,临床医生如何选择靶向药物加入一线化疗以获得最佳疗效?对复发患者选择药物又有何影响呢?
PRIMA是一项III期随机对照试验,评估铂类一线化疗有反应的EOC患者尼卡帕尼用于维持治疗的疗效,主要终点是PFS;PAOLA-1也是一项随机III期试验纳入铂类化疗(包括贝伐单抗)有反应的患者,随机分为安慰剂维持治疗组、贝伐单抗和奥拉帕尼维持治疗组,PFS为主要终点。目前来看,JAVELIN Ovarian 100为阴性结果,若PRIMA (NCT02655016)和PAOLA-1 (NCT02477644)有阳性结论,将改变EOC初始及复发患者的治疗模式。此外,NRG-GY004也将分析PARPi与化疗的关系。如果这些研究均达到主要终点,复发性EOC患者的治疗方案将变得更加复杂。
药物研发的传统模式始于“铂抵抗”(PR)群体,然而在利用分子特性进行靶向治疗和试验设计的时代,传统模式已失去主导地位,EOC治疗领域正在发生迅速变化,新疗法不断涌现,转变思路和治疗模式势在必行。
在利用分子特性进行靶向治疗和试验设计的时代,传统治疗模式已失去主导地位,EOC治疗领域正在发生迅速变化,新的疗法及大量临床实验不断涌现。因此,不应仅仅根据“铂敏感”和“铂耐药”决定复发性EOC患者的治疗,需参考患者分子和基因组特征进行多步骤个体化治疗,探索最佳治疗方案。本文主要观点归纳为:
1. GOG 213和DESKTOPIII随机试验旨在评估CRS的作用,GOG 213对CRS提出质疑,DESKTOP III试验待结果
2. 对于PSR EOC患者,首推PLD/卡铂联合贝伐单抗治疗,非铂类化疗没有生存获益
3. AA联合免疫检查点抑制剂:AA联合atezolizumab治疗IV期NSCLC,PFS及OS均改善,PD-L1高表达者获益明显;复发性EOC相关ATALANTE试验正在进行中
4. 对于复发性EOC,PARPi联合化疗毒性较大,均需要调整剂量
5. PARPi单药治疗PSR:奥拉帕尼ORR为45%;卢卡帕尼为54%;QUADRA II期试验评价尼拉帕尼治疗HRD阳性患者ORR为29%;奥拉帕尼单药较PLDORR高,PFS无差异
6. PARPi联合AA:无论BRCA状态,联合治疗较单药PFS明显改善
7. 对于复发性EOC患者,AA和PARPi维持治疗均可选择,BRCA阳性,既往未使用 PARPi者,可选择PARPi
8. JAVELIN Ovarian 100未能证明化疗联合免疫调节剂维持治疗的疗效;PRIMA旨在评估铂类一线化疗有反应的EOC患者尼卡帕尼维持治疗的疗效,PAOLA-1则评估上述患者贝伐单抗联合奥拉帕尼维持治疗的疗效,试验在进行中。














共0条评论