[导读] 作者:解放军总医院第八医学中心病理科 王学利
肾黏液样小管状和梭形细胞癌(mucinous tubular and spindle cell carcinoma,MTSCC)是一种少见的低度恶性上皮性肿瘤,在肾细胞癌中所占比例不足1%。本文回顾分析我科诊断的2例MTSCC的临床特点、病理形态学及免疫组化结果、临床治疗及预后,结合相关文献汇报如下,以提高对该肿瘤的认识。
1.材料和方法
1.1材料 例1,女,69岁,因体检发现右肾占位而入院,于2014年2月在我院移植外科行腹腔镜下肾癌根治术;例2,男,64岁,因腹痛一周余而入院,增强CT示右肾占位,于2015年2月在我院移植外科行腹腔镜下肾癌根治术,均送检标本至我科。
1.2方法 切除标本经10%中性福尔马林固定24 h以上,常规脱水,石蜡包埋,3μm厚切片,行常规HE染色和免疫组化EnVision法染色,镜下观察切片。所用抗体均购自北京中杉金桥生物技术公司。
2.结果
2.1巨检 例1,送检右肾根治标本,于肾上极肾实质内见一灰白色结节状肿物,大小为4.8*4*4cm,切面灰白略呈灰黄色,局部结节样,质软,与周围肾组织分界清楚,局部紧邻肾盂黏膜。例2,送检右肾根治标本,于肾中极肾实质内见一结节状肿物,大小为1.8*1.6*1.6cm,切面灰白灰红色,局部呈囊性,质中等。
2.2镜检 肿瘤大部分区域为小管状或伴有粘液和梭形细胞,小部分区域小管呈透明细胞样,瘤细胞呈立方形、梭形、卵圆形,细胞质少,核圆形或不规则形,可见核仁,异型性不明显,核分裂象少见,紧密排列的狭长小管及编织状梭形细胞漂浮于黏液背景中(图1,2)。
2.3免疫组化 例1,肿瘤细胞表达CK18、CK19、CK7(图5)、P504(图6)、Vimentin(图4)和SMA;不表达CD10、CKH、CK8/18、PSA、α-inhibin、RCC、CD34、HMB45、Melan A;核增殖指数Ki-67<5%。例2肿瘤细胞表达CK18(图7)、CK7、Cytokeratin(图3)、PAX-2和PAX-8(图8);不表达Vimentin、RCC、CD10,核增殖指数Ki-67<5%(图9)。
病理诊断:例1,右肾黏液样小管状和梭形细胞癌,癌组织局限于肾实质内;例2,右肾低级别多形性上皮肿瘤,考虑粘液小管及梭形细胞癌。2例患者均未能做进一步随访。
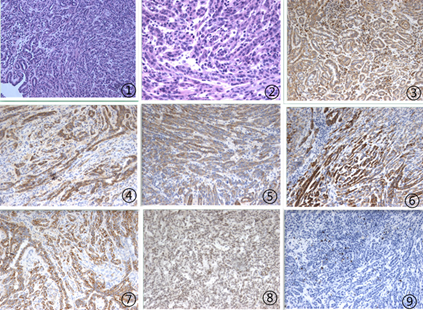
图1肿瘤主要由大小不等的小管构成,间质可见黏液,100倍;图2典型的梭形小管结构漂浮在黏液背景中,肿瘤细胞呈立方状,胞质嗜酸性,异型性小,200倍;图3肿瘤细胞CK阳性;图4肿瘤细胞Vim阳性;图5肿瘤细胞CK7阳性;图6肿瘤细胞AMACR阳性;图7肿瘤细胞CK18阳性;图8肿瘤细胞PAX8阳性;图9核增殖指数ki67<5%。
3.讨论
3.1临床特征 1997年MacLennan等首先报道了MTSCC,2001年Parwani等称之为具有远端肾单位分化的低度恶性黏液性肾上皮性肿瘤,直至2004年WHO泌尿系统肿瘤分类才正式将其定义为一种独立的肾上皮性肿瘤,将其划分为肾细胞癌的一种独立亚型,定义为具有黏液样小管状和梭形细胞特点,是一种罕见的低级别多形性肾脏上皮性肿瘤。2016年WHO泌尿系统肿瘤分类无变化。
MTSCC年龄分布较广泛,平均年龄53岁,多发生于女性,男女比1:4。多数患者无症状,少数可出现侧腹痛或血尿。本组患者的临床特点与文献报道基本一致。MTSCC可同时合并其他泌尿系疾病,虽极为罕见但需注意,也有文献报道肾移植后相关个案。影像学表现表现具有一定的特异性,而明确诊断仍然需要术后病理。目前国内外文献报道不足二百例,国内多为个案或小宗报道。
3.2病理诊断 MTSCC大体标本边界清楚,无包膜,多位于肾实质内,呈结节状突出于肾实质表面。切面呈灰白色或棕黄色,质地致密,少见出血及坏死,罕见囊性变。镜下可见肿瘤细胞呈小管状结构、梭形细胞及黏液样三相形态,这是MTSCC最典型的类型。MTSCC可呈现多种形态学特点,小立方细胞排列成紧密、狭长的小管状结构,编织状排列的梭形细胞及细胞外黏液样间质可按不同比例组合。肿瘤细胞为立方形和梭形细胞,体积较小,呈立方形或卵圆形,胞质嗜酸性,异型性小,核圆形或不规则,核仁不明显,这两种细胞形态均较为温和,核分裂象罕见。肿瘤间质可见不同比例的黏液,此外还可见泡沫样巨噬细胞、砂砾体样钙化、结节状淋巴细胞套等。
2006年Fine等根据黏液、管状和梭形成分的不同比例,将MTSCC分为不同亚型:经典型、黏液稀少型、小管结构为主型和梭形细胞为主型等,其中经典型最为常见。目前高级别MTSCC陆续有文献报道,肿瘤细胞异型性明显,表现为细胞核大,染色质粗,核仁明显等特点。Akhtar等报道中提示高级别的MTSCC具有肉瘤样组织,缺乏经典的管状结构,黏液背景不明显,肿瘤细胞排列方式多样,文献报道的转移性MTSCC多为此类型。
电镜示梭形细胞具有上皮细胞的特点,可见紧密连接体、桥粒、微绒毛、腔缘和张力丝。管腔内可见短的微绒毛,有连接复合体。MTSCC免疫表型较为复杂,CK7、CK18、AMACR、PAX2/8及E-cadherin多呈阳性,Vimentin和高分子CK阳性率不一,CD15偶可阳性,而SMA、HMB45、S-100、CK20及GATA3为阴性,部分病例表达神经内分泌标记。有国外学者免疫组织化学研究显示,高级别肿瘤将会高表达Ki-67及p53,这可能是MTSCC不良预后的预测因子。
3.3鉴别诊断 MTSCC主要与以下病变相鉴别:①乳头状肾细胞癌(PRCC):当MTSCC挤压明显时则难以鉴别,而免疫组化帮助不大,应仔细寻找梭形细胞成分,曾有观点认为MTSCC为乳头状肾细胞癌的一种变异型的假设。PRCC具有复合分支乳头且缺少黏液样基质。目前研究显示PRCC有7、17号染色体的获得和Y染色体的缺失,而MTSCC不存在,因此分子检测有助于鉴别。②血管平滑肌脂肪瘤:镜下由多少不等成熟脂肪组织,壁厚的不规则血管和平滑肌组织构成。当平滑肌组织有黏液变性需与MTSCC相鉴别,后者缺乏脂肪成分和扭曲变形的厚壁血管,可见小管状结构,且HMB45等标记物阴性。③后肾腺瘤:女性好发,大体可呈囊性,镜下无黏液样背景,肿瘤细胞呈小的腺泡状排列,胞质嗜碱性,缺乏梭形细胞区域,间质偶见沙砾体,免疫组化CK7阴性。④集合管癌:高度恶性肿瘤,多见于有镰刀细胞性血液病的年轻患者,主要位于肾髓质,肾内转移灶常见,有坏死和卫星灶且常见全身转移。肿瘤细胞质嗜酸性,细胞核大,核仁明显,高度恶性分级,呈管状乳头状排列,间质通常纤维化伴有坏死,但缺少明显的细胞外黏液样基质。⑤肉瘤样肾细胞癌: 当MTSCC梭形细胞为主时容易误诊,后者来源于近端肾小管单位的浸润性肿瘤,肿瘤细胞呈明显多形性,异型性明显,核分裂象多见,瘤细胞呈浸润性生长,可见癌和肉瘤成分,坏死灶及出血可见。
3.4分子遗传学 目前研究通过比较基因组杂交和免疫荧光原位杂交技术等方法显示MTSCC具有多个染色体丢失的组合。此外Weber等报道该肿瘤无3p染色体的丢失或VHL基因的缺失,而这些在典型的透明细胞肾细胞癌中很常见,还有研究提示15号和22号染色体单体,7号和22号染色体双体可能是高核级MTSCC的重要诊断依据。目前对于MTSCC的起源存在着很多争论,大量证据表明MTSCC起源于髓袢细胞或集合管上皮细胞,而对后者的支持更多。
3.5临床治疗及预后 MTSCC是一种低度恶性肿瘤,预后较好,治疗首选早期手术切除,应在完整切除肿瘤的前提下尽可能保留肾单位。但目前发生复发、转移并致死的报道也逐渐增多。位志峰等于2012年报道了国内首例致死的病例,并指出MTSCC可分为两型: Ⅰ型即经典型,恶性程度低,预后较好;Ⅱ型,恶性程度高,可有局部或远处转移,预后较差。此分类对于其治疗具有一定的指导意义。对有远处转移者,可考虑予舒尼替尼治疗。由于目前报道的资料有限,尚待进一步深入的研究。
综上所述,MTSCC是一种罕见的肾上皮性肿瘤,其恶性程度相对较低,预后相对较好,具有特殊的临床、影像及病理表现,目前首选的治疗方案仍以手术为主,其中以肾部分切除术为主。然而目前发现其不良预后及淋巴结转移的病例逐渐增多,有必要建立转移性MTSCC的系统治疗指南。尤其是病理形态学异型性明显者,术后需密切随访。
参考文献:略














共0条评论