[导读] 作者:解放军总医院第八医学中心病理科王学利
后肾腺瘤(metanephric adenoma,MA)是临床上极为少见的良性肾肿瘤,临床、影像或病理学极易误诊为恶性肿瘤,尤其是术中冰冻和穿刺活检,形态学常误诊为乳头状肾细胞癌或肾母细胞瘤,从而造成过度治疗。笔者曾在临床外检工作中连续遇到2例,故从临床表现、病理诊断、临床治疗和预后等方面进行探讨,并复习相关文献,提高对该肿瘤的认识。
1.材料和方法
1.1 材料
例1:女,32岁,1周前因上腹部不适行B超检查发现左肾占位,患者无腰痛、血尿及发热等症状,增强CT示左肾可见一大小约3.9cm×3.8cm软组织密度团块,增强明显强化。印象:左肾富血供占位,肾癌可能性大,请结合临床。以左肾占位收入院,在全麻下行后腹腔镜下左肾部分切除术,送检标本至我科。
例2:女,48岁,患者1周前在301医院体检,泌尿系增强MR检查示:左肾占位性病变伴出血,考虑肾癌可能。以左肾实性占位收入院,在全麻下行腹腔镜下左肾根治性切除术,送检标本至我科。
1.2方法 切除标本经10%中性缓冲福尔马林固定24 h以上,常规脱水,石蜡包埋,3μm厚切片,行常规HE染色和免疫组化EnVision法染色,镜下观察。所用抗体均购自北京中杉金桥生物技术公司。
2.结果
2.1巨检 例1送检灰白色结节1枚,大小5.5*4*3cm,切面灰白色,质细腻,周边可见少量肾组织;例2 送检肾脏根治标本,于肾中极可见一类圆形肿物,大小4.5*4*3cm,切面灰白色,质中,界清。
2.2镜检 肿瘤细胞较小,均匀一致,排列较紧密,肿瘤细胞排成腺泡状或管状,形成肾小球样或花蕾样结构;肿瘤细胞异型性小,核分裂罕见(图1,2)。
2.3免疫组化 例1 肿瘤细胞PAX-2,PAX-8,Vimentin,CD57,WT-1阳性表达;肿瘤细胞RCC,CK20,CK7,CK,AMACR阴性,肿瘤细胞Ki-67增殖指数<2%。病理诊断:后肾腺瘤,切缘净。
例2 肿瘤细胞CK(图3),CD57(图4),PAX-8,Vimentin,WT-1(图5)阳性表达,肿瘤细胞CD10,CK7,S-100(图7),TFE3,RCC,AMACR(图6)阴性;肿瘤细胞Ki-67增殖指数<5%(图8)。 病理诊断:考虑为后肾腺瘤,伴出血及囊性变。
患者术后定期复查,未作其他处理,目前随访19和15个月,状态尚可。
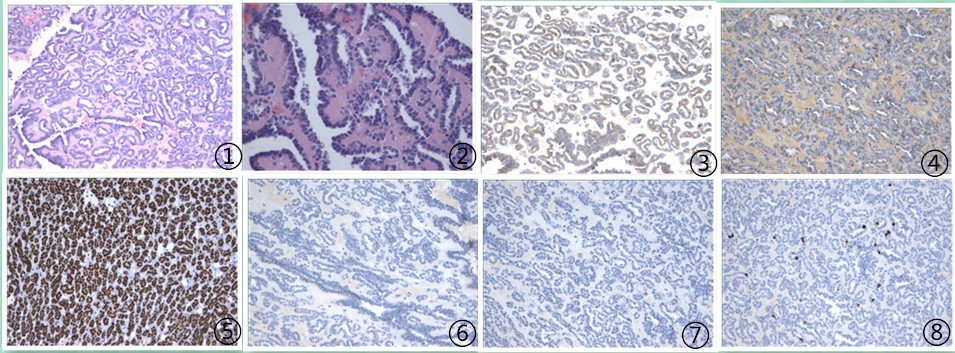
图1肿瘤细胞排列成腺泡或乳头状,100倍;图2肿瘤细胞较小,异型性小,未见核分裂,200倍;图3肿瘤细胞CK阳性,EnVision法;图4肿瘤细胞CD57阳性,EnVision法;图5肿瘤细胞WT-1强阳性,EnVision法;图6肿瘤细胞AMACR阴性,EnVision法;图7肿瘤细胞S-100阴性,EnVision法;图8肿瘤细胞Ki-67增殖指数<5%,EnVision法
3.讨论
3.1临床特征 1979年Bove等人首次描述该肿瘤,1992年由Brisigotti等将其命名为MA,当时定义为起源于肾胚胎发育过程中的肾皮质小管残留组织的一种罕见肾肿瘤。1996年被WHO收到良性肾腺瘤大类中。2004年WHO肾脏肿瘤组织学分类中把它归入后肾肿瘤,这类肿瘤包括:MA、后肾腺纤维瘤(metanephric adenofibroma,MAF)和后肾间质瘤(metanephric stromal tumour,MST)。三者在组织发生和肿瘤性质上是相似的一组肿瘤,MA和MST构成了后肾肿瘤谱系的两端,MA完全由上皮细胞构成,MST完全由基质构成,而MAF上皮和基质均有。2016年肾脏肿瘤组织学分类未作变化。MA是该家族中最多见、预后最好的类型,约占成人肾脏上皮源性肿瘤的0.2%。
MA多发生于成人,平均发病年龄为50-60岁,男女比例约1:2,多为单侧单病灶。MA生物学行为常为良性,生长缓慢,多为偶然发现,无明显临床症状,实验室检查大多无异常,文献报道10%-12%的患者可能出现红细胞增多症,可能与MA可产生并分泌促红素及其他细胞因子有关。一些病例还可出现血压高的症状,肿瘤切除后均恢复正常。虽然有个别报道其可转移至淋巴结或骨,但预后良好。目前最大宗的报告为1995年Davis 等报道50例,而国内报道最多为16例。
3.2病理诊断 MA 可发生于肾脏各个部位,尤其皮质区,结节状,直径0.3~20cm,平均 5.5 cm;以单侧发病为主,偶见双侧或多发;肿瘤边界清楚,有完整包膜;切面实性或囊实性,灰白、灰红或灰黄色,质中,可见散在钙化灶,少数呈片状钙化伴砂砾体形成;可见明显囊性变、出血、坏死。镜下观见肿瘤细胞较小,排列呈规则而紧密的小管状、巢状乳头状或腺泡状结构。胞质淡染,胞核圆形、深染,核仁不明显,无异型性,无核分裂象或少见。本病特有的花蕾状或肾小球样结构极具诊断价值。另外可见组织间隙水肿、砂粒样结构或钙盐沉积,也可见肿瘤坏死。电镜下见胞质内细胞器稀少,上皮细胞腔面有微绒毛,肿瘤性小管周围有较为丰富的基底膜围绕。
免疫组化:MA表达WT-1、CD57,局灶表达CK7、CK、EMA,不表达CD56,Ki67增殖指数不高。有文献报道称S-100有助于MA的鉴别诊断,这一结果尚待进一步考证。Choueiri等报道90%MA会出现BRAFV600E基因突变,该检测的特异性和敏感性均较高,有望成为确诊MA的重要手段之一。
3.3鉴别诊断 ①肾母细胞瘤(Wilms tumor,WT): 因MA表达WT-1,提示与WT可能存在一定的关联。WT-1具有转录调节作用,可表达于肾脏与造血细胞,在正常肾小球、肾小管及肾盂的移行上皮细胞中呈阴性表达,是一种抑癌基因。Muir等人对MA、肾源性残余及WT做了一系列研究,认为三者均起源于后肾原始细胞,且MA和WT可能属于同一谱系肿瘤的两端,因此WT-1标记对二者的鉴别诊断没有意义。WT患者大多为儿童,成人罕见,体积常较大,肿瘤呈恶性生长,常压迫侵袭肾脏,边界不清,可有远处转移;肿瘤细胞异型性明显,核分裂象多见;特征性病变具有未分化胚芽组织、间叶组织和上皮样细胞三种成分,但在极少数情况下会呈现单一组织成分,当以上皮成分为主时就会难以与MA相鉴别;细胞异型性、核分裂象和灶性间变有助于诊断,CD57通常为阴性。研究发现Ki67可作为二者鉴别指标,其在WT呈高表达,而在MA呈低表达。②乳头状肾细胞癌(PRCC):需重点鉴别,镜下乳头状结构为其典型表现,乳头有纤维血管轴心,细胞异型性明显,核分裂象多见,常见泡沫样细胞,部分可见含铁血黄素沉着及沙砾体。当以实性为主型时与MA鉴别困难,需借助免疫组化检查,前者CK7多阳性且高表达AMACR,而CD57和WT-1多阴性。③肾脏原发的神经内分泌肿瘤: 因MA可表现为器官样排列,故需鉴别,神经内分泌标记物有助于诊断。④肾集合管癌:虽可呈管状排列,但细胞异型性非常明显,间质为伴有血管的纤维结缔组织,免疫组织可与鉴别。⑤乳头状腺瘤:管状乳头结构与后肾腺瘤相似,但瘤体小,缺乏水肿样间质,且EMA阳性。
3.4分子遗传学 大多数文献报道未检测到该肿瘤存在染色体异常,但鉴于遗传学检测例数有限,对该病的认识尚待进一步研究。近期发现90% MA存在BRAFV600E突变,这一特有的遗传学改变,提示MA是一种具有显著特性的独立病种。
3.5临床治疗及预后 MA被认为是一种具有良性生物学行为的罕见肾脏肿瘤。有报道指出少数MA患者中影像学检查发现患肾肾盂、肾盏受累,推测MA可能有一定的侵袭性。Pins等报道1例发生骨转移,也有报道发生局部淋巴结转移。但目前有多篇文献报道MA细胞中混杂有恶性肿瘤细胞的个案,其中Picken等报道1例混杂有恶性梭形细胞肉瘤成分的个案,并被命名为后肾腺肉瘤;而国内报道了1例MA中混杂有乳头状腺癌成分。目前尚缺乏大宗病例报道论证,谨慎起见故对于MA患者,术后有必要定期随访。
手术仍是治疗MA的首选方案。目前对于瘤体较小,与周围组织界限清,未见明显恶性倾向者,应选择保留肾单位的手术,如腹腔镜下肾部分切除术;对于瘤体较大,界限不清,或呈内性生长者,可选择根治性肾切除术。
综上所述,MA是一种罕见的肾脏上皮组织良性肿瘤,常误诊为恶性,术前增强CT对诊断有一定帮助,术前穿刺或术中冰冻诊断需慎重,绝大多数患者预后良好,但仍应进行密切随访,尤其对于组织学形态不典型的病例。














共0条评论