[导读] 作者:尹燕雪 李娟
3.胎儿血管灌注异常
建议用胎儿血管灌注不良(FVM)来代替胎儿血栓性血管病变。对于严重的FVM,建议使用术语“高级别FVM”(参见后面)。FVM的一系列病变可能是由于胎儿血流受阻导致,引起的原因包括脐带病变、高凝状态、胎儿心功能障碍的并发症,如低氧血症等。
支持FVM的血流病理生理学的相应病理形态包括血栓形成、节段性无血管绒毛和绒毛间质与血管壁核碎裂。其他可能的提示包括血管壁纤维素沉积、干绒毛血管闭塞/纤维肌硬化和血管扩张等。
活产的和死产的胎盘均可见到FVM的特征性改变。宫内死亡病例中出现FVM的情况复杂,可以是血栓形成倾向或血管阻塞等原因引起的,也可以是胎儿死亡后的退化的或退行性改变。如有血栓形成则证实是死亡前病理改变。在一些宫内死亡病例会发现无血管绒毛,这些绒毛间质细胞稀少,而死亡后的退变绒毛间质丰富,也可以用于鉴别。
FVM形态上可分为“低级别”和“高级别”。前一种指节段性FVM,表现为绒毛膜板或干绒毛血管血栓性阻塞,或干绒毛血管闭塞。虽然病变呈节段性分布,但血栓或梗阻造成的阻塞是完全的。后一种是弥漫性FVM,此时脐血流受到一定程度的影响,形态上表现为静脉扩张、大血管壁内纤维素沉积、和/或小灶性(每个病灶<5个)的无血管绒毛或间质核碎裂的绒毛。虽然梗阻是部分的或散在的,但病变可弥漫分布于整个胎盘实质。“节段性”一词的使用与其它专业病理的术语一致。
术语—应使用“胎儿血管灌注异常”。“高级别FVM”可用于描述严重的FVM病例。
高级别FVM指无血管绒毛的病灶≥2灶,且3个组织切片累计发现≥45个无血管绒毛或平均每个组织切片发现>15个无血管绒毛,可见到干绒毛血栓;或≥2个绒毛膜板或干绒毛血管血栓造成完全性或不完全性闭塞;或多发性的不完全性闭塞的血栓。
血栓形成—尽可能明确血栓形成是动脉血栓还是静脉血栓,以及血栓形成的位置:脐带、绒毛膜板、干绒毛或以上的组合。
静脉或动脉血栓不易确定,可以通过大体上绒毛膜板上的动脉走形于相应的静脉的上方这一特点加以明确(图21)。写明血栓形成位置有助于研究不同血管的血栓相应的临床意义。
无血管绒毛—应描述无血管绒毛的分布和范围。
先前发表的无血管绒毛标准略有修改。小病灶指3个或3个以上由2 ~ 4个终末绒毛形成的病灶,这些绒毛毛细血管完全丧失,绒毛间质均一的透明样变;中等病灶指单灶5 ~ 10个绒毛;大病灶指单灶>10个绒毛(图22)。
血管壁纤维素沉积—“血管壁纤维素沉积”是替代“附壁纤维蛋白垫”的标准术语。“孤立性血管壁纤维素沉积”指每张切片平均少于一个这样的病变。需同时描述是新鲜的还是陈旧性的。
纤维素沉积可以位于血管壁内皮下或肌层内。还应注意到,根据定义,沉积是非闭塞性的。血管壁内纤维素沉积的标准以前已经发表过:新鲜血管壁内纤维素沉积指胎儿大血管壁内见到纤维素或纤维素样物沉积(图23),陈旧性的指沉积物出现钙化(图24)。
虽然血管壁内纤维素沉积可能反映全局性FVM,但发现孤立的血管壁内纤维素沉积的意义尚不清楚。因此,量化可能有助于进一步的临床病理研究。
绒毛间质血管核碎裂—目前用“绒毛间质-血管核碎裂”来替代“出血性血管内皮炎”的诊断。
描述该病变还有其他的术语,但是我们仍认为“绒毛间质-血管核碎裂”反映了病变的形态。“出血性血管内皮炎”是不恰当,因为本病变并非炎症,且没有临床提示作用。先前已发表的绒毛间质血管核碎裂的标准稍作修正:3个或3个以上的病灶每灶有2 ~ 4个终末绒毛显示胎儿细胞(有核红细胞、白细胞、内皮细胞和/或间质细胞)存在核碎裂,但周围滋养细胞完整 (图25)。
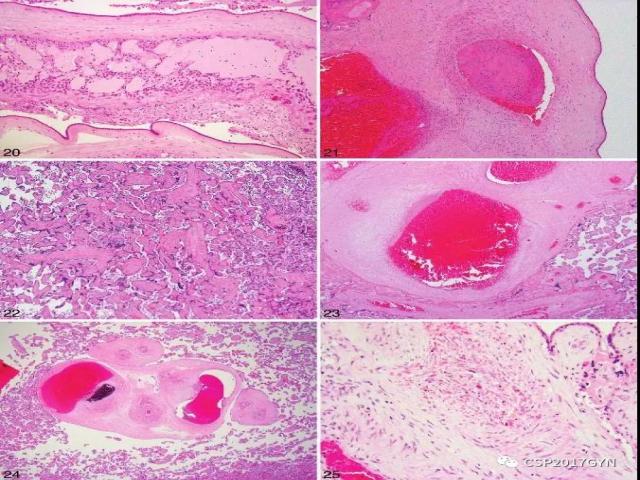
图20、平滑绒毛膜内形成的连续性假性囊肿 (HE,×10)。
图21、绒毛膜板中胎儿动脉(在伴行静脉上方)血栓形成 (HE,×10)。
图22、大片无血管绒毛,可比对右侧有血管的正常绒毛 (HE,×4)。
图23、大的干绒毛血管壁内可见纤维素沉积 (HE,×4)。
图24、在胎儿大血管壁内纤维素沉积伴钙化,表明病变陈旧 (HE,×2)
图25、绒毛间质血管核碎裂:胎儿细胞存在核碎裂,但周围滋养细胞完好 (HE,×40)
干绒毛血管闭塞—应使用干绒毛血管闭塞(纤维肌硬化的同义词)代替术语干绒毛血管内膜病变。
在干血管闭塞中,血管壁明显增厚,从而导致血管腔闭塞(图26)。
血管扩张—当组织学观察时,应注意是否有血管扩张。
血管扩张的原因目前尚不清楚,可能没有意义,也可能是与FVM相伴随的胎儿脐带损伤。血管扩张的特征是病变血管超过周围相对正常血管腔径的4倍(图27)。
4. 绒毛欠成熟
建议用“绒毛欠成熟”一词来代替“绒毛成熟缺陷”、“绒毛成熟不均”或“绒毛发育成熟不良”。这种病变通常发生在妊娠36周后,很少发生在妊娠34周之前,其特征是绒毛一致性的血管合体膜形成与该孕周不符,以及细胞滋养细胞连续分布和绒毛的毛细血管于绒毛中央聚集等。
胎盘中不同部位的绒毛成熟度正常情况下就存在不一致,采用“绒毛欠成熟”这一术语不会与这一生理现象相混淆。而“绒毛成熟不均”更突出了绒毛的正常的不均一成熟现象。“成熟障碍”和“绒毛状成熟缺陷”都过于宽泛,可以包括欠成熟和过度成熟。因此“绒毛欠成熟”这一术语较优,并且其更明确地与“绒毛过度成熟”相对应。
术语—建议使用“绒毛欠成熟”这一术语。
病变指单一绒毛群(定义为至少10个这样的绒毛)的毛细血管聚集于中央,血管合体膜形成不良,类似于不足该孕周的组织学形态(图28)。当这种病变出现在一张完整胎盘实质切片的至少30%绒毛时,应做出诊断。
推荐分级模式—根据提出的方案建议对病变进行分级:局灶性,即仅在1张切片中发现病灶;弥漫性,即在2张或更多的全层切片中发现病灶。
目前尚不清楚该病变引起不良后果的阈值,这一分级系统可能有助于确定病变的程度。
上行性宫内感染—与会者认识到上行性宫内感染在临床上有重要意义,其组织学诊断占据大部分胎盘病理的工作量。与会者一致强调,组织学上的绒毛膜羊膜炎可能并不等同于临床绒毛膜羊膜炎。然而,关于是否在报告中描述炎症的分期和分级存在争议。
炎症部位及特征—应记录炎症反应的位置和成分。
该小组认为,对于非专业病理医生来说,不遗漏炎症比炎症分级和分期(参见下文)更重要。描述炎症出现的部位可以区分母体和胎儿的炎症反应。这一点很重要,因为有证据表明,胎儿炎症反应与胎儿预后不良有关。慢性炎症过程可能与单纯急性炎症反应的临床意义不同,因此应予以记录。
绒毛膜板下炎症—在没有其他炎症的情况下,绒毛膜板下间隙或平滑绒毛膜层下存在中性粒细胞,并不等同于急性绒毛膜羊膜炎,应报告为“绒毛膜板下炎”(图29)。
在绒毛膜下纤维蛋白和/或蜕膜绒毛膜结合界面上偶尔出现斑块状积聚的分叶核白细胞提示羊水感染的反应的早期阶段,而绒毛膜羊膜炎确切含义应指在绒毛膜和羊膜的炎症(图30)。
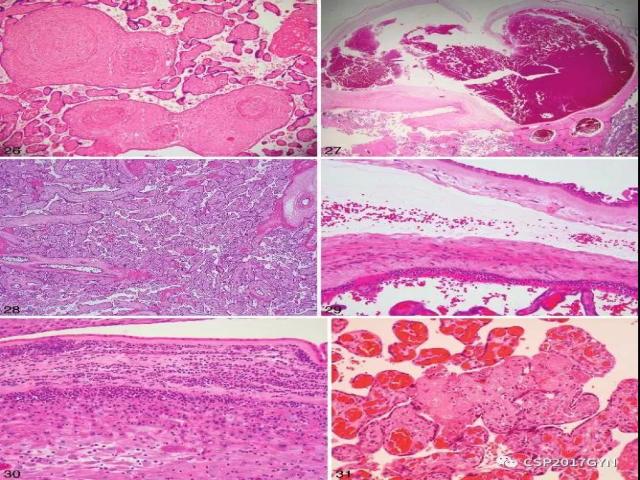
图26、干管血管闭塞:血管壁明显增厚,导致血管腔闭塞 (HE、×10)。
图27、血管扩张:绒毛膜板血管的腔径是相邻血管的四倍以上(HE、×2)。
图28、足月胎盘绒毛欠成熟:绒毛形态单一,毛细血管集中于绒毛中央,血管合体膜形成不良 (HE、×4)。
图29、绒毛膜板下的绒毛间隙内中性粒细胞聚集,提示绒毛膜板下炎 (HE、×10)。
图30、急性炎症细胞穿透平滑绒毛膜,进入羊膜,提示急性绒毛膜羊膜炎 (HE、×10)。
图31、低级别的病因不明的绒毛炎:同一灶累及多于5个绒毛 (HE、×20)。
分级和分期—鼓励对炎症进行分级和分期。由儿科病理学协会提供了一个模板和相应的定义(表)。

动脉或静脉受累或两者皆受累—应明确哪种类型的胎儿血管出现炎症反应。
有证据表明,脐动脉炎和脐静脉炎时出现的细胞因子改变存在差异,细胞因子水平与受累血管数量之间存在相关性。与没有脐动脉炎的新生儿相比,患有脐动脉炎的新生儿不良预后发生率更高。
报告格式—根据我们目前对该疾病过程的理解,建议将胎盘、胎膜和脐带的组织学急性炎症报告为:急性绒毛膜羊膜炎(或急性绒毛膜炎),伴有/不伴有胎儿绒毛膜血管、脐静脉和/或脐动脉(或动脉)炎症反应。
一些病理医生可能更喜欢使用“母体炎症反应”和“胎儿炎症反应”这两个术语。
5. 病因不明的绒毛炎
病因不明的绒毛炎(VUE)是一种组织学诊断术语。虽然有炎症的绒毛可能分布不均一,但有证据表明,3个胎盘组织实质的切片可以发现62%的绒毛炎,而6和7个组织切片可发现85%的绒毛炎。根据定义,病因不明的绒毛炎应排除那些已确定病因的病例,如病毒性或急性感染,因此这一术语优于“非特异性慢性绒毛炎”。炎性细胞主要是淋巴细胞和组织细胞,虽然极个别浆细胞的存在并不排除VUE的诊断,但在以浆细胞性绒毛炎为主的情况下,需要对感染性病因(如巨细胞病毒)进行全面的评估。
分级模式—如诊断为病因不明的绒毛炎,则应区分为低级别和高级别病变两种。低级别的定义为超过一个区域有不到10个相邻绒毛被炎症细胞累及(图31)。高级别的定义为多张切片有多个病灶,其中至少有一灶有多于10个相邻绒毛受累(图32)。
区分低级别和高级别的绒毛膜炎是很重要的,因为后者与FGR、神经发育障碍和复发显著相关。
低级别病变在一张切片上应进一步分类为局灶性病变和多灶性病变,局灶性病变指所有病变仅出现于一张切片上,有多于1个病灶且单一病灶累及<10个绒毛。多发病灶指病变出现2个及以上组织切片,所有的病单一灶都累及<10个相邻的绒毛。高级别病变进一步分为灶性和弥漫性,灶性病变呈多灶发生,见于1张或多张组织切片,至少一个病灶累及≥10个相邻绒毛。弥漫性高级别病变指炎症累及超过30%的远端绒毛。
极个别情况下,仅有一个病灶。目前没有充足证据表明其临床意义,当单个病灶较小(<10个连续的绒毛受到影响)应该报告为“无法分级-可能为低级别”,当单个病灶包含10个或更多影响绒毛应该报告为“无法分级—可能为高级别”。
血管损伤—当炎性细胞导致肌性血管损伤时,应使用伴有“干绒毛血管闭塞的绒毛炎”一词。当无血管的绒毛出现于有绒毛炎的胎盘中时,应报告为“伴有无血管绒毛的慢性绒毛炎”。
绒毛炎可导致胎儿-胎盘循环障碍,从而可导致诸如神经功能损害等不良预后。
在无血管绒毛伴有散在炎细胞时(图33)可能是“绒毛炎的终末阶段”,如果是大面积连续均一透明样变的无血管的绒毛(图34)则可能源于上游血管闭塞,但有时很难将无血管的绒毛归结于炎症或阻塞性过程。
位置—如果可能,应报告绒毛炎病灶的分布报情况。如位于近底板处/近胎盘隔处、胎盘实质内、绒毛膜板下或以上多个部位的组合。
近底板的绒毛炎通常与慢性蜕膜炎相关,据报道,在辅助生殖技术,尤其是供卵受孕的怀孕中更为常见,这对理解异常的母胎免疫具有重要意义(图35)。记录下这种分布,以及绒毛炎的程度(级别)可以帮助研究病变与临床的关联性。
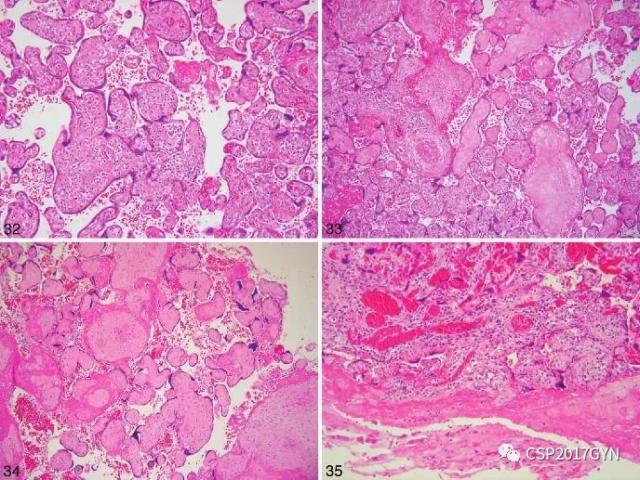
图32、高级别的病因不明的绒毛炎:同一病灶影响多于10个绒毛 (HE、×10)。
图33、偶尔出现伴有散在炎性细胞的无血管绒毛,提示“绒毛炎的终末阶段” (HE、×10)。
图34、成片的绒毛出现间质均一透明样变,提示上游血管闭塞 (HE、×4)。
图35、呈带状分布的近底板处绒毛炎 (HE、×10)。
其他炎性病变—应注意与绒毛炎相关的病变,如嗜酸性粒细胞/ T细胞血管炎、慢性绒毛间隙炎和慢性蜕膜炎。
嗜酸性粒细胞/T细胞血管炎可发生于绒毛膜血管的近羊膜侧或近胎盘实质侧,由T淋巴细胞和嗜酸性粒细胞组成,偶尔伴有血栓形成(图36)。慢性绒毛间隙炎可能与不良妊娠结局有关,也可能复发。有些报道严格除外了合并慢性绒毛炎,另一些报道是包含了合并的病例(图37)。慢性蜕膜炎定义是底板内有慢性炎症,并有明确的浆细胞(图38)

图36、A、绒毛膜血管嗜酸性粒细胞/T细胞血管炎 B、高倍镜显示T淋巴细胞和嗜酸性粒细胞的混合 (HE、A×4 B×40)。
图37、慢性绒毛间隙炎:组织细胞浸润绒毛间间隙 (HE、×20)。
图38、慢性蜕膜炎:底板可见大量淋巴细胞和浆细胞浸润 (HE、×20)。
翻译:尹燕雪①,李娟① 审阅:陶祥②,赵澄泉③
①山东省济南市妇幼保健院,
②复旦大学妇产医院,
③匹兹堡大学医学中心






















共0条评论