[导读] 中华病理学杂志,2015,44(10):696-703. 张绪超,陆舜,张力,廖美琳,王长利,程颖,李甘地,Mok Tony,黄诚,刘晓晴,王洁,王孟昭,张沂平,周建英,周晓军,周晓燕,林冬梅,杨衿记,宋勇,王凯,何勇,李慧,钟文昭,吴一龙,代表中国临床肿瘤学会(CSCO)肿瘤标志物专家委员会
原发性肺癌(简称肺癌)是我国最常见的恶性肿瘤之一。根据世界卫生组织(WHO)癌症Globocan数据库,2012年我国新发肺癌患者达65.28万,居所有恶性肿瘤之首,约占全球1/3,其中80%以上的患者为非小细胞肺癌(non-small cell lung cancer)。近十多年来,随着分子医学的进展和靶向药物的不断涌现,非小细胞肺癌的治疗已由化疗为主进入到个体化分子靶向"精准"治疗的时代。目前临床应用的个体化分子靶向治疗主要针对表皮生长因子(EGFR)突变型和间变性淋巴瘤激酶(ALK)融合基因型肺癌,这两种基因变异型肺癌均具有明确的分子靶点、靶点检测技术及上市的靶向药物,临床疗效得到明显提高。其他基因变异型肺癌的靶向药物和伴随分子诊断(companion diagnostics)技术正在不断研发中。
肺癌中ALK变异主要为ALK基因与其他基因发生断裂重排。其中,棘皮动物微管结合样蛋白4(EML4)-ALK融合基因变异是其主要类型,除了EML4外,肺癌中与ALK基因融合的其他基因还包括TFG和KIF5B等。国内外大量的研究数据显示,发生ALK重排的非小细胞肺癌患者占3%~7%。
目前,在中国获批的针对ALK靶点的小分子抑制剂为克唑替尼(crizotinib),针对ALK靶点的其他小分子抑制剂如赛瑞替尼(ceritinib)已被美国食品和药品管理局(FDA)批准用于克唑替尼治疗失败后的患者。在我国,相关适应证目前还处在临床试验阶段。克唑替尼是一种ATP竞争性酪氨酸激酶抑制剂,既可特异性靶向抑制ALK,也可抑制c-MET和ROS1等信号通路。临床试验显示对于ALK阳性的晚期非小细胞肺癌患者,克唑替尼的疗效显著优于传统化疗,一线单药治疗患者的中位无进展生存期(PFS)为10.9个月,有效率高达74%,二线单药治疗患者的中位PFS为7.7个月,有效率达到65.3%。2014年9月《新英格兰医学杂志》发表了克唑替尼在ROS1阳性晚期非小细胞肺癌患者1期扩展临床研究结果,在该研究中,克唑替尼在ROS1阳性非小细胞肺癌总体缓解率达到72%。中位缓解持续时间为17.6个月,中位PFS为19.2个月,且ROS1融合基因的种类不影响疗效。
目前针对ALK融合基因检测的常用方法有3种:荧光原位杂交(FISH)、即时荧光定量PCR技术(RT-PCR)和免疫组织化学法(IHC)。上述3种方法各有其优缺点。FISH价格昂贵,操作规范要求较高,且不能区分ALK融合类型(fusion variants);RT-PCR对标本质量要求较高,需专用的试剂盒进行检测;IHC简便易行,但阳性标准不统一。ALK阳性非小细胞肺癌虽仅占全部非小细胞肺癌的3%~7%,但是每年新发病例数在中国仍接近35000例。因此,如何准确和规范地诊断和治疗ALK阳性非小细胞肺癌便成了临床上的当务之急。中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)肿瘤标志物专家委员会于2013年组织诊断和治疗领域专家制定了中国ALK阳性非小细胞肺癌的诊断专家共识(2013版)。基于近年来新出现的大量研究和循证医学证据,肿瘤标志物专家委员会决定对2013版专家共识进行更新,并将共识升级为指南及补充治疗指南。
一、ALK阳性非小细胞肺癌的定义
2007年Soda等和Rikova等分别发现肺癌中存在EML4-ALK融合基因变异现象,且该基因变异具有致癌性,明确了EML4-ALK融合基因是肺癌的驱动基因之一。2009年Shaw等将ALK基因重排阳性的肺癌列为非小细胞肺癌的一个特定分子亚型。根据已有的研究结果,CSCO肿瘤标志物专家委员会讨论认为,从检测方法学角度考虑,ALK融合型非小细胞肺癌不仅是基因序列层面的改变即序列重排,ALK融合蛋白也是该类疾病中的重要变异,因此将此类疾病统称为"ALK阳性非小细胞肺癌"。检测方法具体包括ALK基因FISH检测、ALK融合变异RT-PCR检测或ALK融合蛋白IHC检测阳性的肺癌。该类肺癌是非小细胞肺癌的一个分子亚型,常见于腺癌,其患者通常可从ALK酪氨酸激酶抑制剂(TKI)治疗中获益。
二、ALK检测适宜人群
CSCO肿瘤标志物专家委员会讨论了肺癌中ALK检测的适宜人群、标本条件及与其他分子标志物分析的关系,做出以下推荐或建议。
1.晚期非小细胞肺癌患者使用ALK TKI治疗前必须检测ALK融合变异状态。推荐所有含腺癌成分的非小细胞肺癌患者在诊断时常规进行ALK融合基因或融合蛋白检测(1类)(证据级别定义请见文章末注释)。
2.对于小活检标本或者不吸烟的鳞状细胞癌患者也建议进行ALK检测(1类)。
3.检测前应有送检标本的质控,包括亚型确认和标本量确认。送检标本类型包括手术标本、活检组织标本、胸水等细胞学标本。由于部分活检组织标本临床取材小标本的局限性,有时无法保证肺腺癌的准确诊断,应考虑对不能判断组织学类型的肺癌也进行ALK检测(1类)。
4.对于送检标本ALK融合和EGFR突变双阴性的患者,美国国家综合癌症网络(NCCN)指南推荐进一步检测ROS1的重排,考虑到小活检标本的有限性,关于ROS1的检测,在患者的允许下,推荐ROS1、ALK和EGFR同时检测(2A类)。目前关于ROS1检测方法还没有完全统一,建议有条件的实验室先进行ALK/ROS1的IHC检测,ROS1检测结果阳性的患者,进一步使用FISH或者RT-PCR确诊。
5.为了避免标本浪费和节约检测时间,对于晚期非小细胞肺癌活检标本,建议一次性切出需要诊断组织类型和ALK/EGFR检测的标本量,避免重复切片浪费标本(2A类)。
6.有研究表明,在我国年龄是ALK阳性非小细胞肺癌一项显著的独立预测因子,在年轻非小细胞肺癌患者中,发生ALK融合的概率显著高于发生EGFR突变的概率,在年龄小于51岁的患者中,发生ALK重排的概率高达18.5%。因此对于样本量有限、可能不能满足同时检测ALK/EGFR检测的样本,对年轻的患者,建议优先检测ALK融合状态(2B类)。
三、ALK阳性非小细胞肺癌的检测
目前,我国国家食品药品监督管理总局(CFDA)批准的诊断ALK阳性非小细胞肺癌的诊断试剂盒有雅培贸易(上海)有限公司的ALK基因重组检测试剂盒(FISH法)、罗氏诊断产品(上海)有限公司的Ventana抗ALK抗体诊断试剂盒(IHC法)和厦门艾德生物医药科技有限公司的EML4-ALK融合基因检测试剂盒(RT-PCR法)。对于ALK阳性非小细胞肺癌的诊断,推荐使用CFDA批准的诊断试剂和方法进行诊断(1类)。
具体使用何种方法,检测实验室应根据组织标本类型选择合适的检测技术。当怀疑一种技术的可靠性时(如FISH的肿瘤细胞融合率接近15%时),可以考虑采用另一种技术加以验证。其他检测手段如常规IHC技术可以作为ALK融合基因的初筛手段,对于初筛结果ALK阳性的患者建议使用上述3种批准的检测方法之一进行确诊。
1.FISH:
在针对ALK阳性的非小细胞肺癌的临床试验中,大部分研究检测ALK融合均是基于FISH的诊断,因此,FISH检测目前仍是诊断ALK融合基因的经典方法。2014年10月CFDA批准雅培FISH分离探针试剂盒(Vysis ALK Break Apart FISH Probe Kit)用于诊断ALK融合基因。该试剂盒设计的两种探针分别标记ALK基因的两端,300 kb的3'端和442 kb的5'端分别标记为橘红色和绿色。在无ALK融合基因表达的肿瘤细胞中,橘红色和绿色重叠为黄色或者相互黏合(两个信号之间的间隔小于两个信号的直径);而在存在ALK融合基因表达的肿瘤细胞中,橘红色和绿色信号相互分离(间隔≥2个信号直径)或绿色信号缺失。标本FISH阳性结果的判定标准为单个视野中的50个肺癌细胞中至少有25个存在分离信号或绿色信号缺失,或者两个不同视野中的100个肺癌细胞中至少有15个存在分离信号或绿色信号缺失。详细的FISH阳性判读标准可参见雅培ALK分离FISH探针试剂盒说明书。ALK FISH技术适用的组织样本类型:4%中性甲醛固定后石蜡包埋标本,采用防脱落技术处理的玻片装载切片,厚度3~5μm。FISH检测ALK融合也存在不足之处。首先,FISH检测对于操作和判读技术要求较高,诊断医师必须经过严格的FISH操作和结果判读培训。只有经FISH操作经验丰富的医师判定的结果才具有可靠性。其次,晚期非小细胞肺癌患者通常只能提供2mm左右的小活检组织,很难保证每个视野均存在50个以上的肺癌细胞进行判读。此外,FISH检测结果的判断界值(cut-off值)也存在商榷之处,已有多项研究发现少数ALK FISH阴性、IHC阳性的患者也能从克唑替尼治疗中明显获益。最后,目前FISH检测的成本昂贵,且不能明确ALK融合基因的具体融合变异体。因此,虽然FISH检测仍是经典ALK诊断手段,但现阶段尚无法适用于中国ALK阳性非小细胞肺癌患者的大规模筛查和诊断。
2.IHC:
(1)Ventana IHC:由罗氏公司开发的Ventana anti-ALK抗体诊断试剂盒在2013年获CFDA批准用于诊断ALK阳性非小细胞肺癌。由于其在全自动免疫组织化学仪器上操作,检测流程和结果判读都得以标准化。该技术平台方法使用了基于非内源性半抗原、信号扩增多聚体和辣根过氧化物酶(HRP)系统的染色信号放大技术。在不影响检测特异性的前提下,大大提高了ALK融合蛋白IHC检测的敏感性。结果判读时采用简单易行的二分类系统,即仅为阳性和阴性两种,阳性结果即可诊断为ALK阳性非小细胞肺癌。大量研究数据表明其与FISH结果的吻合率达到95%以上,结果判读的可重复性大于95%,目前在中国已经广泛应用于临床ALK阳性非小细胞肺癌的诊断。同时,由于操作简便,检测准确度较高,相对于其他诊断方法价格便宜。国际上其他ALK抑制剂的3期临床试验中,ALK Ventana IHC已经成为ALK阳性非小细胞肺癌的首选检测方法。因此专家共识推荐:Ventana IHC可以作为ALK阳性非小细胞肺癌的临床首选的常规诊断方法(2A类)。诊断报告中应该注明Ventana IHC方法,以区别于初筛的常规IHC方法。虽然Ventana IHC具有操作简便、检测的准确度较高、相对于其他诊断方法价格便宜等优势,但Ventana IHC需要专门的自动化染色仪器,而目前,在相当一部分检测实验室还没有Ventana的染色自动化仪器,这在一定程度限制了它在临床上的广泛使用。Ventana IHC技术适用的临床标本类型:4%中性甲醛液固定后石蜡包埋标本,采用防脱落技术处理的玻片装载切片,厚度3~5μm。(2)常规IHC技术:由于FISH检测存在由于经济适用性差和技术操作有难度不易普及的不足,Ventana IHC自动化设备在中国相当一部分检测实验室还没有普及。因此,有必要有一种初筛的方法来满足部分检测实验室的需求。目前已有较多学者不断探索其他的分子诊断检测方法。常规IHC技术因其具有简便易行、价格便宜、操作方法成熟等特点,成为潜在有效的筛查方法之一。目前,在非小细胞肺癌患者中,可以用于ALK融合基因筛选的抗体主要为D5F3(Cell Signaling公司)和5A4(Abcam公司),它们检测ALK融合蛋白的敏感性和特异性分别达到了100%和95%~99%,ALK1抗体敏感性较低(ALK1, Dako公司),不适宜用于ALK融合基因的检测。总结已报道的数据后发现(表1),常规(指非自动化仪器辅助的手工操作)IHC检测的强阳性与FISH检测阳性之间存在高度的一致性。IHC 3+、2+、1+、–的患者FISH阳性率分别为95.9%、57.0%、5.8%和0。现有数据也证实ALK IHC阳性与克唑替尼临床疗效之间存在相关性。
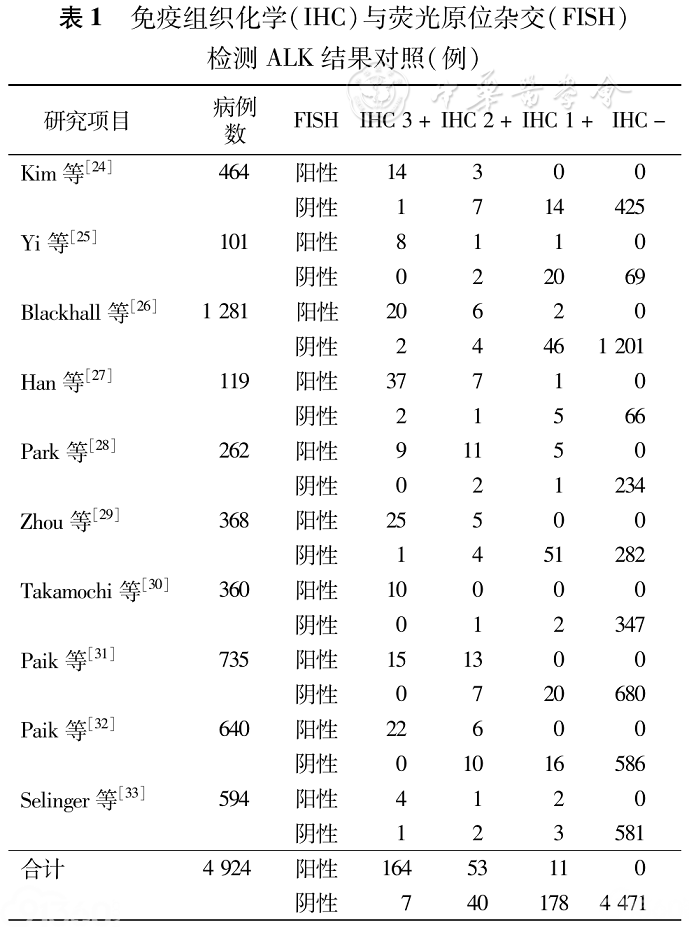
表1:免疫组织化学(IHC)与荧光原位杂交(FISH)检测ALK结果对照(例)
采用IHC法需注意以下两点:第一,由于ALK的蛋白表达与神经外胚层的分化有关,故其可能在小细胞肺癌和正常人的脑组织中表达,因此不建议在小细胞肺癌中使用ALK融合蛋白的IHC检测;第二,常规ALK IHC操作和判读标准还未统一,在实验室开展常规ALK IHC前,需要对抗原修复、一抗的类型和浓度、抗体孵育的温度和时间等关键步骤进行优化统一,建议采用国内病理专家已经达成共识的规范化操作和判读标准进行操作。
由于常规IHC存在上述优缺点,考虑到晚期非小细胞肺癌样本的有限性,而常规IHC在临床实践中具有可操作性,我们推荐:(1)有条件的单位首选Ventana IHC方法检测(1类);(2)对于不能开展ALK Ventana IHC检测的实验室,鼓励患者尤其是小活检标本患者,将标本送到周边能开展Ventana IHC检测的实验室进行ALK融合基因检测(2A类);(3)在条件缺乏的地区建议采用常规IHC法进行ALK阳性非小细胞肺癌患者的初筛,筛查ALK阳性或疑似阳性的患者必须接受FISH、Ventana IHC或者RT-PCR技术中任意一种技术确诊(2A类)。
3.基于PCR扩增的方法:
(1)即时定量RT-PCR:RT-PCR法检测ALK融合基因的特点在于快速、简便易行、能同时明确ALK已知的融合变体的类型。既往RT-PCR的不足之处在于假阴性率高,这是由于RT-PCR对于RNA的质量要求较高,若结果为阴性,则很难判定是真阴性还是RNA降解所致的假阴性。此外,目前在非小细胞肺癌中已陆续发现了超过20种不同的ALK融合变体,不能排除仍有未知融合变体的存在。因此,无法检测未知的融合型是其最大的不足之处。这些因素限制了RT-PCR在ALK融合基因诊断中的应用。目前,随着PCR技术的进步,上述很多问题已能得到很好的解决,RT-PCR的检测结果与FISH检测的阳性吻合率和阴性吻合率分别达到98.4%和94.6%。2013年CFDA已批准厦门艾德生物技术有限公司的可用于临床的ALK融合基因检测的试剂盒(EML4-ALK融合基因检测试剂盒),通过多重引物RT-PCR法,需100~500ng肿瘤组织的RNA,即可检测出EML4-ALK融合基因的阳性信号。该试剂盒可检测7种不同的EML4-ALK融合基因型,基本涵盖了常见的EML4-ALK融合基因型。该方法适用于甲醛液固定石蜡包埋的肿瘤组织标本和各类新鲜组织或细胞学标本。不过,RT-PCR法也存在着无法检测未知的融合变体和对RNA提取质量要求较高等不足之处,需要临床上提高组织标本的保存质量。(2)cDNA末端快速扩增PCR联合测序方法:除了RT-PCR方法外,广东省肺癌研究所Zhang等采用cDNA末端快速扩增PCR联合测序技术成功检测分析了ALK基因的融合变异。该方法的独到之处在于采用cDNA末端快速扩增技术结合两轮PCR技术来富集扩增ALK基因的融合变体,敏感性高,不限于检测EML4与ALK的融合,而且可以检测到其他任何基因与ALK的融合,联合PCR产物的直接测序步骤能够明确融合是来自EML4-ALK多种变体中的具体哪一种。这具有一定的临床意义。已知不同EML4-ALK融合基因变体的酪氨酸激酶活性程度有明显差异,因而可能对临床用药剂量有一定的指导价值。该方法主要适用于各类新鲜组织或细胞学标本。
开展基于PCR技术检测ALK融合变异的实验室环境要求应该能够保证检测质量,PCR实验室需要符合我国卫生计生委临床检测中心的临检PCR实验室资格认证条件。各检测实验室应做好室内质控,并积极参与外部质控评价项目。考虑到PCR扩增片段的非特异性技术特点,判断基于PCR技术诊断ALK融合变异阳性应该满足以下条件:PCR产物经测序后序列比对确认存在ALK融合序列、或基于融合变异序列特异性荧光探针的即时定量PCR检测结果阳性。单纯RT-PCR产物经电泳后的条带观察不推荐作为ALK融合基因诊断依据。
上述多种技术都可以选择,各有优缺点,存在一定的互补性。结合临床可获得的各类生物材料标本(手术或穿刺活检组织、胸水细胞学和痰液细胞学等),有效利用各种检测分析技术获得最高检出率具有重要科学意义和临床意义。
4.可用于检测ALK的其他方法简介:
(1)高通量测序技术:高通量测序(high-throughput sequencing)又名下一代测序(next generation sequencing,NGS),是相对于传统的桑格测序(Sanger sequencing)而言的。NGS是近几年发展最为迅速的技术之一,以其高数据输出量与高解析度的特性,不仅可以同时检测多个基因的突变、融合和拷贝数变化情况,而且使得检测的费用和时间大大缩短。2014年在美国临床肿瘤学会(ASCO)会议上,Ali等展示了利用NGS可以有效鉴定出FISH不能诊断出的ALK阳性肺癌患者,在9例ALK NGS阳性FISH阴性的患者中,5例患者对克唑替尼治疗有响应,2例无响应,还有2例无法评估,显示了NGS在ALK检测上的优越性。除了检测灵敏度比较高外,NGS还可以同时检测多个其他靶点。这样既节约了标本,也节省了患者等待检测结果的时间,对于突变频率不高的靶点,重要性显著提高。基于这些优势,NCCN肺癌指南从2014年第3版开始,推荐使用NGS同时检测EGFR突变和ALK融合。NGS虽然具有很多优势,国内外有多款NGS仪器获得CFDA批准用于临床,且有多家公司正在研发基于NGS的肿瘤生物标志物检测试剂盒。但目前,关于NGS检测样本的质控、数据的解析等一系列问题还没有明确的规范。国内也没有一款获批的基于NGS的肿瘤生物标志物检测试剂盒,且目前NGS的收费还比较高。因此,在临床常规检测中,暂不推荐使用NGS来常规检测EGFR突变和ALK融合,但各中心可以根据实际情况,在临床研究中使用NGS来筛查ALK等相关基因的融合突变情况。(2)特异性的RT-PCR联合测序方法:特异性RT-PCR是确认非小细胞肺癌存在ALK融合基因的另一种快速诊断方法。技术优势在于其检测突变转录本的高敏感性,如发现扩增产物则意味着ALK融合基因。该技术也存在一些不足。首先,RT-PCR分析必须基于单管多重技术(multiplex),由于EML4-ALK融合基因至少存在11种变体和非EML4的其他融合配对者,所以任何基于PCR的检测策略必须配对所有已知ALK融合基因的明确引物,否则对于潜在的非EML4基因的配对者与ALK基因融合就无法检测出来,而且对于潜在的EML4第21号外显子与ALK融合的转录变体长度达1284 bp也可能难于检测。第二,肺癌患者甲醛液固定石蜡包埋组织提取的RNA很容易降解,与新鲜冷冻组织相比,采用RT-PCR操作甲醛液固定石蜡包埋组织标本RNA的难度较大。第三,存在出现非特异性扩增的风险而出现假阳性,需要较高的实验室环境,防止出现交叉污染。在常规临床诊断实验室可能难于开展。
四、ALK阳性非小细胞肺癌诊断流程
鉴于ALK基因重排或融合的常用分子诊断各种方法的优缺点(表2),且我国适用于ALK变异检测的肺癌患者人数众多,需要在临床建立一套行之有效的分子诊断流程。常规IHC因其具有方便、易行、价格低的优势,适合于ALK阳性非小细胞肺癌的筛查。FISH、Ventana IHC和RT-PCR已获CFDA批准用于临床检测,适合于最终的确诊。以上3种方法的具体操作流程和注意事项可参见CFDA批准的产品说明书。
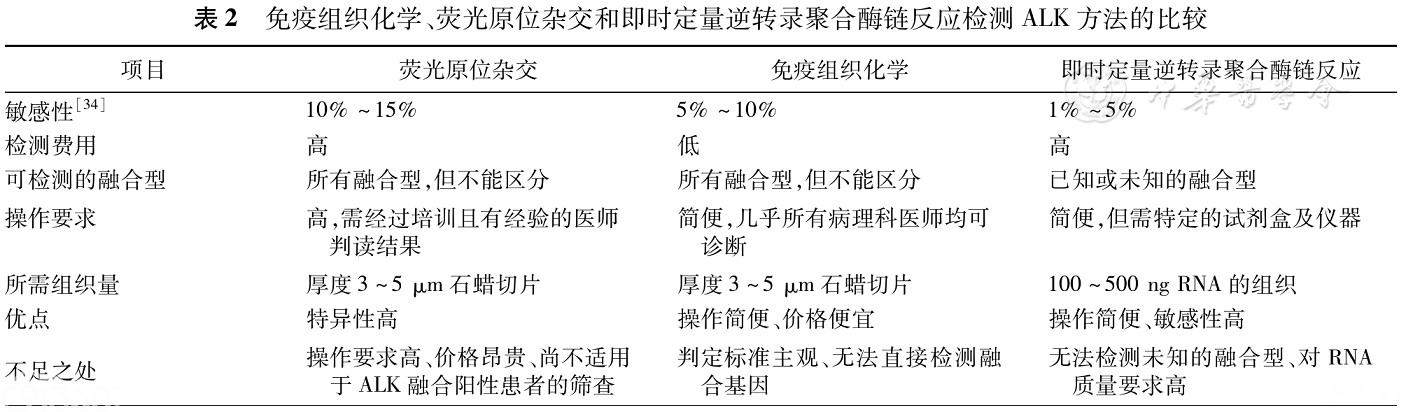
表2:免疫组织化学、荧光原位杂交和即时定量逆转录聚合酶链反应检测ALK方法的比较
ALK检测总体原则:综合获取的各类生物材料的特征、分子检测方法的特点、实验室自身条件,进行多学科大协作,合理采取有效检测方法和流程,以保证ALK融合型非小细胞肺癌的检出率和准确率。
适合ALK融合基因诊断的肿瘤标本,包括各种组织标本和细胞学标本。组织标本获取手段包括手术切除、支气管镜检、经皮肺穿刺、淋巴结活检、手术活检等。对于恶性胸腔积液、心包积液、痰液或支气管灌洗液和细胞学穿刺等标本,在细胞数量充足条件下可制备细胞学标本蜡块(cell block),检测方法可采用FISH、IHC或RT-PCR,如果是新鲜细胞标本可考虑采用特异性PCR方法。考虑到细胞学标本的细胞数量少等特点,细胞学标本的检测结果解释需格外谨慎。
综合考虑上述讨论因素:各类检测技术的优缺点和各组织类型的技术适用性特点,CSCO肿瘤标志物专家委员会推荐以下用于临床实践的检测流程图(图1)。
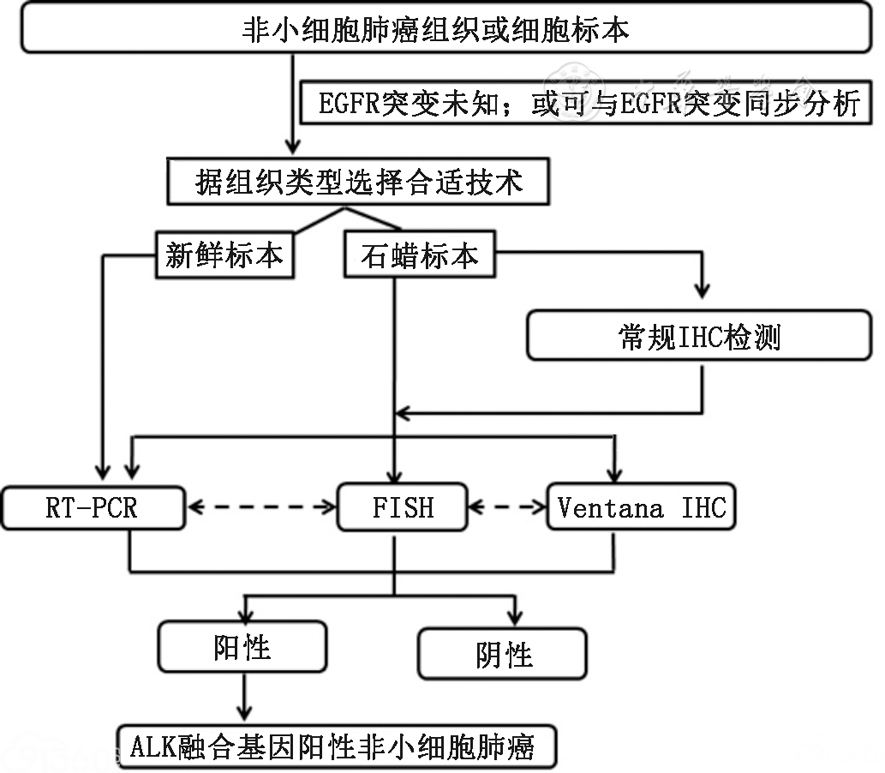
图1:中国ALK阳性非小细胞肺癌患者的诊断流程图
1.对于部分无条件行Ventana IHC检测的医疗机构或中心,常规ALK IHC可作为初筛方法,但阳性标本需以CFDA批准的FISH、Ventana IHC或RT-PCR技术进一步确诊。
2.所有含腺癌成分的非小细胞肺癌,应在诊断时常规进行ALK融合基因检测。
3.ALK抗体使用推荐:常规IHC建议使用Cell Signaling公司的D5F3克隆号、Abcam或Novocastra公司的5A4克隆号抗体;Ventana IHC使用专用抗体试剂盒(D5F3)。
4.流程图中FISH、RT-PCR、Ventana IHC技术之间的虚线表示单一技术检测结果判断不确定(equivocal)时三种方法之间可相互验证结果。
5.NCCN肺癌指南从2014年第3版开始,推荐使用NGS来同时检测EGFR突变和ALK融合。NGS虽然具有很多优势,但目前,关于NGS检测标本的质控、数据的解析等一系列问题还没有明确的规范。国内也没有一款获批的基于NGS的肿瘤生物标志物检测试剂盒,且目前NGS的收费还比较高。因此,在临床常规检测中,暂不推荐使用NGS来常规检测EGFR突变和ALK融合,但各中心可以根据实际情况,在临床研究中使用NGS来筛查ALK等相关基因的融合突变情况。
五、ALK阳性晚期非小细胞肺癌的治疗
1.一线治疗:
对于晚期非小细胞肺癌,含铂双药方案是标准一线化疗方案。而ALK阳性晚期非小细胞肺癌经确诊后,一线首选克唑替尼治疗,PROFILE 1014研究证实,一线患者PFS可达10.9个月,总体缓解率可达74%,并且患者的疾病相关症状(如咳嗽、胸痛和呼吸困难等)和整体生活质量得到显著的改善。值得注意的是,脑转移及65岁以上老年人群亚组患者也能从克唑替尼的治疗中PFS获益。因此,专家委员会推荐:对于ALK阳性晚期非小细胞肺癌患者,应一线使用克唑替尼治疗(1类)。克唑替尼治疗最常见的不良反应(≥25%)为视觉异常、恶心、呕吐、腹泻、便秘、水肿、转氨酶升高及疲乏。但通常这些反应的级别较低,主要为1或2级。在PROFILE 1014研究中3/4级不良反应中发生率相对较高的为转氨酶升高(14%)及中性粒细胞减少(11%),在临床应用过程中,要注意患者肝功能及全血细胞计数的监测。较少发生的严重不良反应为间质性肺病,在PROFILE 1014研究中发生率为1%,治疗过程中要注意监测患者间质性肺病的症状和指征,一旦发生间质性肺病需永久停药。克唑替尼推荐起始治疗剂量为250mg,每日2次,口服。在治疗的过程中,如果患者出现3/4级不良事件,需一次或多次减少剂量。第一次减少剂量:200mg,每日2次,口服;第二次减少剂量:250mg,每日1次,口服;如果每日1次口服250mg仍不能耐受,则永久停服。
2.二线及后续治疗:
晚期非小细胞肺癌二线治疗可选择的化疗药物包括多西他赛和培美曲塞(2A类)。而ALK阳性非小细胞肺癌患者的二线治疗,PROFILE 1007研究证实,与标准二线化疗(培美曲塞或多西他赛单药)相比,克唑替尼治疗组患者PFS显著延长(7.7个月比3.0个月),肿瘤缓解率明显提高(65%比20%),并且患者的整体生活质量和疾病相关症状(如疲乏、咳嗽、胸痛及呼吸困难等)改善更显著。因此,专家委员会推荐:如果一线治疗时没有应用ALK-TKI治疗,推荐克唑替尼用于ALK阳性晚期非小细胞肺癌患者的二线或后续治疗(2A类)。
3.ALK-TKI治疗疾病进展后的治疗:
ALK阳性非小细胞肺癌患者接受克唑替尼治疗后,如同其他TKI治疗一样,不可避免在1~2年内相继发生RECIST(version 1.1)定义的疾病进展。在克唑替尼治疗出现疾病进展后,根据患者的症状、转移部位、单发/多发病灶决定患者是否继续接受克唑替尼治疗。如患者进展无症状,推荐继续使用克唑替尼治疗;如患者出现有症状的单发脑转移或系统性转移灶,考虑局部治疗结合继续克唑替尼治疗;如患者出现有症状的多发脑转移,考虑全脑放疗结合继续克唑替尼治疗;如患者出现有症状的系统性多发转移灶,考虑二代ALK-TKI治疗(克唑替尼治疗进展后二代ALK-TKI治疗的临床研究正在进行中,二代ALK-TKI在中国尚未获批),或腺癌的其他一线治疗(根据患者功能状态评分进行双药化疗)(2A类)。新近回顾性研究显示,克唑替尼后续Ceritinib治疗,患者中位PFS达17.4个月,中位总生存期达49.4个月。目前关于ALK-TKI治疗进展后治疗的高级别循证医学证据较少,但一系列研究正在进行中,如克唑替尼治疗进展后二代ALK-TKI治疗的研究,以及克唑替尼治疗进展后化疗(培美曲塞单药)联合不联合克唑替尼的SWOG1300研究(NCT02134912)等,期待这些研究结果能提供更多的循证医学证据。因此,专家委员会推荐:(1)ALK阳性患者接受克唑替尼治疗后出现耐药进展,考虑到二代药物在我国尚未上市,鼓励患者参加临床试验,以期获得新药进行治疗。(2)经ALK-TKI治疗后的患者出现寡转移或缓慢进展后,如果一般情况良好,且无显著临床症状恶化,可继续口服克唑替尼,并针对局部病灶进行治疗,如无神经系统症状的脑部转移等。若患者出现多部位的全面进展,且临床症状出现恶化后,可换用两药含铂方案进行化疗。再次出现进展后,可根据患者功能评分,酌情选用之前未选用的化疗药物进行治疗(2A类)。
六、小结
基于EGFR突变和ALK融合变异等分子标志物的肺癌分子靶向个体化治疗模式已经在临床建立和应用。吉非替尼、厄洛替尼和克唑替尼等EGFR或ALK抑制剂已经应用于临床,在我国正在向更多的肺癌患者推广应用。非小细胞肺癌的分子靶向治疗将越来越依赖于分子靶点变异的分子诊断。临床实践中分子检测的标准化和检测流程的建立对于提高临床实践能力起关键作用。ALK融合变异作为晚期肺癌中第二个明确应用的分子分型,其诊断方法和流程仍需进一步结合临床数据进行优化。我们根据目前ALK融合基因检测各种方法的优缺点、临床标本的特点和实验室的条件,提出合理的检测流程,推荐应用方法和注意事项。希望各诊疗中心能客观准确地筛查ALK融合变异患者,合理开展基于明确分子诊断的靶向治疗,真正造福广大肺癌患者。
本次"中国ALK阳性非小细胞肺癌诊断治疗的指南"是在CSCO肿瘤生物标志物专家委员会的倡导下,从临床诊断和治疗的角度出发,结合我国肺癌患者众多(约占全球1/3)的现状,综合最新的循证医学研究数据和CFDA批准的药物和伴随诊断方法,供临床实践参考。本指南将根据实际情况定期更新,期望能为未来进一步优化ALK阳性肺癌患者的诊断和治疗提供指导。
注释:CSCO肿瘤生物标志物专家委员会证据或共识水平的定义:
1类:表示该推荐内容基于高水平的证据,并且在本指南制定专家成员中具有广泛的共识,建议值得信赖。
2A类:表示该项推荐基于临床经验在内的较低水平证据,本指南制定专家成员达成共识,因此该推荐是可以信赖的。
2B类:表示该项推荐内容基于临床经验在内的较低水平证据,本指南制定专家成员对于该建议的适宜性意见不一致,但无较大分歧。
3类:表示CSCO肿瘤生物标志物专家委员会专家存在较大分歧。
本文中所推荐的共识证据级别除了少数做特别说明之外,均在2A类以上。
摘自:中华病理学杂志, 2015,44(10): 696-703. DOI: 10.3760/cma.j.issn.0529-5807.2015.10.003
参考文献:略
















共0条评论