[导读] 作者:丁唤飞、姚远洋、沈丹华、王建六;选自:中华妇产科杂志2016年2月第51卷第2期第141-143页
血管肉瘤为少见的软组织恶性肿瘤,好发于头颈部皮肤及表浅组织,约占软组织肉瘤的2%。发生于女性生殖系统的血管肉瘤尤为少见,且卵巢血管肉瘤仅占生殖系统血管肉瘤的1%[1]。原发性卵巢血管肉瘤恶性程度高,疾病进展迅速,且预后很差[2]。目前,国内外文献报道多为病例报告,尚无成熟的治疗方案,多以手术联合化疗为主。2015年2月25日北京大学人民医院妇产科收治1例原发性卵巢血管肉瘤患者,现结合文献复习对本病的临床特点、诊断与鉴别诊断、治疗及预后进行探讨。
一、临床资料
患者51 岁,因右下肢疼痛5 个月、右腹股沟疼痛2 个月、下腹痛伴血尿1个月于2015年2月25日收入本院。入院后妇科检查:子宫增大如孕3个月,右侧附件区可触及直径约10 cm的包块,质硬,不活动。
盆腔CT扫描:
右侧附件区可见巨大囊实性包块,大小为12.8 cm×11.6 cm×7.8 cm,侵犯右侧输尿管下段致中上段输尿管梗阻扩张,并侵犯相邻小肠、盲肠及子宫,考虑右侧附件恶性占位性病变。
尿常规检查:
(尿流式)红细胞1.94×109/L;血清CA125 水平为52.99 kU/L。术前行膀胱镜检查,见双侧输尿管开口位置正常,左侧见明显喷尿,右侧输尿管口周围黏膜水肿明显,未见明显喷尿,在导丝引导下经右侧输尿管口逆行置入单根D-J管,置入过程阻力大,置入后管口未见明显喷尿,后行立位腹部X线片检查,显示右侧输尿管走行区可见D-J管影。
于2015年2月27日行开腹探查术,术中见:
盆腔右侧有一灰红色实性肿物,直径约10 cm,来源于右侧卵巢,固定不活动;肿物与周围大网膜及肠管粘连,肿物的左侧与子宫右后壁无界限。
术中快速冰冻病理检查结果:
可见肿瘤细胞浸润,细胞质丰富,轻~中度异型,考虑来源于间叶组织。因肿物包裹右侧输尿管,范围约6 cm×4 cm,考虑切除肿物及受累的输尿管可能会造成输尿管缺损,遂行子宫全切除+双侧附件切除术。
术后大体标本:
右侧卵巢结构不清,与子宫右后壁相邻处可见灰红色、质糟脆的肿瘤组织,大小为6 cm×5 cm×4 cm;肿瘤累及子宫,部分达子宫肌层的全层。见图1。
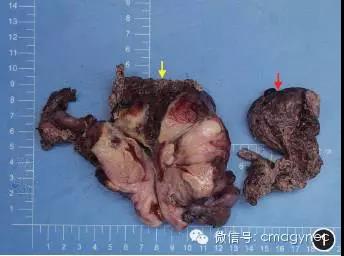
图1 原发性卵巢血管肉瘤的术后大体标本见:右侧卵巢(红色箭头)结构不清,肿瘤组织呈灰红色,质糟脆,大小为6 cm×5 cm×4 cm;肿瘤累及子宫(黄色箭头),部分达子宫肌层的全层
镜下表现:
肿瘤细胞呈梭形及多形,细胞有异型性,可见核分裂象,为5个/10个高倍镜视野(HPF),细胞间可见裂隙样结构,肿瘤伴有广泛性出血及坏死,部分区域可见残留卵巢白体。见图2。免疫组化EnVision法检测显示,钙结合蛋白(caldesmon)、CD31(图3A)、CD34、细胞周期蛋白D1(cyclinD1)、p53 蛋白呈阳性,细胞增殖相关核抗原(Ki-67)蛋白30%呈阳性(图3B),细胞角蛋白(CK)、上皮膜抗原(EMA)、CK5/6、结蛋白(desmin)、CD10、p16、ER、PR、胎盘催素(HPL)蛋白呈阴性。术后病理诊断:原发性卵巢血管肉瘤。
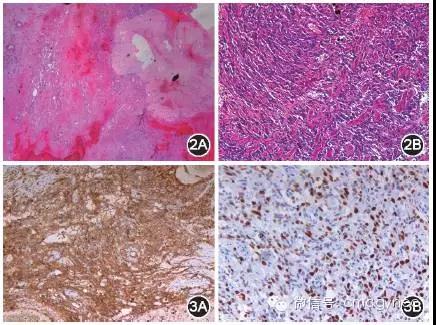
图2 原发性卵巢血管肉瘤组织HE染色后的镜下观察结果2A:卵巢结构破坏,有大片出血坏死,可见残留白体。HE ×40 2B:出血坏死灶旁可见呈梭形的肿瘤细胞,细胞有异型性,细胞间可见裂隙样结构。HE ×200
图3 原发性卵巢血管肉瘤组织的免疫组化EnVision 法检测结果3A:梭形的肿瘤细胞胞质中,CD31蛋白呈棕黄色颗粒状阳性表达。EnVision ×100 3B:肿瘤细胞增生活跃,30%的肿瘤细胞胞核中细胞增殖相关核抗原(Ki-67)蛋白呈棕色颗粒状阳性表达。EnVision ×200
患者术后行正电子发射体层摄影术(PET)-CT检查显示,右侧输尿管下段局部结构紊乱,伴氟代脱氧葡萄糖(FDG)代谢增高;左侧第3肋骨侧面FDG代谢增高灶,不除外肿瘤转移。复查盆腔CT显示,手术区肿瘤残留,包绕右侧输尿管下段,右侧输尿管上段轻度积水。予多柔比星+异环磷酰胺+达卡巴嗪(MAID)方案化疗4个疗程,化疗后复查PET-CT提示,右侧输尿管下段病变范围缩小,FDG代谢减低,左侧第3肋骨FDG代谢增高灶消失。
再次评估病情后,考虑患者对化疗敏感,病灶较前明显缩小,于2015年7月14日行二次手术,术中见:
右侧盆壁、直肠可见多发肿瘤病灶,灰红色、质糟脆,局灶侵犯直肠全层,右侧输尿管中下段被肿瘤灶包裹至膀胱。遂行盆腔肿瘤灶切除+直肠修补+输尿管部分切除+输尿管-膀胱吻合术,无明显肉眼残留病灶。
术后病理检查:
送检组织中可见梭形的肿瘤细胞,细胞异型性明显,伴有出血、坏死。免疫组化EnVision法检测显示,CD31、CD34、CK5/6、波形蛋白(vimentin)蛋白呈阳性,Ki-67蛋白呈80%(+),第Ⅷ因子相关抗原(FⅧ-Rag)、CK、钙视网膜蛋白(calretinin)、肾母细胞瘤蛋白1(WT-1)蛋白呈阴性。
结合临床病史,符合原发性卵巢血管肉瘤。患者术后恢复良好,继续按原方案化疗。定期对患者进行随访,二次手术后化疗3个疗程,复查盆腔CT提示肿瘤复发,已停止化疗,现术后11个月,带瘤生存,因属终末期,予保守性对症治疗。
二、讨论
1. 临床特点:
原发性卵巢血管肉瘤十分罕见,发病率为卵巢恶性肿瘤的1/100万,发病年龄为11~81岁,绝大多数为育龄期妇女,目前国内外文献报道仅35例[3]。原发性卵巢血管肉瘤的临床表现缺乏特异性,多表现为腹痛、腹部包块[4],有些表现为长期原因不明的胃肠道或泌尿系统症状。肿瘤标志物中,血清CA125水平增高,为49.2~189.1 kU/L,血清CA19-9、AFP、癌胚抗原(CEA)多为正常水平。
2. 诊断与鉴别诊断:
镜下观,原发性卵巢血管肉瘤的组织形态复杂多样,由不同程度异型性的内皮细胞构成,分化好时,可形成管腔,分化差时,仅可见单个细胞的腔隙,仔细观察可发现血管形成的微囊或腔隙。原发性卵巢血管肉瘤的诊断需结合常规病理检查结果及免疫组化法检测结果,特别是内皮细胞标志物(主要包括CD31、CD34、FⅧ-Rag、vimentin)阳性方能确诊。故在术中快速冰冻病理检查时,虽可以确定恶性肿瘤性质,但不能明确其具体病理类型。
原发性卵巢血管肉瘤需与良性血管增生、卵巢血管瘤、幼年性血管内皮瘤等良性病变相鉴别,此类病变免疫组化法检测血管内皮细胞标志物均阳性,但细胞缺乏异型性。同时,原发性卵巢血管肉瘤需与恶性黑色素瘤、平滑肌肉瘤等恶性肿瘤相鉴别,恶性黑色素瘤中S-100蛋白、抗黑色素瘤特异性抗体(HMB-45)、黑色素瘤分化抗原(MART-1)阳性;平滑肌肉瘤中desmin、α平滑肌肌动蛋白(SMA)、重型caldesmon等肌源性标志物呈阳性表达[2]。
3. 治疗及预后:
目前,对于原发性卵巢血管肉瘤患者临床上常用的治疗方式为手术联合术后辅助性化疗。目前,尚无标准的手术方式,根据不同的分期以及患者的生育要求,对要求保留生育功能的患者可行患侧附件切除+盆腔和腹主动脉旁淋巴清扫+大网膜切除术,对于无生育要求的患者可参考卵巢癌手术方式,行子宫全切除+双侧附件切除+盆腔和腹主动脉旁淋巴清扫+大网膜切除+阑尾切除术。文献报道,1例Ⅰa期原发性卵巢血管肉瘤患者行保留生育功能手术,术后予表柔比星+顺铂方案化疗6个月,随访5年余仍存活[1]。原发性卵巢血管肉瘤的常用化疗方案包括:MAID 方案[5],也有采用异环磷酰胺+多柔比星[6-10]、吉西他滨+顺铂[3]方案。文献报道,1例29岁原发性卵巢血管肉瘤患者接受保留生育功能手术,术后辅助化疗,28 d为1个化疗周期,以吉西他滨(第1天、第8天,1 000 mg/m2)+顺铂(第1天,70 mg/m2)方案化疗,共6个疗程,随访7年仍存活。另有文献报道,2例原发性卵巢血管肉瘤患者术后分别接受顺铂+异环磷酰胺、多柔比星+异环磷酰胺方案辅助性化疗联合放疗[11-12],其生存时间分别为9和12个月。原发性卵巢血管肉瘤的恶性程度高,转移快,患者预后差,生存时间为18 d~9年。有文献报道,1例术后复发、要求保留生育功能的原发性卵巢血管肉瘤患者,采用异环磷酰胺+多柔比星方案辅助化疗后最终成功妊娠,并顺利分娩一健康活婴[13]。
本例患者第1次手术因病灶侵犯右侧输尿管,范围较大,行姑息性手术。术后以MAID方案化疗4个疗程,残留灶较前明显缩小,即行二次手术,切除盆腔残留灶。二次手术满意,无肉眼残留病灶,术后继续按原方案化疗,密切随访。于术后7个月肿瘤复发,现术后11个月,已停止化疗,因属疾病终末期,予保守性对症治疗。
参考文献:略















共0条评论