[导读] 作者:黄慧(江西省儿童医院)
儿童纤维母细胞和肌纤维母细胞性肿瘤的临床病理学研究进展(二)
【摘要】纤维母细胞和肌纤维母细胞性肿瘤包括一组形态学多样和生物行为学不同的肿瘤,发病年龄广。发生于儿童的纤维母细胞和肌纤维母细胞性肿瘤有其独特的疾病。近10年来,分子生物学技术的发展和研究的最新进展导致儿童纤维母细胞和肌纤维母细胞性肿瘤的诊断发生了变化和更新。本文将综述最近的研究进展,以进一步确定这些肿瘤(婴儿纤维性错构瘤、肌纤维瘤、真皮肌纤维瘤、脂肪纤维瘤病、婴儿型纤维肉瘤及其类似肿瘤,如婴儿原始黏液样间叶性肿瘤)的临床病理学特征。除此之外,还将讨论需要与这些肿瘤鉴别的疾病(包括梭形细胞横纹肌肉瘤、隆突性皮肤纤维肉瘤和钙化性腱膜纤维瘤)。
一、婴儿纤维性错构瘤
组织形态学:肿瘤由三种成分(致密的纤维组织、原始间叶组织和成熟脂肪组织)组成(图1),呈器官样排列。Saab等人对60例婴儿纤维性错构瘤回顾性研究,发现大约一半的病例可见假血管瘤样结构。Al-Ibraheemi A等人对145例婴儿纤维性错构瘤进行复习,所有病例均显示三种组织学形态,但脂肪、纤维组织和原始间叶组织的比例变化较大。44例(30%)存在裂隙样透明带结构,类似巨细胞纤维母细胞瘤(5例通过FISH检测PDGFB基因均阴性)。除了典型的婴儿纤维性错构瘤形态,2例(1例为10个月女婴,因出现新的包块而就诊;1例为6岁男童,肿块位于腿部)还出现肉瘤样形态,表现为局灶细胞密度高、高级别细胞核及核分裂象增多。
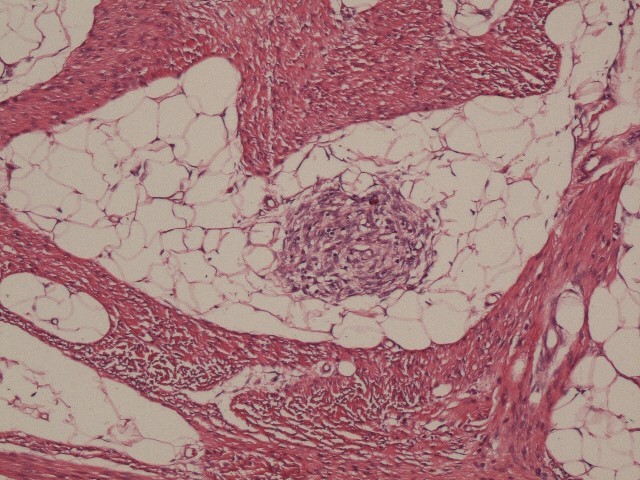
▲图1:婴儿纤维性错构瘤由纤维组织、原始间叶组织和脂肪组织组成。
免疫表型及分子遗传学:Park等人于2016年发表了一篇具有里程碑意义的文章,文中报道的12例婴儿纤维性错构瘤具有EGFR外显子20插入/复制突变,在这组病例中,免疫组化检测EGFR显示低至中等强度阳性,阳性部位主要为原始间叶组织。
二、肌纤维瘤/肌纤维瘤病
概述:肌纤维瘤/肌纤维瘤病是一种好发于婴幼儿的良性间叶性肿瘤,由Williams和Schrum于1951年首次报道,起初被命名为先天性纤维肉瘤。1954年Stout将其更名为幼年性纤维瘤病或先天性系统性纤维瘤病。1981年Chung和Enzinger的报道显示,该肿瘤属于一种肌纤维母细胞性病变,故又将其重新命名为婴儿肌纤维瘤病。因肿瘤偶可发生于成人,故在2002年版的WHO分类中,将“婴儿”一词去掉了。在形态学上,肌纤维瘤/肌纤维瘤病与肌周皮细胞瘤以及所谓的婴幼儿型血管外皮瘤有延续,因此2013版WHO分类将其划归为肌周皮细胞瘤名下。
组织形态学:肿瘤呈结节状生长,并具有明显的区带现象;由淡染的周边区和深染的中央区组成(图2)。周边区由结节状或短束状排列的胖梭形细胞组成,形态学上介于纤维母细胞和平滑肌细胞之间;中央区由圆形或小多边形原始间叶细胞组成,呈实性片状分布,或围绕分枝状的血管呈血管外皮瘤样排列。间质纤维可有黏液变、玻璃样变性。
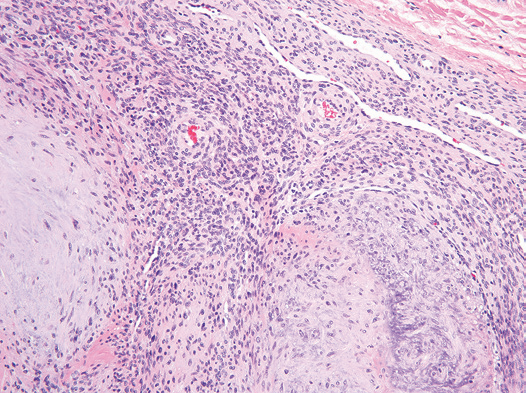
▲图2:肌纤维瘤呈结节状生长,由淡染区和深染区组成。
分子遗传学改变:2017年,Agaimy等人报道婴儿肌纤维瘤和成人肌纤维瘤均存在PDGFRB突变,而在血管平滑肌瘤和肌周皮细胞瘤中则无此突变。同年,Arts等人也报道不管是孤立性还是多中心性的肌纤维瘤存在PDGFRB突变,主要为外显子18、14、12和11突变。这些结果表明,对于重症疾病或许使用酪氨酸激酶抑制剂治疗有效。除此之外,还有NDRG4和NOTCH3基因突变的报道。Antonescu等人于2017年报道肌纤维瘤存在SRF-RELA和SRF-C3ORF762基因融合。
三、婴儿纤维瘤病/脂肪纤维瘤病
概述:脂肪纤维瘤病由Fetsch等人于2000年首次描述,在《Enzinger和Weiss软组织肿瘤》的旧版本中,类似的病变被称为“婴儿纤维瘤病”。第6版《Enzinger和Weiss软组织肿瘤》仍然存在“婴儿纤维瘤病”,但在其后面的括号中添加了脂肪纤维瘤病。不用说,许多疾病分类的不确定性似乎持续存在于这些病变中,“婴儿纤维瘤病”和“脂肪纤维瘤病”似乎有一定的重叠。
组织形态学:脂肪纤维瘤病是一种浸润性和边界不清的肿瘤。其形态变化反映了纤维母细胞成分的不同成熟度。在脂肪组织间可见穿插的条束状纤维结缔组织,脂肪小叶结构基本保存(图3)。部分病例细胞丰富,核分裂象增多,建议诊断为侵袭性婴儿纤维瘤病。
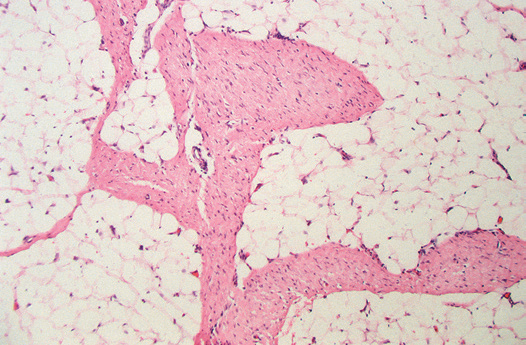
▲图3:脂肪纤维瘤病中可见条束状纤维结缔组织穿插在脂肪组织间。
四、脂肪纤维瘤病样神经肿瘤
概述:2016年,Agaram等介绍了一种与脂肪纤维瘤病相似的独特的软组织肿瘤。然而,该肿瘤表现出不同于脂肪纤维瘤病的表现:细胞核轻度非典型性、S100蛋白和CD34共表达和重现性神经营养酪氨酸激酶受体1(NTRK1)基因重排。基于这些形态学和免疫组化特征,他们建议用脂肪纤维瘤病样神经肿瘤(Lipofibromatosis-like neural tumour,LPF-NT)这个术语来定义这种特殊类型的间叶性肿瘤。
临床特征:2018年,LAO等对10例LPF-NT的临床病理学特征进行了归纳总结。10例患者中男性6例,女性4例;诊断年龄为2~37岁,平均年龄为12.8岁,中位年龄为7岁;所有病例均发生于浅表软组织,包括颈部3例,臀部2例,胸壁、胁腹、髋部、手和足各1例。最常见的表现为皮下肿块或结节,发现至就诊时间为2周~3年(中位时间为6月)。超声表现为皮下脂肪层内低回声或中等回声水平的肿块,肿块内部回声不均匀。CT及核磁共振成像(MRI)检查显示一局限性低密度卵圆形肿块,其脂肪成分含量多少不等。
病理学特征:2018年,LAO等对10例LPF-NT的临床病理学特征进行了归纳总结。大体上,切除的肿块最大直径从2.5cm到8cm不等(平均4.4cm,中位4.5cm)。切面灰粉红色或灰白色,质地均匀,质软或质韧。无出血或坏死区。组织形态学上,肿瘤主要位于皮下组织(图4A),7例肿瘤可见束状梭形细胞以类似于脂肪纤维瘤病的方式浸润皮下脂肪组织(图4B),部分区域可见蜂窝状浸润模式,类似隆突性皮肤纤维肉瘤(图4C),实性区域由密集的束状或紧密的梭形细胞组成,显示不同程度的脂肪浸润(图4D)。3例肿瘤中未见明显的脂肪纤维瘤病样或隆突性皮肤纤维肉瘤样结构,肿瘤主要由胶原纤维分割束状梭形细胞组成(图4E)。高倍镜下,梭形细胞呈轻至中度核异型,核仁不清,胞质淡染至稍嗜酸性(图4F)。8例肿瘤中核分裂象罕见(<1个/10HPF),2例核分裂象可见4个/10HPF(图4G)。除了梭形细胞成分,在一个原发肿瘤和一个复发肿瘤中分别可见散在的多形性多角形细胞(图4H)。本组所有肿瘤均未出现坏死或出血区域。3例复发肿瘤中除1例浸润骨骼肌外,其余均与原发肿瘤相似。
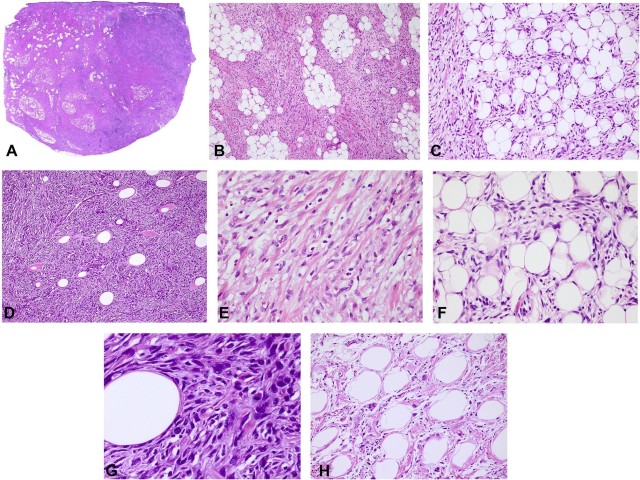
▲图4:脂肪纤维瘤病样神经肿瘤的组织形态学,肿瘤主要位于皮下组织(A),浸润皮下脂肪组织(B),部分区域可见蜂窝状浸润模式,类似隆突性皮肤纤维肉瘤(C),实性区域由密集的束状或紧密的梭形细胞组成,显示不同程度的脂肪浸润(D),部分病例主要由胶原纤维分割束状梭形细胞组成(E),梭形细胞呈轻至中度核异型(F),可见核分裂象(G)及散在的多形性多角形细胞(H)。
免疫组化和分子检测结果:2018年,LAO等对10例LPF-NT的临床病理学特征进行了归纳总结。肿瘤中的梭形细胞表达CD34和S100,1例原发和1例复发肿瘤的散在的多形性细胞也表达CD34和S100。4例肿瘤表达CD99。10例肿瘤均不表达SOX10、STAT6、SMA、calponin、h-caldesmon、desmin、myogenin、MyoD1、AE1/AE3、EMA、CD31和ERG。Ki-67增值指数约为5~10%。荧光原位杂交结果显示5例病例中有4例存在NTRK1基因重排。检测的病例中无ETV6基因(2例)和PDGFB基因重排(1例)。另有文献报道,LPF-NT表达pan-TRK(5/5)。
治疗和随访:2018年,LAO等对10例LPF-NT的临床病理学特征进行了归纳总结。10例患者均行外科手术治疗。10例病例中,1例临床最初考虑为血管畸形,用普萘洛尔、平阳霉素和博来霉素进行治疗,但肿块逐渐增大,治疗无效。迄今为止,临床随访资料显示3例局部复发。没有患者有区域或远处转移的证据。
五、EWSRI-SMAD3基因重排纤维母细胞性肿瘤
概述:EWSRI-SMAD3基因重排纤维母细胞性肿瘤(EWSRI-SMAD3-rearranged fibroblastic tumor,ESFT)是由Kao和Michal 等人于2018年报道的肢端浅表纤维母细胞性肿瘤。
临床特征:该肿瘤发病年龄广(1~68岁),2例发生于儿童(年龄分别为1岁和5岁)。未完全切除有局部复发的可能。
病理学特征:ESFT外观呈隆起性结节,累及真皮及皮下组织(图5A),显示分叶状或丛状外观、浸润性生长模式(图5B),瘤细胞为形态较一致的胖梭形细胞,呈束状排列(图5C),胞质中等丰富、嗜酸性(图5D)。透明样变是其特征性表现,与其他细胞成分混合,形成一个分带状结构。瘤细胞特征性表达ERG,不表达SMA、CD34(6/6)、CD31、SOX10(4/4)、Pan-TRK(1/1)、EMA和S100(6/6)。
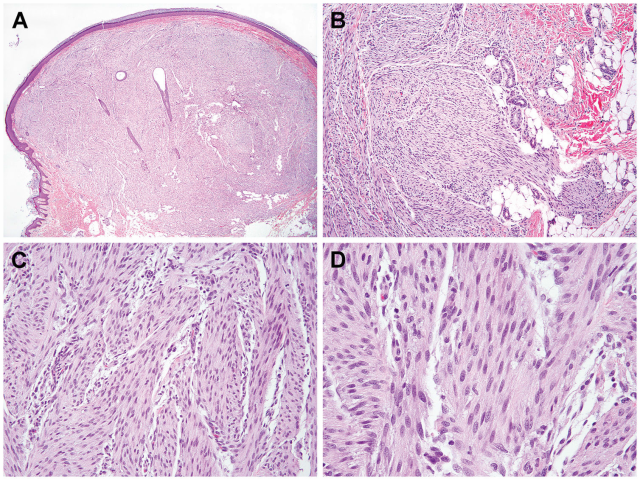
▲图5:ESFT外观呈隆起性结节,累及真皮及皮下组织(A),边界不清,呈浸润性生长模式(B),瘤细胞为形态较一致的胖梭形细胞,呈束状排列(C),胞质中等丰富、嗜酸性(D)。
【参考文献】
[1] Saab ST, et al. Fibrous hamartoma of infancy: a clinicopathologic analysis of 60 cases. 2014.
[2] Al-Ibraheemi A, et al. Fibrous hamartoma of infancy: a clinicopathologic study of 145 cases, including 2 with sarcomatous features.2017.
[3] Park JY, et al. EGFR Exon 20 Insertion/Duplication Mutations Characterize Fibrous Hamartoma of Infancy. 2016.
[4] Agaimy A, et al. Recurrent Somatic PDGFRB Mutations in Sporadic Infantile/ Solitary Adult Myofibromas But Not in Angioleiomyomas and Myopericytomas.2017.
[5] Arts FA, et al. PDGFRB gain-of-function mutations in sporadic infantile myofibromatosis. 2017.
[6] Antonescu CR, et al. Recurrent SRF-RELA Fusions Define a Novel Subset of Cellular Myofibroma/Myopericytoma: A Potential Diagnostic Pitfall With Sarcomas With Myogenic Differentiation. 2017.
[7]Agaram NP, et al. Recurrent NTRK1 Gene Fusions Define a Novel Subset of Locally Aggressive Lipofibromatosis-like Neural Tumors. 2016.
[8] LAO W, et al. Lipofibromatosis-like neural tumour: a clinicopathological study of ten additional cases of an emerging novel entity. 2018.
[9]Kao YC, et al. Novel EWSR1-SMAD3 Gene Fusions in a Group of Acral Fibroblastic Spindle Cell Neoplasms.2018.
[10] Michal M, et al. EWSR1-SMAD3-rearranged Fibroblastic Tumor: An Emerging Entity in an Increasingly More Complex Group of Fibroblastic/Myofibroblastic Neoplasms. 2018.
[11] Hung YP, et al.Evaluation of pan-TRK immunohistochemistry in infantile fibrosarcoma, lipofibromatosis-like neural tumour and histological mimics. 2018.


















共0条评论