[导读] 识病理,划未来!
文丨任斗 湖南省第二人民医院肿瘤科
来源丨医学界肿瘤频道
术后的病理报告决定着肿瘤患者下一步的治疗方案,因此判读病理报告是肿瘤内科医生的“基本功”和“份内事”。科学地规划未来,为患者打造一个量体裁衣的方案,让术后的患者不仅活得好,更要活得久,这既是患者的期盼,也是医生的职责。
那么,我们今天就来结合一个具体病理报告,谈谈如何在临床上“识病理,划未来”!
病理报告
45岁女性。改良根治术后标本,原发肿块2cm×1.5cm,浸润性导管癌3级,脉管内可见癌栓,淋巴结(前哨1/2,腋窝0/15)。免疫组化:雌激素受体(ER)60% 中-强(+),孕激素受体(PR)70% 强(+),人表皮生长因子受体2(HER2)(3+),ki67 20%。
01.准确术后病理分期包括St_Gallen分子分型是治疗的前提
从上述病理结果来看,患者肿块大小为2cm×1.5cm,腋窝淋巴结前哨1/2,清扫后0/15。根据美国癌症联合会(AJCC)第八版分期为pT1cpN1miM0,IB期,St_Gallen分型为HER2阳性(激素受体阳性)。
有了对病理报告的大体把握,接下来该做的事情就是判断患者的复发风险。我们都知道,术后辅助治疗的目的就是为了减少术后复发,尽可能的延长无病生存或者是无复发生存。那么,乳腺癌术后该如何判断复发风险的高低呢?
中国乳腺癌指南指出,乳腺癌的复发风险可以从以下方面来判断,具体见表1:
表1:乳腺癌术后复发风险分组
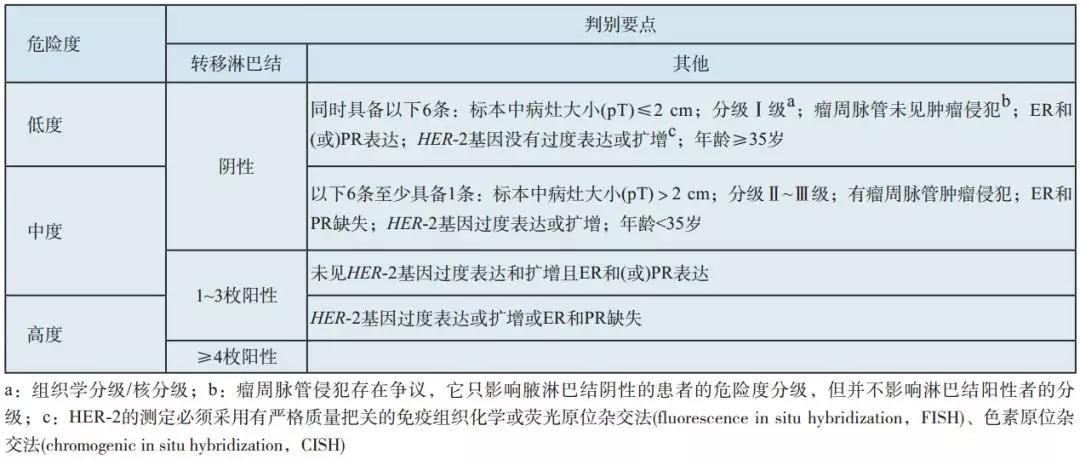
从表1可以看出,乳腺癌术后的复发风险由多个因素决定,但主要是看淋巴结的数目,如有4枚或以上,就是高度复发风险;不过即使只有1-3枚淋巴结转移,如果合并有HER2过表达,也是高危复发风险。
复发风险的高低决定着治疗的方式和强度。结合上述患者术后的病理,患者肿瘤大小虽然为T1,只有一枚前哨淋巴结转移,但是合并有脉管内癌栓及HER2过表达,所以存在着高危复发风险。这些都是我们在为患者制定术后辅助治疗方案时必须考虑的因素,也是治疗的出发点。
03.循证医学指导下的个体化治疗将为患者带来最大生存获益
制定指南的目的就是为了规范治疗,具体到这名患者,我们既然判断她为高危复发患者,那么结合指南和当前循证医学证据,该如何对她进行治疗呢?
1、化疗要不要做?如果要,用什么方案?
2、辅助靶向治疗要做吗?如果要,用什么药物,疗程是多久?
3、放疗要不要做?如果要,怎么设野?剂量多少?
4、内分泌治疗要不要做?如果要,做多久,用什么方案?
这四个问题都是值得思考的问题。
乳腺癌的术后辅助化疗,目前标准的方案是AC→T(阿霉素/表阿霉素+环磷酰胺序贯紫杉醇)的方案,如果是HER2阳性,还需要加上一年的曲妥珠单抗,也就是AC-TH(阿霉素/表阿霉素+环磷酰胺序贯紫杉醇/多西他赛+曲妥珠单抗)方案。
HERA研究表明,曲妥珠单抗辅助治疗一年,近80%患者获得10年以上长期生存,总生存率较对照组增加6.5%,降低死亡风险26%。当然,曲妥珠单抗并不是越久越好,一年是标准治疗,2年的疗效和一年相似,但是明显增加了经济负担和副反应。
NSABP B31/9831研究中AC-TH 组10年无病生存率为73.7%,10年生存率为84%,较AC-T降低死亡风险37%和复发风险40%,同样证明了HER2阳性乳腺癌在常规化疗的基础上加上曲妥珠单抗一年的靶向治疗带来了生存获益。
单靶向是如此好,那么双靶向治疗是不是好上加好呢?APHINITY研究就是一项双靶向术后辅助治疗的研究,比较了化疗+曲妥珠单抗+帕妥珠单抗对比化疗+曲妥珠单抗+安慰剂治疗。10年随访结果表明,双靶治疗并不一定全优于单靶向,只在淋巴结阳性的高危亚组以及激素受体阴性的高危亚组获益才更多。
值得注意的是我们在使用AC-TH的过程中,要注意观察药物的心脏毒性,特别是对于那些有基础心脏病的患者和老年患者,更要注意。该患者发病时只有45岁,基础心脏功能应该是可以耐受两者序贯使用的。基于此,该患者可以选择标准的AC-TH方案。
乳腺癌的术后辅助放疗能够使腋结阳性的患者5年局部复发率降低到原来的1/4-1/3。肿块较大,如T3以上;腋窝淋巴结转移较多,如4个以上,局部复发风险高,放疗无疑是必须的。如果淋巴结转移1-3枚,肿瘤T1-2,放疗的选择则要结合患者复发风险进行个体化选择。
就该患者而言,其为HER2阳性乳腺癌,合并有脉管内癌栓,相对年轻,肿瘤复发风险主要来自HER2驱动基因导致的全身进展,局部放疗的意义相对偏小些,所以放疗可以在抗HER2靶向治疗的基础上进行。至于靶区和剂量,参考指南和文献,单纯对于胸壁给予50GY的常规放疗即可,腋窝已经清扫,无需照射,更不必行锁骨上窝照射。
内分泌治疗是经济有效的治疗手段。对于激素受体阳性患者,术后辅助内分泌治疗是标准治疗手段之一。过去他莫昔芬5年是标准治疗,随着SOFT & TEXT等研究发表,那么我们不禁要问,5年够不够?要不要延长至10年?要不要加上卵巢功能抑制(OFS)呢?换句话说,究竟什么方案对于该患者是最好的呢?
细看中国指南关于绝经前术后辅助内分泌治疗的推荐,只有部分患者,才推荐加上OFS,具体标准是:
1、淋巴结4个及以上;
2、肿瘤的分级高,为2级或者3级;
3、病理分期T2及以上;
4、淋巴结1-3个阳性。
由此可以看出,并不是所有的患者都能从OFS中获益,也不是所有的患者都需要OFS。SOFT&TEXT的研究也表明,OFS联合治疗的获益人群更多为淋巴结阳性、细胞学分级为2-3级、肿瘤直径大于2-3cm者。
总体而言,复发风险越高的患者,就越有可能从卵巢功能抑制中获益,因此中国早期乳腺癌卵巢功能抑制临床运用专家共识了如下推荐:对绝经前激素受体阳性的早期乳腺癌中危和高危患者,推荐OFS联合芳香化酶抑制剂治疗,OFS联合他莫昔芬也是合理的选择;对于存在他莫昔芬禁忌证的任何风险级别患者,推荐OFS联合芳香化酶抑制剂治疗。因此,对于该患者而言,在辅助靶向治疗的同时,加上卵巢功能抑制行内分泌维持治疗5年也是必须的。
总之乳腺癌的治疗是一个围绕患者病理特征、临床实际和循证医学证据,在指南指导下的全生命周期的实践过程,让患者活动又好又久是临床医生的恒久目标!只有识得病理,方能赢得始终!
参考文献:
[1] 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2018.v1);
[2]中国抗癌协会乳腺癌诊治指南与规范(2017版);
[3]中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018版)。














共0条评论