选自:中华妇产科杂志2018 年12月第53 卷第12期
作者:沈小静 贺其志 娜依玛·巴亚西 王丽薇 王庆萍 朱慧庭
成熟畸胎瘤是卵巢常见的良性生殖细胞源性肿瘤,育龄期妇女好发,大体上多呈囊性,组织学上可见成熟的多胚层组织成分。卵巢成熟畸胎瘤的恶变率为0.46%~4.00%[1],多发生在45岁以后,其含有的各胚层组织均可继发恶变,但因其少见,临床上对其临床病理特点了解不多[2],术前诊断率极低。本研究回顾性分析了9例卵巢成熟畸胎瘤恶变患者的临床病理资料,以增加临床及病理医师对其的认识。
2010年1月—2018年6月同济大学附属第一妇婴保健院共收治卵巢成熟畸胎瘤3 511例,其中恶变患者9例,占0.26%(9/3 511)。
9例卵巢成熟畸胎瘤恶变患者的年龄为(50.0±14.8)岁(28~77岁)。9例患者均表现为盆腔包块,其中2例发现包块分别为6、10年,均因近期明显增大就诊;有腹痛、腹胀等腹部不适症状者3例,尿频、尿急等压迫症状者2例。
术前9例患者均行B超检查,其中6例提示卵巢畸胎瘤,其余提示卵巢或附件区囊肿,均未明确提示恶变。9例患者均接受血清学肿瘤标志物检测,3例血清CA125水平升高,4例血清CA199水平升高,2例血清癌胚抗原(CEA)水平升高,3例鳞癌患者检测血清鳞状细胞癌抗原(SCC-Ag)水平有2例升高。
9例患者均接受手术治疗,其中5例行肿瘤根治性手术,包括2例行子宫全切除+双侧附件切除+大网膜切除+阑尾切除+盆腔淋巴清扫术,2例行子宫全切除+双侧附件切除+大网膜切除+盆腔淋巴清扫术,1例行肿瘤细胞减灭术(范围包括子宫全切除+双侧附件切除+阑尾切除+大网膜切除+盆腔转移灶切除+盆腔粘连分解术),这5例患者术后予以铂类药物为基础的联合化疗,4~6个疗程不等;2例行单侧附件切除术;2例行患侧囊肿剥除术。
按照2014年国际妇产科联盟(FIGO)的卵巢上皮性癌(卵巢癌)分期标准进行手术病理分期,其中7例为Ⅰa期、1例为Ⅰc期(该例术中发生肿瘤破裂)、1例Ⅲc期(伴盆腹腔多处转移)。
9例患者术后均进行病理检查。(1)大体检查:肿瘤直径为6.0~14.0 cm,平均10.1 cm,恶变部分的肿瘤最大径为0.2~5.0 cm,平均3.0 cm,恶变部分的肿瘤所占比例为2%~50%。9例患者中,7例呈囊性,2例呈囊实性;5例肿瘤包膜完整光滑,4例与周围组织粘连,其中1例术中包膜破裂;9例均发生于单侧卵巢,其中左侧卵巢6例、右侧卵巢3 例;8 例见油脂及毛发,5 例见明显头结节,直径为0.8~4.0 cm。恶变的肿瘤区域与周围成熟畸胎瘤成分混杂,仅占囊肿壁部分区域,多数(6/9)情况下恶变成分大体表现明显,少数(3/9)情况下恶变成分范围小,大体表现不明显,需充分取材镜下确诊。恶变区域多表现为囊壁增厚,表面粗糙呈颗状、乳头状或结节状改变,切面多呈灰白色,部分呈灰黄色或灰黑色,质地软、中等或质硬。(2)镜下检查:9例患者均行术中快速冰冻病理检查,8例提示有卵巢成熟畸胎瘤伴恶变,其中6例明确恶变成分的病理类型。所有的手术标本病理切片均经重新复核,证实为卵巢成熟畸胎瘤恶变,9例镜下均可见分化成熟的多胚层成分,以皮肤及其附属腺、脂肪组织常见,另可见软骨、各种腺体或腺上皮、神经及甲状腺组织。9例恶变患者中,恶变成分为鳞癌6例,恶变成分所占比例为15%~50%,组织学改变与其他部位鳞癌相似,病理分化程度以中~低分化为主,其成熟畸胎瘤均可见分化成熟的多胚层成分,可见鳞癌与正常鳞状上皮的移行区。恶变成分为类癌2例,其中1例为梁状型类癌,其恶变成分所占比例为2%,直径1.8 cm的头结节镜下观察为成熟畸胎瘤外胚层成分,周围囊壁中肿瘤细胞排列成细长的缎带样和梁状结构,可见纤维间质间隔;1例为甲状腺肿性类癌,其恶变成分所占比例为40%,直径0.8 cm的头结节镜下观察为成熟畸胎瘤外胚层成分,周围囊壁甲状腺肿成分与类癌混合生长,两者界限不清。恶变成分为恶性黑色素瘤1 例,其恶变成分所占比例为20%,直径4.0 cm的头结节镜下观察为成熟畸胎瘤外胚层成分,恶变成分与成熟畸胎瘤外胚层皮肤组织成分相间,周围囊壁见成熟脑组织及甲状腺组织,恶变成分与其相邻,肿瘤组织中仅见少量色素,上皮样肿瘤细胞密集成片,胞质丰富,核大深染,核仁明显,核分裂象易见。(3)免疫表型:6例鳞癌患者表达高分子上皮角蛋白p63、高分子细胞角蛋白(CK34βE12),5例p16蛋白呈斑片状阳性,3例p53基因有错义突变;2例类癌患者表达嗜铬素A(CgA)、突触素(Syn)等神经内分泌标志物;1 例恶性黑色素瘤表达抗黑色素瘤特异性抗体(HMB-45)、S-100蛋白。见图1~6。
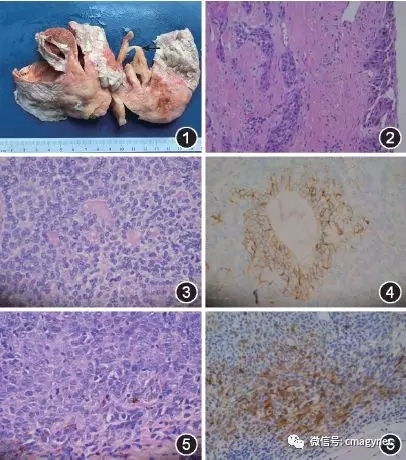
图1 卵巢成熟畸胎瘤恶变为鳞癌的大体标本,肿瘤区囊壁增厚,切面呈灰白色、质中
图2 镜下观鳞癌组织,其表层鳞状上皮癌变,间质内见浸润。HE ×200
图3镜下观甲状腺肿性类癌组织,肿瘤细胞形态一致,核圆而规则,染色质细腻,核分裂象少。HE ×400
图4 免疫组化法检测类癌组织,CD56呈棕黄色阳性表达。EnVision二步法×400
图5 镜下观恶性黑色素瘤组织,肿瘤细胞密集成片,上皮样,胞质丰富,核大深染,核仁明显,核分裂象易见,局灶见色素。HE ×400
图6 免疫组化法检测
恶性黑色素瘤组织,抗黑色素瘤特异性抗体(HMB-45)呈棕黄色阳性表达。EnVision二步法×200
9例患者术后随访2~47个月,中位随访时间18.6个月,5例失访,其余4例患者随访期内均无肿瘤复发,该4例患者的手术病理分期均为Ⅰa期。
二、讨 论
卵巢成熟畸胎瘤约占卵巢肿瘤的一半,80%以上发生在育龄期妇女,平均年龄为32岁,肿瘤平均直径为7 cm[3]。卵巢成熟畸胎瘤的恶变甚为罕见,术前临床诊断率极低。本研究中,卵巢成熟畸胎瘤的恶变率为0.26%,与文献报道的结果相似。卵巢成熟畸胎瘤恶变来源于肿瘤的体细胞,与未成熟畸胎瘤有着本质区别,后者来源于卵巢生殖细胞。
1. 卵巢成熟畸胎瘤恶变的临床特征:研究报道,卵巢成熟畸胎瘤恶变一般发生在45岁以后,且肿瘤直径>10 cm。本研究中,9例恶变患者的年龄为(50.0±14.8)岁,肿瘤平均直径为10.1 cm。
卵巢成熟畸胎瘤恶变患者的早期症状无特异性,常因无意中发现盆腔包块就诊,部分患者以轻度腹痛、肿瘤体积较大时的腹胀压迫症状为首发症状或肿瘤破裂导致急腹症等就诊。卵巢成熟畸胎瘤恶变的发病机制尚不明确,因大多数发生于绝经后妇女而有学者认为与成熟畸胎瘤的长期存在有关[4]。本研究中,9 例恶变患者中有2 例发现包块的时间较长(分别为6、10年),因近期明显增大就诊。因此,建议查体发现的尤其是绝经后妇女的卵巢畸胎瘤,应尽早手术治疗;对于有卵巢成熟畸胎瘤病史的患者,应警惕恶变的可能性[5]。卵巢成熟畸胎瘤恶变在术前常难以确诊。研究认为,血清SCC-Ag水平升高(>2.5 μg/L)有助于术前判断有无恶变[2]。也有研究指出,血清CA125和CEA水平可升高,但特异度不高[6]。当患者年龄>45 岁(尤其绝经后)、肿瘤直径>10 cm时,需高度警惕卵巢成熟畸胎瘤恶变的可能;术前检测血清SCC-Ag、CA125、CA199、CEA等肿瘤标志物有助于明确诊断,并可用于治疗后的病情监测。本研究中,9例恶变患者均行血清学肿瘤标志物检测,3例血清CA125水平升高,4 例血清CA199水平升高,2例血清CEA水平升高,3例鳞癌变患者检测血清SCC-Ag水平有2例升高。文献报道,恶性卵巢畸胎瘤超声检查尽管有一定的特征性,但总体诊断率低,易误诊,需结合患者的年龄及血清肿瘤标志物检测结果等综合考虑[7-8]。本研究中,9例恶变患者术前均行B超检查,其中6例提示卵巢畸胎瘤,其余提示卵巢或附件区囊肿,均无明确提示恶变。由于术前影像学检查及血清学肿瘤标志物检测对良、恶性畸胎瘤的鉴别诊断帮助不大,因此,本院对于卵巢畸胎瘤术前良、恶性不明确者,常规行术中快速冰冻检查,术中明确病变性质,以协助临床处理,本研究的9例患者术中均行快速冰冻病理检查。
2. 卵巢成熟畸胎瘤恶变的病理诊断:卵巢成熟畸胎瘤各胚层组织均可继发恶变,外胚层的上皮成分恶变较多,恶变为鳞癌最为常见,占75%~85%[9-10],其次为腺癌,罕见有类癌、甲状腺乳头状癌、恶性黑色素瘤和基底细胞癌等类型,也可见混合性肿瘤成分[11]。本研究中,9例卵巢成熟畸胎瘤恶变患者中,有6例恶变为鳞癌。有研究认为,p53通路改变可能与鳞癌变的发生相关[12],而本研究的6例鳞癌患者中有3例免疫组化染色显示p53基因错义突变,推测,p53基因突变可能与卵巢鳞癌的发生相关,其具体机制尚待进一步研究。有学者指出,高危型HPV感染可能与卵巢畸胎瘤鳞癌变的发生相关[13],该结论尚存争议;也有研究提示,HPV感染与鳞癌变无明显相关性[14]。本研究中,6例鳞癌变患者均无HPV感染,其中5例p16呈斑片状阳性,1例阴性,故目前无法提示两者存在相关性;另有2例类癌,1例恶性黑色素瘤,与文献报道的结果相近。以上恶变成分的组织学表现与转移性肿瘤相似,因此,均需结合病史与转移性肿瘤相鉴别。
3. 卵巢成熟畸胎瘤恶变的治疗及预后:卵巢成熟畸胎瘤的恶变临床上少见,尚无成熟的治疗方案,治疗标准不统一,基本原则为手术治疗辅以化疗或放疗。卵巢成熟畸胎瘤恶变患者多数手术病理分期为Ⅰa期,经临床综合治疗后Ⅰ期患者预后好,术后随访生存率较高。全面的分期手术和满意的肿瘤细胞减灭术对改善患者的预后至关重要,手术原则是完整切除肿瘤并最大限度地避免术中肿瘤破裂。
关于卵巢成熟畸胎瘤鳞癌变的研究较多,基本原则为在满意的肿瘤细胞减灭术的基础上,采用以铂类药物为基础的联合化疗,或同时联合体外放疗。卵巢原发性类癌的发生率极低,几乎均为临床Ⅰ期,预后极好,对于那些需要保留生育功能的年轻患者,可行单侧附件切除术,术后密切随访;对于无需保留生育功能的老年患者可行双侧附件及子宫切除术并辅以化疗。卵巢恶性黑色素瘤的手术治疗方式为单侧附件切除术或子宫全切除+双侧附件切除+盆腔病灶清除术,化疗以顺铂为主,对改善患者预后有一定帮助。近年来,少数卵巢畸胎瘤恶变为恶性黑色素瘤的患者也接受了免疫治疗,但其长期疗效还有待观察[15],卵巢恶性黑色素瘤患者的预后要差于相同手术病理分期的卵巢癌患者。
综上所述,卵巢成熟畸胎瘤恶变的发生率低,多为中老年患者,肿瘤常单侧发生,体积较大,多呈囊性,包膜多完整,恶变成分以鳞癌常见。治疗以手术治疗为主,术后辅以化疗,Ⅰ期患者预后较好。由于卵巢成熟畸胎瘤恶变成分一般较少,局部组织活检一般难以发现病灶,本研究中恶变肿瘤的平均直径为3.0 cm,且文献报道恶变成分的术中快速冰冻检查的检出率不高,因此,仔细、全面剖检标本,选取其中囊壁增厚区、实性区进行多点取材有助于提高检出率,必要时行免疫组化及分子检测,以防漏诊其中的恶性成分。














共0条评论