[导读] 肿瘤发生的一个全新理论——肿瘤发生二元论
编者按:2018年12月11-15日,第二届国际肿瘤干细胞会议(CSC)在奥地利小镇塞费尔德顺利举行。来自奥地利、比利时、德国、中国、美国等国的肿瘤干细胞研究领域的专家、学者参会,分享并讨论肿瘤干细胞基础研究和临床应用领域的最新进展。会上,美国著名华裔病理学家M.D.Anderson癌症研究中心刘劲松教授做了主旨演讲,分享了他团队的最新研究成果,即关于肿瘤发生的一个全新理论——肿瘤发生二元论。本刊记者在前方特邀刘教授进行了深度访谈,为我们揭开肿瘤发生的奥秘。
《肿瘤瞭望》:作为本次CSC会议开场的主旨演讲嘉宾,您给大家带来了肿瘤干细胞领域非常重要的、全新的研究发现,请您给广大读者再介绍一下这项重磅研究成果?
刘教授:这次会议分享了我们最新的研究成果,提出了肿瘤发生的一个全新理论:肿瘤发生二元论[1](图1)。第一条途径是从有性生殖的胚胎干细胞开始。人从受精卵发育而来,而受精卵通过卵裂(cleavage division)启动生命发育的第一步。 这是一个非常奇妙的过程,在该过程中细胞的核分裂,細胞的數目越來越多,但体积却越來越小,核浆比逐渐增高,细胞排列非常紧密,形态学上呈巨细胞状,细胞致密化形成桑葚胚(morula),继而产生囊胚(blastocyst)—包括滋养层细胞(trophoblasts)和胚细胞/内细胞团(embryoblasts/inner cell mass),随后种植在子宫中,胚胎在子宫内发育形成各种器官,最终发育成一个新生命。

图1.肿瘤发生的二元途径,有性生殖(左)和无性生殖(右)途径。不同分化阶段的成熟受阻(红×)导致形成各种不同恶性潜能的肿瘤。
然而在胚胎及其器官发育的过程中,任何一个胚胎发育的干细胞成熟受阻,将导致该细胞停留在受阻的特定发育阶段,产生不同的肿瘤,比如儿童比较常见的白血病,肉瘤,非成熟性畸胎瘤等。该途径在上世纪六十年代已被病理学家Dr.Barry Pierce描述过,可称之谓经典途径。但后来大家都转向肿瘤分子生物学研究,该途径在当今肿瘤生物学研究中已很少有提及。
此次我提出的肿瘤发生理论除了经典途径之外,还包括另一条我们研究小组发现的新途径。该途径由成熟体细胞通过无性繁殖形成多倍体细胞获得类似胚胎干细胞的潜能[2-6],涉及了大约50%的人类癌症的发生。相信大家都记得2012年诺贝尔奖授予了成熟体细胞去分化至胚胎干细胞的研究者。从去分化的角度,众所周知是通过四个转录因子的调控,将体细胞诱导为全能干细胞(iPSCs),或者是将成熟细胞的核移植到卵子中也可以产生生命(克隆)。去分化(dedifferentiation)这一概念也是一个经典的肿瘤病理学名词,也可称间变(anaplasia),但是去分化的细胞发育机制与肿瘤发生的关系一直未被搞清。
那么成熟的体细胞又是如何去分化而获得恶性生长潜能呢?基于课题组最近八年的工作,我们已经发表了一系列文章证明多倍体肿瘤巨细胞/Polyploid giant cancer cells (PGCCs,图2 ),作为一个特殊的亚群,有卵裂球样癌症干细胞的特性。我们发现细胞在环境压力的情况下,有丝分裂和细胞质分裂(cytokinesis)被关闭,细胞的生长是通过核内再复制(endoreduplication) 的过程完成。内复制即细胞通过内周期(endocycle)细胞核DNA一直复制,核变大,随后部分细胞进入内分裂(endomitosis),以一种大爆炸的分裂 (big bang)方式进行复制。 这是个类似于正常发育的卵裂过程,使得本来已成熟的体细胞获得干性潜能,重新具备了向不同方向分化的能力[4-6]。 我们的实验结果证实了PGCCs可以分化为肿瘤间质的成纤维细胞, 血管内皮细胞及红细胞,中性粒细胞等等[7-10]。所以PGCCs并非传统意义上的肿瘤干细胞,并且是可在显微镜下观察到的。 由此,我们的理论可以很好地解释肿瘤组织器官样生长,也是我们病理学上的肿瘤形态和显微镜下观察所见,如三阴性乳腺癌,高级别的卵巢癌, 高级别肉瘤等肿瘤组织都可以看到PGCCs,并且也可以解释这些不同类型肿瘤发生的过程。
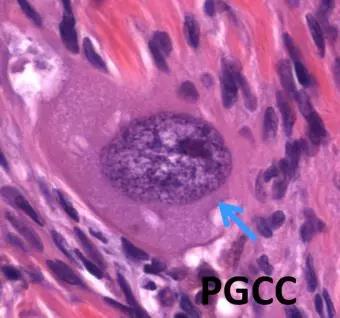
图2. 卵巢组织中正常纤维细胞可以通过内复制产生单核瘤巨细胞继而形成肿瘤。图示单核瘤巨细胞(PGCC)。
《肿瘤瞭望》:我们可以认为肿瘤的发生,从某种意义上来说是模拟早期胚胎发育的过程吗?
刘教授:是的。传统观点认为肿瘤是一个长得大小及快慢的问题,是促癌基因,抑癌基因突变的后果。 所以既往和现有的研究都致力于通过抑制或干扰不同的靶基因来实现治疗的目的。 但众所众知, 基于这个理念的关于治疗的研究耗费了大量的人力财力资源却收效甚微。实际上肿瘤是一个“器官”, 以畸胎瘤为例,这一类型的肿瘤具有三个胚层,和人发育生长的起始阶段是非常的相似的(图3)。 如果仅仅从细胞生长的数量和速度的角度, 是不能解释这一类肿瘤的发生或发展的。 从生物学角度来说, 新生命的产生包括有性生殖和无性生殖,前者是通过精子和卵子的结合形成受精卵,其需要通过卵裂去甲基化把父母的印记去除,重新甲基化后产生新的个体。我们认为卵裂阶段可以产生染色体的不稳定性,同样也能够形成生命的多样性。 不稳定性正是正常生命多样化的体现。 当这样的细胞团种植到子宫,程序可以重新正常化,产生正常的分化;其发生和发展模拟了胚胎发育的过程。但如果正常分化过程受阻, 发育中细胞将会停留在该阶段产生相应分化水平的肿瘤, 这就是两元模型中的经典通路。
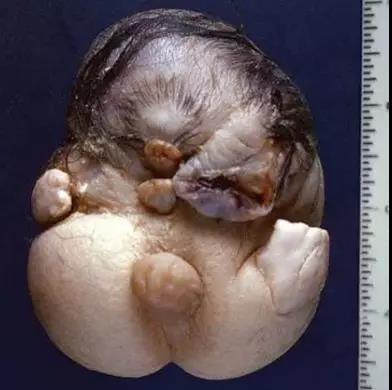
图3. 畸胎瘤(小人)。形似畸形的胎儿,强烈提示肿瘤来源于异常的胚胎发育,而不是细胞自主异常增生所致。该图引自Crum, Nucci, and Lee. Diagnostic Gynecologic and Obstetric pathology, 2nd edition, 2010.
对于发育完全成熟的体细胞,在外界压力下,包括缺氧、炎症、 饥饿、放疗化疗等各种不利因素刺激下,会发生返祖现象。 细胞核增大,但是细胞不分裂,核浆比增加,导致细胞体积增大的过程中出现多个细胞核的情况。在受到环境不利因素的打击下,则会形成一个类似卵裂球样的结构,即PGCC。这是类似无性生殖的过程, 然而这个过程中并未像正常有性生殖中经历种植这个程序,所以缺乏发育正常化的过程,于是会“发育”成各种恶性潜能的“器官”,即肿瘤。病理学家在肿瘤组织中经常能观察到这样的细胞,通常情况下,大家会习惯性认为这些细胞是一群快要死亡的,退变老化的,不能进行有丝分裂进而认为其是没有生命力的细胞。 但并未探究其来源、产生的机制以及功能。 而我们的研究正是以这样一群细胞为切入点,确定这其实是部分肿瘤发生的一个非常必要的过程,即细胞逆向分化回到生命早期发育的不同阶段,其机理类似于胚胎发育最早期的卵裂阶段[3,6](图4)。

图4. 扫描电镜下,可见PGCC的形成过程与人类受精卵早期发育(卵裂)过程酷似。其中受精卵早期发育图片来自网络。
《肿瘤瞭望》:您提到这一现象在老年性肿瘤组织中多有发现, 那肿瘤多倍体细胞存在性别上的差异吗?有些男性的体细胞随着衰老,以及肿瘤的发生,会发生Y染色体丢失的情况,这个在您发现的多倍体瘤巨细胞里也存在吗?还有就是肿瘤多倍体瘤巨细胞端粒酶的活性以及端粒的长度会改变吗?
刘教授:这几个问题非常好。性别差异我们没有研究,推测应该是没有差异或者比较小。是否发生Y染色体的丢失,是个有趣的问题,目前我们还没有做这方面的工作。至于PGCC中端粒的变化情况,正在研究之中,已有初步结果 ,相信很快会就和大家交流。
《肿瘤瞭望》:谢谢刘教授的解惑,觉得您的发现非常有意义,在多种组学 (omics) 盛行的当下,能够回归本源,通过观察所见推及功能,有种大道至简的亲切感!当时看您的PPT,就不仅仅是印象深刻了!感觉每张课件都是非常用心的准备,提炼和推敲的!令人钦佩!作为病理学家,您最初是怎么锁定瘤巨细胞这个研究目标的呢?
刘教授:这可能与我的教育经历有关。我是分子生物学出身,完成五年病理医生培训之后,在M. D. Anderson癌症中心的病理系诊断组做了二十年的肿瘤病理医生。我的早期的研究工作是研究肿瘤基因和抑癌基因共同作用把正常细胞转化为肿瘤细胞, 也得到了很好的一些结果。但总是感觉现代的组学与肿瘤的形态学对不上,内心一直有所存疑。而PGCCs是我们科研工作中“无心插柳”的偶然意外发现。当初我实验室里的张诗武博士给肿瘤细胞缺氧刺激后,意外的得到了PGCCs。 我们在日常诊断工作中经常能见到这种细胞,职业与科研的敏感性使得我们没有忽略这个实验的副产品,意识到其可能在肿瘤的形成过程中起重要作用。就此着迷开始研究并一发不可收拾。随后我实验室的牛娜博士发现PGCCs具有类似胚胎早期发育的卵裂球的功能。由此使得肿瘤发生与早期胚胎发育联系起来, 由此产生了一个全新的肿瘤学起源的概念。
《肿瘤瞭望》:谢谢您如此耐心地分享您的经历和体会,让我想起加拿大病理学家威廉斯勒说过的:和病人说话,病人的语言就解释了诊断。您作为病理学家,就是在显微镜下寻找最直接的证据,解释这样一个重要却被忽视的细胞发育生物学和病理学现象!
刘教授:是的。研究PGCCs之后,发现细胞经过PGCCs转换之后出来的是全新的肿瘤组织结构, 自此我们的研究可以与真正的肿瘤形态学联系起来,显微镜下可以看得见,对肿瘤的研究再也不局限于各种各样抽象的信号通路了。从遗传学上来说,正常组织的表型和基因型的联系很普遍并且是必须的,但在肿瘤研究中,表型研究(病理学)与基因型(分子生物学)研究始终处于彼此孤立的世界,鲜有研究者将这两个完全不同的维度统一于肿瘤研究之中。我个人认为,肿瘤二元理论对于肿瘤的发生、发展、复发、转移、治疗和预防将提供一个颠覆性的全新的指导理念和思路。
《肿瘤瞭望》:非常感谢!您提出的肿瘤二元理论,在肿瘤的靶向治疗这一块有怎样的启示和应用?
刘教授:针对治疗而言如果可以把起源问题弄清楚,则治疗方案上定会有突破。 比如长期以来,大家忽略了发育过程中的卵裂,囊胚等机制,肿瘤学研究领域一直所倡导的靶向肿瘤干细胞往往停留在依靠肿瘤干细胞的表面标记物上和分子通路, 然而表面标记物缺乏特异性,并且也不稳定(moving targets),无法去实时准确分离和纯化出这样一群细胞。但是如果去找PGCCs, 形态学上既提供了准确且直观的追踪可能性,进而将变换的靶标实时把控,进而阻断这个过程的形成;另外因为具有干性,则可寻找有效诱导分化的手段;而且这种细胞是免疫赦免的,因此也提供了研发抗肿瘤疫苗的可能。
《肿瘤瞭望》:谢谢您,希望不久的将来能听到您更多的令人振奋的研究成果。
刘教授:谢谢,很高兴和大家分享。希望我们的工作是抛砖引玉, 能让大家从完全不同的角度重新思考和认识肿瘤!
参考文献:
1. Liu J. The dualistic origin of human tumors. Semin Cancer Biol. 2018 Dec;53:1-16.
2. Chen J, Niu N, Zhang J, Qi L, Shen W, Donkena KV, Feng Z, Liu J.Polyploid Giant Cancer Cells (PGCCs): The Evil Roots of Cancer. Curr Cancer Drug Targets. 2018 Jul
3. Niu N, Mercado-Uribe I, and Liu J.Dedifferentiation into blastomere-like cancer stem cells via formation of polyploid giant cancer cells. Oncogene,;36(34):4887-4900, Aug 24, 2017
4. Niu N, Zhang J, Zhang N, Mercado-Uribe I,Tao F, Han ZB, Pathak S, Multani AS, Kuang J, Yao J, Bast RC, Sood AK, Hung MC, and Liu J. Linking Genomic Reorganization to Tumor Initiation via the Giant Cell Cycle. Oncogenesis, 2016 Dec19;5(12):e281. doi: 10.1038/oncsis. 2016.75.
5. ZhangS, Mercado-Uribe I, Sood AK, Bast RC, and Liu J. Coevolution of neoplastic epithelial cells and multilineage stroma via polyploid giant cells during immortalization and transformation of mullerian epithelial cells. Genes and Cancer 7(3-4):60-72, 2016 (cover story)
6. Zhang S, Mercado-Uribe I, Xing Z, Sun BC,Kuang J, and Liu J. Generation of cancer stem-like cells through formation of polyploid giant cancer cells. Oncogene 33(1):116-28; 2014
7. Zhang S, Mercado-Uribe I, and Liu J. Tumor stroma and differentiated cancer cells can be originated directly from polyploid giant cancer cells Induced by paclitaxel. Int J Cancer 134 (3):508-18,2014
8. Zhang S, Mercado-Uribe I, Hanash S, Liu J.iTRAQ-based proteomic analysis of polyploid giant cancer cells and budding progeny cells reveals several distinct pathways for ovarian cancer development. PLoS One, 8 (11) (2013)
9. Zhang S, Mercado-Uribe I, Liu J. Tumor stroma and differentiated cancer cells can be originated directly from polyploid giant cancer cells induced by paclitaxel. Int. J. Cancer, 134 (3)
(2014), pp. 508-518
10. Zhang S, Mercado-Uribe I, and Liu J. Generation of erythroid cells from fibroblasts and cancer cells in vitro and in vivo. Cancer Letters 333(2):205-12, 2013
专家简介

2013-2014年全美华人病理学会(CAPA)主席,M.D. Anderson癌症中心病理系教授病理终身教授,是中国教育部早期通过中美生物化学联合招生项目考试(CUSBEA)向海外派遣的留学生之一。1983年毕业于上海医科大学,在美国印第安纳大学获得硕士学位;凯斯西储大学获得博士学位;密歇根大学接受博士后培训;纽约大学医学院完成了病理住院医生和外科病理专科培训,并获得美国解剖病理学委员证书。1999年为助理教授,2004年终身副教授,2009年终身教授。
刘教授是在国际享有声誉的诊断病理学家及实验病理学家,世界知名M. D. Anderson癌症中心的诊断小组的专家。刘教授的主要临床工作是为病人提供准确的病理诊断,专注于的妇科肿瘤诊断。此外,他还指导了数百名专科病理医生的培训,指导研究生、博士后、访问学者的课题研究。
刘教授的研究重点是炎症、肿瘤微环境、上皮卵巢癌肿瘤发生机制和预后指标。最近他的研究小组在世界上第一次证明多倍体肿瘤巨细胞具有卵裂球样癌症干细胞的特性,提出的体细胞去分化后返组的癌细胞生长发育全新癌症发病机理,为癌症起源,复发,预防和治疗提出了一套崭新的理论。刘教授已发表236篇研究论著、25篇综述、116篇会议摘要,参编了5部专著。刘教授的文章被引用1万4千多次,H指数达67。他自2005年起共同主办安德森癌症中心-中国姐妹医院病理学研讨会。2016年全美华人病理学会杰出病理学家奖;2018中国医师协会妇产科分会妇产科好医生第七届林巧稚杯获得者,首位华人病理医生获得此殊荣。
文章来源:《肿瘤瞭望》


















共0条评论