肺癌临床诊疗指南(2018版)
本文来源:肿瘤研究与临床, 2018,30(12) : 793-824.
1 概述
原发性支气管肺癌简称肺癌,起源于支气管黏膜上皮及肺泡,是我国及世界范围内发病率和死亡率最高的恶性肿瘤之一,严重危害人类健康。在我国,随着工业化、城市化的进展所致的空气污染以及吸烟率的居高不下,肺癌的发病率和死亡率仍呈明显上升趋势。据我国国家癌症中心统计,2014年我国肺癌发病率和死亡率均居首位,其中新发病例约78.1万,死亡病例约62.6万;男性高于女性,城市高于农村;发病率和死亡率亦存在区域差异,由高到低依次为东部、中部和西部。早期肺癌多无明显症状,多数患者确诊时已属晚期,致肺癌整体5年生存率仅为16 %左右。因此,在减少危险因素、发现高危人群、进行高危人群早期筛查、早期诊断以及对晚期肺癌进行除了病理检测以外的基因和分子分型的精准诊断和治疗等方面,制定诊疗指南是当务之急。
近年来,肺癌的诊断和治疗进展迅速。对于早期肺癌,人们日益追求精细且创伤性更小的手术方式;对于晚期肺癌,靶向治疗深入人心,免疫治疗的出现给野生型肺癌患者带来了新的希望,肺癌患者的治疗选择较前显著增多。为进一步提高我国肺癌的诊疗水平、改善患者的预后、给各级临床医师提供专业的循证医学意见,中华医学会组织全国的专家,整合近年来肺癌病理、基因检测、免疫分子标志物检测、新治疗手段等最新研究成果,并结合中国的国情,制定了此中国肺癌诊疗指南。循证医学和精准医学是制定此指南的基本原则。目前国际指南是基于当前国际上最新的研究结果和证据。中国是一个发展中国家,必须考虑到药物和治疗措施的可及性。欧美国家已批准上市的药物在我国可能一段时间内尚不可及,我国不同区域因发展的不平衡,在治疗的选择上存在差异,因此,结合国际指南和我国的国情,本专家组制定了中国肺癌临床诊疗指南。根据循证医学级别进行了分类推荐,共分4个级别:1类推荐证据级别最高,为专家组一致推荐;2A类推荐证据级别稍低,为专家组一致推荐;2B类推荐证据级别低,为部分专家推荐;3类推荐证据为专家分歧较大。此指南旨在针对专业的各级临床医师提供循证的、指导性意见。
2 肺癌的筛查
2.1 高危人群的选择
年龄55~74岁,吸烟量30包年(如已戒烟,戒烟时间不超过15年)的个体推荐参加低剂量CT(low-dose computed tomography,LDCT)肺癌筛查。如果具有以下某些肺癌高危因素也可作为筛查的条件,包括:氡暴露、职业致癌物质暴露(如石棉、辐射、二氧化硅等)、个人肿瘤史、直系亲属肺癌家族史、肺部疾病史(如慢性阻塞性肺病或肺纤维化)、有长期二手烟接触史、长期油烟吸入史等(图1),不能耐受可能的肺癌切除手术或有严重影响生命的疾病个体不建议进行LDCT筛查。

▲图1 肺癌筛查的人群选择
2.2 筛查频率
建议筛查的间隔时间为1年,间隔时间超过2年的筛查模式并不推荐。年度筛查正常者,建议每1~2年继续筛查。
2.3 筛查的管理
目前建议直径≥5 mm的结节需接受进一步检查。阳性结节的定义如下,(1)基线筛查:直径≥5 mm的非钙化结节或包块,或发现气管和(或)支气管可疑病变定义为阳性。(2)年度筛查:发现新的非钙化结节、包块或呼吸道病变,或原有结节增大或实性成分增加,则定义为阳性。
2.4 结节的临床管理步骤
基线筛查出的结节管理流程见图2,年度筛查结节管理流程见图3。
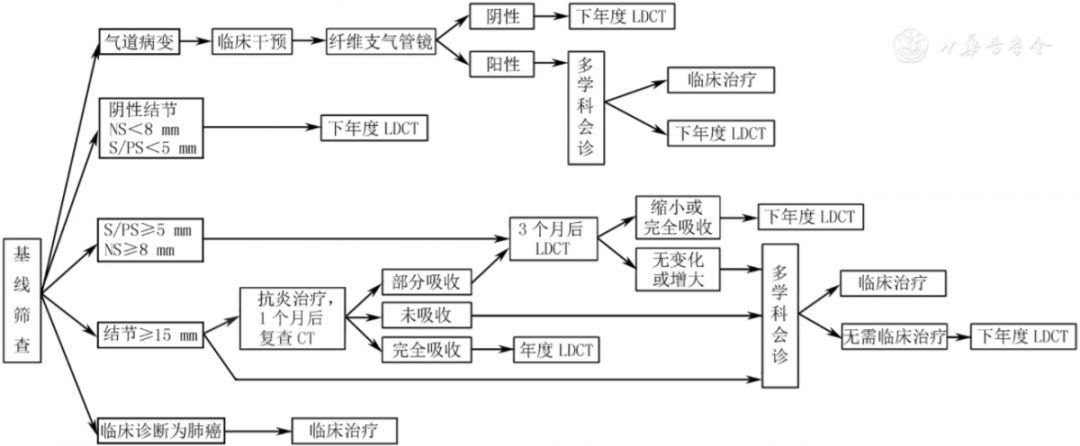
注:LDCT为低剂量CT;NS为非实性结节;S为实性结节;PS为部分实性结节
▲图2 肺癌基线筛查出结节的管理流程图
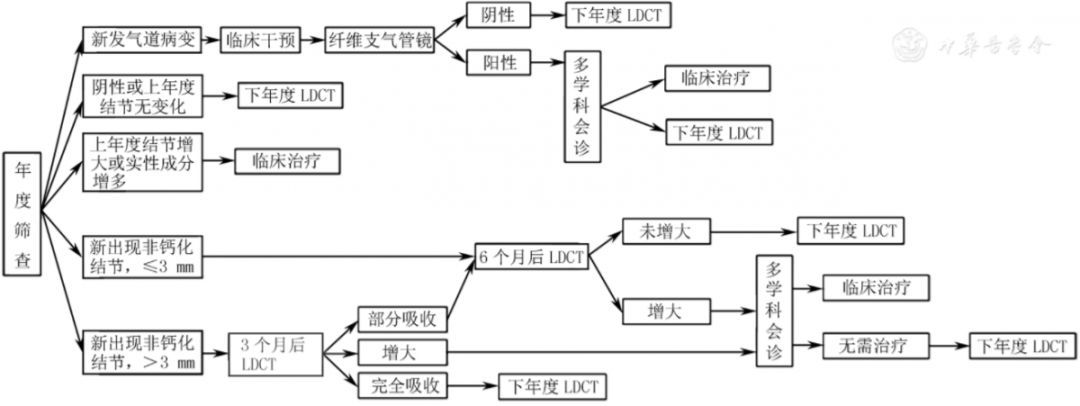
注:LDCT为低剂量CT
▲图3 肺癌年度筛查管理流程及结节管理
3 肺癌的诊断(图4)
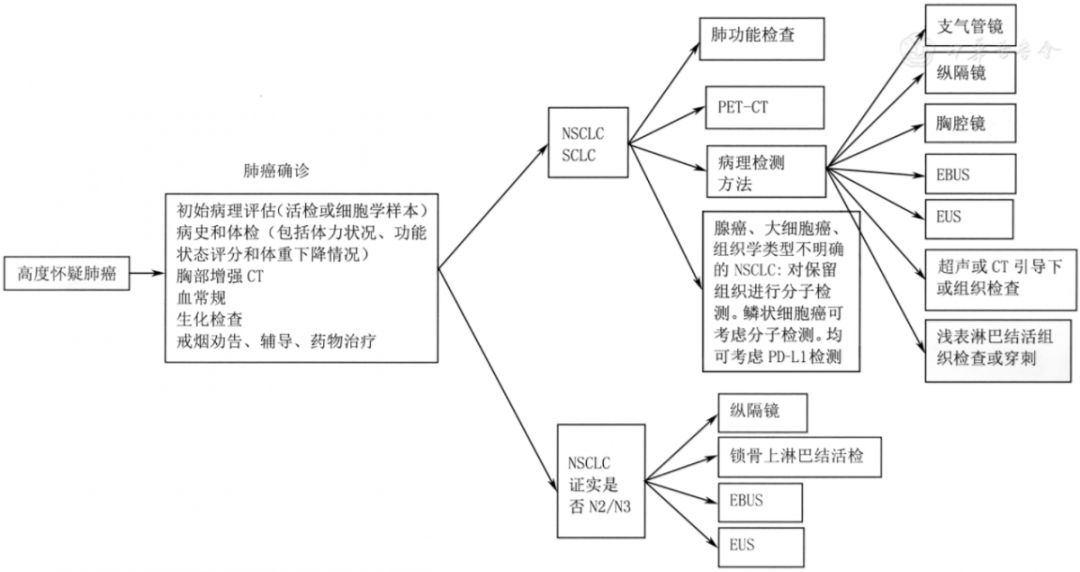
注:NSCLC为非小细胞肺癌;SCLC为小细胞肺癌;PET-CT为正电子发射计算机断层扫描;PD-L1为程序性死亡受体配体1;EBUS为超声支气管镜检查术;EUS为超声内镜检查术
▲图4 肺癌活组织检查流程图
3.1 肺癌的危险因素
3.1.1 吸烟
20世纪50年代首先发现吸烟与肺癌的关系,并提出了"吸烟可导致肺癌"的重要推论。大量调查结果表明,吸烟和许多癌症发生有密切关系,尤以肺癌为甚。通常认为,吸烟与鳞状细胞癌和小细胞癌的关系相对更为密切。肺癌发生的高峰期往往滞后于吸烟高峰期,开始吸烟年龄越小、每日吸烟量越大、持续时间越长,引起肺癌的相对危险度越高。被动吸烟也会增加肺癌的发生。
3.1.2 环境污染
广义的环境污染包括室外大环境污染和室内小环境污染。各种农业、工业废气、粉尘、汽车尾气等可导致呼吸系统疾病上升及心肺疾病死亡率的上升。室内污染也是导致肺癌发生不容忽视的原因,例如室内烹饪燃烧的烟煤释放的大量苯并芘,其可导致肺癌发病率升高。
3.1.3 职业暴露
长期接触铀、镭等放射性物质和石棉、氡、砷及其化合物等高致癌物质者更易罹患肺癌。对于发达国家的非吸烟人群而言,氡是仅次于被动吸烟的室内致肺癌发生因素;另外,经常接触柴油废气者的肺癌发病率也会升高。
3.1.4 肺癌家族史及既往肿瘤史
这类人群往往可能携带有异常基因改变。在目前尚无可靠的肺癌基因筛查系统和公认方法时,更应关注患者的肺癌家族史及既往罹患肿瘤史。有证据表明,一级亲属被诊断肺鳞状细胞癌的个体患肺癌的风险度明显升高。
3.1.5 年龄
在我国,45岁以下人群肺癌发病率相对较低,45岁及以上人群呈现明显增加趋势。
3.1.6 其他
肺结核、慢性阻塞性肺疾病、尘肺等慢性肺部疾病患者肺癌发病率高于健康人。肺支气管慢性炎症及肺纤维瘢痕病变在愈合过程中的鳞状上皮化生或增生可能发展成肺癌。
3.2 肺癌的临床表现
周围型肺癌早期可无明显症状,随着病情的发展,可出现相应的呼吸道症状或转移相关症状。
3.2.1 原发肿瘤表现
(1)咳嗽、咳痰:咳嗽是肺癌患者就诊时最常见的症状,早期常表现为刺激性咳嗽,如果肿瘤增大影响到痰液引流,可继发阻塞性肺炎。(2)痰血与咯血:由于肿瘤组织血管常较为丰富,部分患者肿瘤坏死可出现痰血,如果肿瘤侵袭较大血管,可引起咯血。(3)喘鸣、胸闷、气急:呼吸气流通过气管受压或部分阻塞形成的狭窄处可引起喘鸣。对不明原因反复局部出现喘鸣者尤应警惕。肿瘤压迫可能导致肺呼吸面积减少、甚至引发胸腔积液,可表现为不断加重的胸闷、气急。突发胸闷、气急者需排除肺栓塞的可能。(4)体质量下降、乏力与发热:肿瘤可能引起消耗、食欲不振等,导致患者出现乏力伴体质量下降,肿瘤患者发热以间断中、低热多见,合并感染时可有高热。(5)胸痛:肿瘤侵犯壁层胸膜、肌肉神经或骨组织时,疼痛可加重、持久并位置固定。肺上沟瘤位置较高,可能引起肩、胸背部持续疼痛或出现腋下放射性疼痛。(6)声音嘶哑:多见于因肺癌转移淋巴结压迫或侵及左侧喉返神经而造成声带麻痹所致;而右侧喉返神经位置较高,多在右侧上纵隔淋巴结转移时可能出现。(7)吞咽困难:多见于肿瘤或转移淋巴结压迫、侵犯食管。(8)上腔静脉综合征:多见于肿瘤或转移淋巴结压迫、侵犯上腔静脉。因血液不能顺畅回流,可出现颜面、颈部及上肢肿胀和胸壁血管怒张。(9)膈肌麻痹:多见于肿瘤侵犯膈神经而致其麻痹,可表现为顽固性呃逆、胸闷、气急,还可引起膈肌升高、运动消失或呼吸时的反常运动(吸气上升、呼气下降)。(10)胸腔及心包积液:可由于肿瘤侵犯或转移至胸膜和心包引起,多表现为胸闷、胸痛、心动过速和心前区心音减弱。(11)Pancoast综合征:位于肺尖部的肺癌称为肺上沟瘤,又称Pancoast综合征,因其周围空间狭小而易侵犯臂丛下神经根、星状神经节、交感神经节和肋间神经,产生肩部、肩胛骨内侧缘、上臂甚至前臂的疼痛,往往为阵发性加重的烧灼样痛,可伴皮肤感觉异常和不同程度的肌肉萎缩。如病变侵及星状神经节、交感神经节,则可出现同侧Horner综合征,即同侧瞳孔缩小、眼球内陷、眼睑下垂、颜面无汗等。
3.2.2 远处转移表现
(1)颅内转移:肺癌是引起颅内转移的最常见原因之一,患者可无症状,常出现的中枢神经系统症状包括头痛、呕吐、眩晕、复视、共济失调、偏瘫及癫痫发作等,有时还会伴有精神状态改变和视觉障碍。(2)骨转移:常见于肋骨或脊柱、盆骨与长骨,可无症状或伴有局部疼痛与压痛,若脊柱转移压迫或侵犯脊髓,可导致二便失禁或截瘫等。(3)肝转移:可无症状,转移灶严重时可出现肝肿大和肝区疼痛,可伴有食欲不振、恶心和消瘦,可伴有门冬氨酸氨基转移酶或胆红素升高等表现。(4)肾上腺转移:可呈现爱迪生病(Addison病)症状,出现食欲不振、腹泻、皮肤色素增加、腋毛脱落、低血压等。(5)淋巴结转移:往往循淋巴回流途径首先转移到肺门淋巴结,继而可达纵隔和锁骨上。肿大的浅表淋巴结多质地较硬,可融合成团,多不伴有压痛。(6)其他:肺癌可转移至各个部位,导致多种征象,例如皮下结节、皮肤溃疡、腹痛等表现。
3.2.3 肺外表现
少数肺癌患者可出现一些少见的症状和体征,并非肿瘤的直接作用或转移引起,可出现于肺癌发现前或后,也可同时出现,常表现于胸部以外的脏器。(1)高钙血症:由肺癌导致的骨质破坏、肿瘤分泌甲状旁腺激素导致的骨重吸收钙等引起,可导致心电图PR间期和QRS时限延长、QT间期缩短,心动过缓甚至传导阻滞。(2)抗利尿激素分泌异常综合征(syndrome of inappropriate antidiuretic hormone secretion,SIADH):源于肿瘤细胞异位分泌产生的抗利尿激素样物质。好发于小细胞癌,常表现为稀释性低钠血症,严重时可致意识障碍。(3)异位库欣综合征(Cushing syndrome,ECS):源于肿瘤细胞异位分泌产生的促肾上腺皮质素(adrenocorticotropic hormone,ACTH)类物质,好发于小细胞癌和类癌等。可有低血钾和高血糖、高血压表现,有些患者可能出现特征性的"满月脸"。(4)副肿瘤性神经综合征(paraneoplastic neurologic syndrome,PNS):是恶性肿瘤间接效应引起的一组神经系统症状与体征,脑、脊髓、周围神经、神经肌肉接头及肌肉等多器官均可受累,临床表现多样,多见于小细胞癌患者,可表现为近端肌肉无力、反射降低和自主神经功能失常等,并往往发生于肺癌确诊之前。(5)血液系统异常:表现多种多样,包括血小板的异常增多与减少、类白血病反应、凝血功能异常甚至弥漫性血管内凝血(disseminated intravascular coagulation,DIC)等。(6)皮肤表现:常见于腺癌患者,包括皮肌炎、黑棘皮症等。
3.3 肺癌的辅助影像学检查
肺癌的辅助影像学检查方法主要包括:胸部X线摄影、CT、磁共振成像(magnetic resonance imaging,MRI)、超声、核素显像、正电子发射计算机断层扫描(positron emission tomography-computed tomography,PET-CT)等方法。主要用于肺癌诊断、分期、再分期、疗效监测及预后评估等。在肺癌的诊治过程中,应根据不同的检查目的,合理、有效地选择一种或多种影像学检查方法。
3.3.1 胸部X线摄影
胸部X线摄影是最基本的影像学检查方法之一,通常包括胸部正、侧位片。当对胸部X线摄片基本影像有疑问,或需要了解显示影像的细节,或寻找其他对影像诊断有帮助的信息时,应有针对性地选择进一步的影像学检查方法。因为胸部X线摄片的分辨率较低,且有检查盲区,所以不常规推荐用于肺癌的筛查和检查。
3.3.2 胸部CT检查
胸部CT可以有效地检出早期周围型肺癌,进一步验证病变所在的部位和累及范围,也可帮助鉴别其良、恶性,是目前肺癌诊断、分期、疗效评价及治疗后随访最重要和最常用的影像学手段。
CT检查的特点包括:可检出直径仅2 mm的微小结节及隐藏在隐蔽部位(如心影后、横膈上、纵隔旁、锁骨及肋骨下)肺癌;通过CT,特别是高分辨率CT(high resolution computed tomography,HRCT),能发现对良、恶性肿瘤有鉴别意义的影像学表现;增强CT可帮助检出肺门及纵隔有无增大淋巴结,更正确地判断肺癌的转移范围,对肺癌作出更准确的临床分期;判断手术切除的可能性等。
CT的薄层重建是肺内小结节最主要的检查和诊断方法。对于肺内直径≤2 cm的孤立性结节,可进行薄层重建和多平面重建;对于初诊不能明确诊断的结节,视结节大小、密度不同,给予CT随访。随访中关注结节大小、密度变化,尤其是当发现部分实性结节中的实性成分增多和非实性结节中出现实性成分时,需高度警惕肺癌可能。
在对怀疑肺癌的患者进行诊治前,强烈推荐进行胸部增强CT检查。
3.3.3 MRI检查
MRI检查不推荐用于肺癌的常规诊断,可选择性地用于以下情况:判断胸壁或纵隔受侵情况,显示肺上沟瘤与臂丛神经及血管的关系,特别适用于判定脑、椎体有无转移。脑部增强MRI可作为肺癌术前或初治分期前的常规检查。MRI对椎体及骨转移灵敏度和特异度均很高,可根据临床需求选用。
3.3.4 超声检查
常用于检查腹部重要器官有无转移,也用于锁骨上窝及腋下等浅表部位淋巴结的检查;对于浅表淋巴结、邻近胸壁的肺内病变或胸壁病变,可较为安全地进行超声引导下穿刺活组织检查;超声还可用于检查有无胸膜转移、胸腔积液及心包积液,并可行超声定位抽取积液。
3.3.5 骨扫描
骨扫描是判断肺癌骨转移的常规检查,是筛查骨转移的首选方式,特别是对于无临床症状的可疑骨转移,具有灵敏度高、全身一次成像、不易漏诊的优点;缺点是空间分辨率低,特异性差,需要结合其他检查进一步确诊。当骨扫描检查提示单处骨可疑转移时,若条件允许,建议对可疑部位进行X线摄影、MRI或CT检查,进一步验证。
3.3.6 PET-CT检查
PET-CT是肺癌诊断、分期与再分期、放疗靶区勾画、疗效和预后评估的最佳方法之一。有条件者推荐进行PET-CT检查。但PET-CT对脑和脑膜转移敏感性相对较差,对于需排除有无脑转移的患者,建议与脑部增强MRI联合,以提高诊断率。
对肺癌患者进行分期诊断时,有条件者可进行胸部增强CT、PET-CT及脑部MRI检查。亦可根据当地情况进行胸部增强CT、腹部CT或超声(包括锁骨上淋巴结)、头部CT或MRI、全身骨扫描检查。
3.4 肺癌组织学或细胞学检查标本获取技术
获取病理学标本时,若条件允许,除细胞学外应尽可能地获取组织标本,除用于诊断外还可以进行基因检测。
3.4.1 痰液细胞学检查
是目前诊断中央型肺癌最简单方便的无创诊断方法之一。
3.4.2 胸腔穿刺术
胸腔穿刺术可以获取胸腔积液,进行细胞学检查,以明确病理类型和进行肺癌分期,有条件的地区可行胸腔积液细胞包埋,以提高诊断的阳性率。
3.4.3 浅表淋巴结及皮下转移结节活组织检查
对于有肺部占位怀疑肺癌的患者,如果伴有浅表淋巴结肿大,可进行浅表淋巴结活组织检查,以获得病理学诊断。
3.4.4 经胸壁肺穿刺术
肺穿刺可以在CT或超声引导下进行,是诊断周围型肺癌的首选方法之一。
3.4.5 纤维支气管镜检查
纤维支气管镜检查是肺癌的主要诊断工具,可以进入到4~5级支气管,帮助肉眼观察大约1/3的支气管树黏膜,并且通过活组织检查钳、毛刷以及冲洗等方式进行组织学或细胞学取材,上述几种方法联合应用可以提高检出率。
常规气管镜检查的不足主要包括:(1)检查范围有限,对于外周2/3的呼吸道无法进行肉眼观察;(2)对于腔外病变及淋巴结等无法观察;(3)对于呼吸道黏膜的上皮异型增生及原位癌的诊断率不高。
荧光支气管镜是利用肿瘤组织的自体荧光特性有别于正常组织这一原理开发出的气管镜技术,联合常规气管镜检查对上皮内瘤变和浸润性肺癌的诊断率显著优于常规支气管镜。
对于常规气管镜无法到位的病灶,在能开展经支气管镜肺活组织检查的机构,可根据病灶实际情况开展透视下、小探头、磁导航等技术,以获得病理结果。
3.4.6 经支气管针吸活组织检查术(transbroncho-scopic needle aspiration,TBNA)和超声支气管镜引导下经支气管针吸活组织检查技术(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)
传统TBNA根据胸部CT定位操作,对术者要求较高,不作为常规推荐的检查方法,有条件的医院可开展。EBUS-TBNA可在超声引导下实时进行胸内病灶的穿刺,对肺癌病灶及淋巴结转移灶能够明确诊断,且更具有安全性和可靠性,有条件的医院建议积极开展。当临床怀疑纵隔淋巴结转移影响治疗决策,而其他分期手段难以确定时,推荐采用超声支气管镜等有创分期检查手段明确纵隔淋巴结状态。
3.4.7 纵隔镜检查
纵隔镜检查取样较多,是鉴别伴有纵隔淋巴结肿大的良恶性疾病的有效方法,也是评估肺癌分期的方法之一,但操作创伤及风险相对较大。
3.4.8 胸腔镜
内科胸腔镜可对于不明原因的胸腔积液、胸膜疾病等进行检查。外科胸腔镜可以进行肺癌诊断和分期,可安全有效地获取病变组织,提高诊断阳性率。对于经支气管镜和经胸壁肺穿刺术等检查方法无法取得病理标本的肺癌,尤其是肺部微小结节病变,可行胸腔镜下病灶切除,即可明确诊断。对考虑为中晚期肺癌的患者,可以在胸腔镜下行肺内病灶、胸膜的活组织检查,为制订全面治疗方案提供可靠依据。但胸腔镜检查创伤较大、费用较高,在有其他检查方法可选的条件下,不作为常规推荐手段。
3.5 肺癌的实验室血清学检查
原发性肺癌通常可以分为4种组织学类型:小细胞肺癌(small cell lung cancer,SCLC)、鳞状细胞癌、腺癌和大细胞肺癌。由于SCLC与其他3种类型的临床表现不同,因此临床上一般分为SCLC和非小细胞肺癌(non-small-cell lung carcinoma,NSCLC),也可将有神经内分泌成分的大细胞肺癌和SCLC归为神经内分泌肺癌,其他类型归为非神经内分泌肺癌。目前推荐常用的原发性肺癌标志物有癌胚抗原(carcino embryonic antigen,CEA)、神经元特异性烯醇化酶(neuron-specificenolase,NSE)、细胞角蛋白19片段CYFRA21-1、胃泌素释放肽前体(pro-gastrin-releasingpeptide,ProGRP)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC)等。以上肿瘤标志物联合检测可提高其在临床应用中的灵敏度和特异度。
3.5.1 辅助诊断
肺癌的诊断通常需要结合影像学和病理学检查。肺癌血清肿瘤标志物的灵敏度和特异度还不够高,但肺癌患者血清肿瘤标志物的升高可早于一些临床症状的出现,因此临床诊断时可根据需要检测肺癌相关的肿瘤标志物,行辅助诊断和早期鉴别诊断,并了解肺癌可能的病理类型。标志物水平较高提示肿瘤处于发展期,大多数情况下其水平与肿瘤的大小和分期有一定关联;首次诊断及开始治疗前升高的标志物水平对于以后的监测治疗有重要意义,治疗后的标志物水平可为肿瘤的疗效判断等提供信息,提示预后。(1)SCLC:NSE和ProGRP是诊断SCLC的首选指标。NSE由中枢或外周神经元以及神经外胚层性肿瘤分泌,当组织学结果不能定论时,NSE可以辅助支持SCLC的诊断;但溶血会显著影响NSE检测结果,应在60 min内与红细胞分离检测,防止假性升高。ProGRP作为单个标志物对SCLC诊断的特异性优于其他标志物,它和SCLC分期呈正相关,可以通过其水平鉴别SCLC和良性肺病。ProGRP浓度升高也会出现在肾功能不全的患者中,其水平和血清肌酐明显相关,因此,当ProGRP水平升高而与患者临床症状不相符时,应首先评估患者血清肌酐水平。(2)NSCLC:在患者的血清中,CEA、SCC和CYFRA21-1水平的升高有助于NSCLC的诊断。在肺癌的各种组织学类型中,CEA在大细胞肺癌和肺腺癌中的升高最为明显,且灵敏度较高,此外需注意CEA增高还可见于消化道肿瘤和肺间质纤维化。联合CYFRA21-1和CEA可提高对肺腺癌诊断的灵敏度和特异度。长期吸烟人群的CEA水平可能略高于健康人。CYFRA21-1也是NSCLC敏感的指标之一,要注意其在肾衰竭的患者中可能会出现假性升高。SCC的检测可应用于一般的鳞状上皮肿瘤,一般认为其对肺鳞状细胞癌有较高的特异性,可辅助组织学诊断。皮肤和唾液污染及肾衰竭患者会导致其假性升高。
然而,靠单一的标志物并不能鉴别SCLC和NSCLC,因为大约10%的NSCLC也对神经内分泌标志物中至少一种存在免疫反应。若将NSE、CYFRA21-1、ProGRP、CEA和SCC等指标联合检测,可提高二者的鉴别准确率。
3.5.2 注意事项
(1)对肿瘤患者长期监测过程中,改变肿瘤标志物检测方法可导致结果差异,因而不同检测方法的结果不宜直接比较。如果监测过程中改变检测方法,应重新建立患者的基准线水平,以免产生错误的医疗解释。(2)标本采样后应尽快离心,选择正确的保存条件;同时注意采样时间,排除饮食、药物等其他因素对检测结果的影响。(3)对于影像学检查无明确新发或进展病灶而仅仅肿瘤标志物持续升高的患者,建议寻找原因,警惕疾病复发或进展的可能,需密切随访。
4 肺癌的病理学评估
4.1 病理学亚型
4.1.1 病理学评估
病理学评估的目的取决于标本的来源,包括初始诊断怀疑肺癌的小活组织检查标本或细胞学标本、手术切除标本、诊断为肺癌拟进行分子检测的标本。
(1)小活组织检查标本或细胞学标本。①用于初始诊断的小活组织检查标本或细胞学标本:依据2015年版世界卫生组织(WHO)分类准确诊断;保留足够标本进行分子生物学检测,尤其对于无法手术切除的中晚期患者。②已明确病理诊断的经靶向治疗后进展的行分子检测的小活组织检查标本或细胞学标本:只有当怀疑有不同组织类型肿瘤时,用尽可能少的组织进行免疫组织化学检测证实原组织类型;保留组织做分子检测。③可使用的诊断:"NSCLC倾向腺癌"和"非小细胞癌-非特指型(non-small cell carcinoma-not otherwise specified,NSCLC-NOS)倾向鳞状细胞癌"。对于形态为低分化癌的小活组织检查标本,尽量少使用NSCLC或NSCLC-NOS。NSCLC-NOS应当是除外性诊断,必须在形态学无鳞状细胞癌或腺癌特点,和(或)特殊染色及免疫组织化学检测无法提供帮助或不明确时(参见"本指南的免疫组织化学"部分)才建议使用NSCLC-NOS。④保留组织用于分子检测十分重要。尽量避免组织蜡块的反复切取,并尽量减少用于免疫组织化学染色的组织数量。
(2)手术切除标本。手术切除标本用于明确肿瘤的性质和组织类型、肿瘤分期与预后相关信息(包括肿瘤大小、周围组织侵犯情况、手术切缘及淋巴结转移等)。①淋巴结转移情况与预后相关,因此淋巴结转移数量及部位需要在报告内详细标明,原发肿瘤浸润至邻近淋巴结应作为淋巴结转移。②胸膜侵犯情况应当使用弹力纤维特殊染色或免疫组织化学法标记胸膜弹力纤维进行判读。③呼吸道播散(spread through air spaces,STAS)建议在报告中注明,并注意与穿刺或操作引起的肿瘤脱落细胞以及组织细胞相鉴别,必要时可以进行免疫组织化学染色加以区分。④对肿瘤大小以及肿瘤距离邻近手术切缘、周围组织等与预后相关的数据应当进行准确测量,测量精度为"mm"。
4.1.2 病理组织学类型
组织学分型采用2015年版WHO肺肿瘤组织学分型标准,分期采用国际抗癌联盟(Union of International Cancer Control,UICC)和美国癌症联合会(American Joint Committee on Cancer,AJCC)TNM分期第8版(表1、表2)。
表1 第8版国际抗癌联盟和美国癌症联合委员会肺癌TNM分期与临床分期的关系
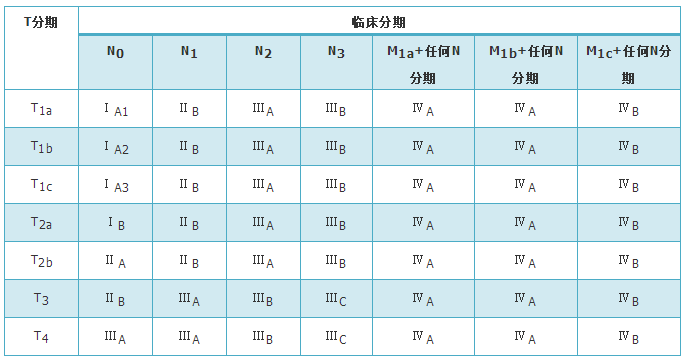
表2 第8版国际抗癌联盟和美国癌症联合委员会肺癌TNM分期描述
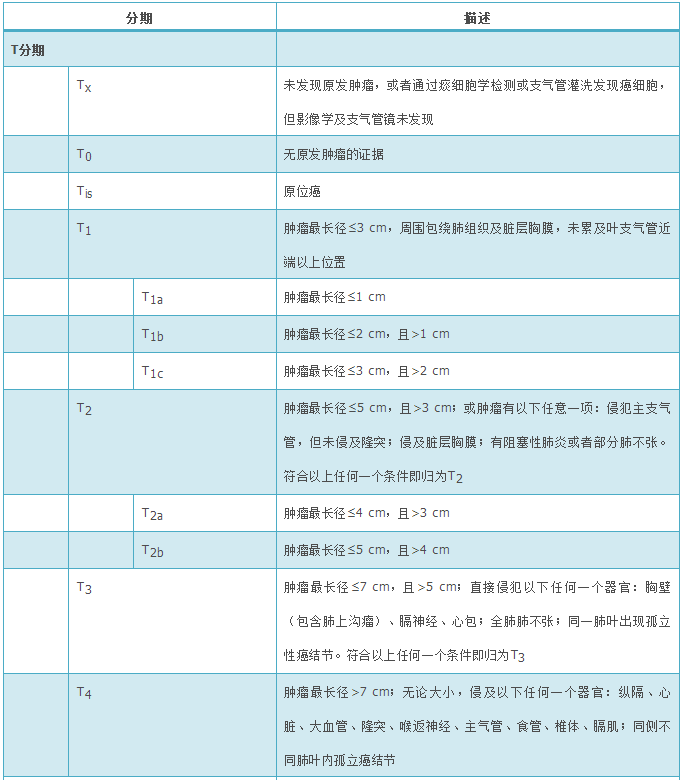
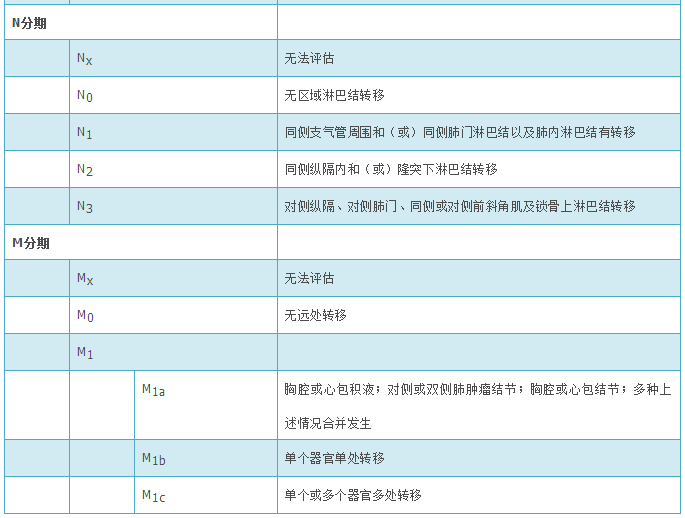
(1)组织标本诊断原则。①鳞状细胞癌:是出现角化和(或)细胞间桥或者形态为未分化NSCLC免疫组织化学表达鳞状细胞分化标志的上皮性恶性肿瘤。目前国际分类分为角化型、非角化型、基底样鳞状细胞癌3种浸润癌亚型。②腺癌:对于小的(肿瘤直径≤3 cm)手术切除的腺癌标本,判断浸润程度很重要。原位腺癌(adenocarcinoma in situ,AIS)指小的局灶性结节(肿瘤直径≤3 cm)、单纯贴壁生长模式的腺癌。大部分为非黏液型,极少为黏液型。可有多灶同时发生的AIS。无间质、脉管及胸膜侵犯,无腺泡状、乳头状、实性或微乳头状等浸润性生长方式。微浸润性腺癌(minimally invasive adenocarcinoma,MIA)是指小的(肿瘤直径≤3 cm)孤立性腺癌,以贴壁型成分为主,且浸润成分最大径≤5 mm;通常为非黏液型,罕见黏液型。无胸膜、支气管、脉管侵犯,无肿瘤性坏死,无呼吸道播散。小活组织检查标本不能诊断AIS及MIA。当小活组织检查标本呈现非浸润性生长时,指出为贴壁生长方式。浸润性腺癌亚型分为贴壁为主型、腺泡型、乳头型、微乳头型和实体型。常为多个亚型混合存在,按照各亚型所占比例从高至低依次列出,各型成分所占比例以5%为增量。微乳头型腺癌及实体型腺癌未达5%也建议列出。浸润性腺癌成分至少一处浸润灶最大直径>5 mm。直径>3 cm的肿瘤全部检查取材后为纯粹贴壁生长或浸润成分不超过5 mm时,应当诊断为贴壁生长为主型腺癌(lepidic predominant adenocarcinoma,LPA)。③腺鳞癌:指含有腺癌及鳞状细胞癌两种成分,每种成分至少占肿瘤的10%。诊断基于手术完整切除的标本,在对小活组织检查标本、细胞学标本或穿刺活组织检查标本诊断中可加以描述提示。④大细胞癌:是未分化型NSCLC,缺乏小细胞癌、腺癌及鳞状细胞癌的细胞形态、组织结构和免疫组织化学特点。诊断需要手术标本经充分取材后作出,非手术切除标本或细胞学标本不能诊断。⑤神经内分泌癌:包括SCLC、大细胞神经内分泌癌(large cell neuroendocrine carcinoma,LCNEC)、类癌,前两种属于高级别神经内分泌肿瘤,后者属于低级别神经内分泌肿瘤。SCLC形态特点为肿瘤细胞小(<3个静止的淋巴细胞),细胞质稀少,核质比高,细颗粒状染色质,无核仁或细小核仁,细胞核分裂数高。高质量的HE染色切片或细胞标本染色良好时可以直接诊断。复合型SCLC是指小细胞癌合并NSCLC的任何一种组织学类型,如腺癌、鳞状细胞癌、大细胞癌、肉瘤样癌或LCNEC(前4种非神经内分泌癌成分无比例要求,合并LCNEC时至少含10% LCNEC成分)。LCNEC是指组织学具有神经内分泌形态特点(菊形团或外周栅栏状)、细胞体积偏大、细胞质丰富、核仁明显且染色质粗糙、免疫组织化学染色表达神经内分泌标志的NSCLC。区别SCLC和LCNEC的最有价值的特点是SCLC核质比高,无明显核仁和细小核仁。复合型LCNEC指LCNEC伴有腺癌、鳞状细胞癌或梭形细胞癌,和(或)巨细胞癌成分。类癌包括典型类癌(typical carcinoid,TC)和不典型类癌(atypical carcinoid,AC)。核分裂象计数采用2 mm2为单位,计数核分裂象最活跃的区域。对于接近截点值(cut off值)2个/2 mm2或10个/2 mm2的肿瘤,至少计数3个/2 mm2,并取平均值。核分裂是区别SCLC和类癌的重要组织学特点。Ki-67免疫组织化学染色有助于鉴别SCLC和类癌,尤其是小活检标本伴挤压变形,或肿瘤细胞坏死时计数核分裂困难的情况下。SCLC的Ki-67阳性细胞占50%~100%。神经内分泌标志仅用于形态学怀疑神经内分泌肿瘤的病例。少部分(<10%)SCLC可以无任何神经内分泌标志物表达,依据细胞形态及甲状腺转录因子1(thyoid transcription factor-1,TTF-1)强表达或细胞角蛋白(cytokeratin,CK)点灶状阳性标记,仍可诊断。⑥转移性肿瘤:肺是全身肿瘤的常见转移部位,因此肺癌诊断时,尤其是肠型腺癌、大细胞癌及SCLC等缺乏肺特异性标志的肿瘤都应当注意除外转移性肿瘤。
(2)细胞学标本诊断原则(2A类推荐证据)。①尽可能少使用NSCLC-NOS的诊断。②当有配对的细胞学和活组织检查标本时,应综合诊断以达到一致性。③对找到肿瘤细胞或可疑肿瘤细胞的标本,均应尽可能制作与活组织检查组织固定程序、规范要求一致的甲醛固定石蜡包埋(formalin-fixed and paraffin-embedded,FFPE)的细胞学蜡块。④细胞学标本准确分型需结合免疫细胞化学染色,建议细胞学标本病理分型不宜过于细化,仅作腺癌、鳞状细胞癌、神经内分泌癌或NSCLC-NOS等诊断,目前无需在此基础上进一步分型及进行分化判断。
4.2 免疫组织化学检测(2A类推荐证据)
4.2.1 原则
对于小活组织检查标本,需审慎使用免疫组织化学染色,以便保留组织用于分子检测。
4.2.2 形态学不明确的肺癌
小活组织检查标本中使用1个腺癌标志[TTF-1或新型胃蛋白酶天冬氨酸蛋白酶A(noval aspartic proteinase of pepsin family A,napsinA)]或一个鳞状细胞癌标志(p40、CK5/6或p63)可以解决绝大部分NSCLC-NOS分型问题。对于手术标本:(1)使用一组抗体鉴别腺癌、鳞状细胞癌。用于鉴别的标志物包括TTF-1、napsinA、p40、CK5/6(p63)。(2)当出现神经内分泌形态(细颗粒状染色质、铸型核、周边栅栏状)时,用一组分子标志物证实神经内分泌分化,如CD56、嗜铬素A(chromogranin A,CgA)、突触核蛋白(synuclein,Syn)、TTF-1、CK、Ki-67;当超过10%肿瘤细胞有一种或一种以上标志明确阳性时,即可诊断。(3)对于低分化癌,当缺少腺样分化时或有特定病因(非吸烟患者或年轻患者)时,要检测睾丸核蛋白(nuclear protein of the testis,NUT)表达情况,以确定是否为肺NUT癌。
4.2.3 形态学不明确的癌
(1)免疫组织化学用于原发肺腺癌与鳞状细胞癌、大细胞癌、转移癌和胸膜恶性间皮瘤的鉴别诊断。(2)WT-1、钙视网膜蛋白(calretinin)、D2-40、CK5/6和Hector Battifora间皮抗原1(Hector Battifora mesothelial antigen-1,HBME-1)为间皮瘤敏感性和特异性标志,CEA、紧密连接蛋白4(claudin 4)、TTF-1和napsin A为腺癌特异性标志。(3)一些标志有助于与转移癌的鉴别诊断,并辅助判断肿瘤来源,如肺原发性腺癌特异性标志TTF-1和napsin A,乳腺癌标志雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、GATA结合蛋白3(GATA binding protein-3,GATA-3)、巨囊性病液状蛋白(gross cystic disease fluid protein 15,GCDFP15)和乳腺球蛋白(mammaglobin),肾细胞癌标志配对盒8(paired box,PAX8),卵巢浆液性乳头状癌标志PAX8、PAX2和ER,胃肠道腺癌标志尾型同源盒2(caudal type homeobox 2),CDX2和绒毛蛋白(villin)(肠型腺癌亦可阳性),前列腺癌标志NKX3.1、前列腺特异性抗体(prostate-specific-antigen,PSA)和雄激素受体(androgen receptors,AR)等。
4.3 分子病理学检测
4.3.1 标本类型
(1)甲醛固定石蜡包埋的标本适合所有的分子生物学检测要求,进行过酸处理的骨穿刺标本不适宜用于检测。(2)细胞学标本中,细胞块和细胞涂片同样适用于分子检测。(3)所有待检测组织学和细胞学标本需要经过病理医师质控,如果有条件可以进行肿瘤富集操作(如微切割或切割)。
4.3.2 基本原则
(1)晚期NSCLC组织学诊断后需保留足够组织进行分子生物学检测,根据分子分型指导治疗(2A类推荐证据)。(2)所有含腺癌成分的NSCLC,无论其临床特征(如吸烟史、性别、种族或其他等),常规进行表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、ROS1分子生物学检测(1类推荐证据)。EGFR突变应用实时聚合酶链反应/扩增阻滞突变系统(real time PCR/amplification refractory mutation system,RT-PCR/ARMS)检测;ALK融合应用Ventana免疫组织化学法检测;ROS1融合基因应用RT-PCR/ARMS方法检测(1B类推荐证据);组织有限和(或)不足以进行分子生物学检测时,可利用血浆游离DNA ARMS法检测EGFR突变(2B类推荐证据)。(3)NSCLC推荐检测必检基因EGFR、ALK、ROS1和扩展基因BRAF、MET、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)/neu、K-ras、RET(2A类推荐证据)。可采用下一代测序(next generation sequencing,NGS)同时检测全部必检基因和扩展基因,或者在常规检测EGFR、ALK、ROS1之后,再应用NGS检测扩展基因。(4)对于EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)耐药患者,建议二次活组织检查进行继发耐药EGFR T790M检测,选择敏感性高的检测方法[如COBAS检测法,目前美国食品药品监督管理局(FDA)批准COBAS检测法用于组织标本EGFR T790M突变的诊断];对于无法获取组织的患者,可用血浆循环肿瘤DNA(circulating tumor DNA,ctDNA)行EGFR T790M检测(1类推荐证据),常用方法包括数字PCR法、Super-ARMS法、NGS法等。EGFR T790M突变检测应用于指导第三代EGFR抑制剂(奥希替尼)治疗的选择。
4.3.3 补充说明
亚裔人群肺腺癌EGFR基因敏感突变阳性率约为50%。EGFR突变检测应涵盖EGFR-18、19、20、21号外显子(1类推荐证据)。最常见的EGFR基因突变(如19号外显子缺失突变,21号外显子p.L858R点突变)以及少见类型EGFR突变(如19号外显子插入,p.L861Q,p.G719X,p.S768I)均对EGFR-TKI治疗有效。部分类型EGFR突变对EGFR-TKI治疗无效(如20号外显子插入突变和p.T790M);但EGFR-20号外显子插入突变(p.A763_Y764insFQEA)仍对EGFR-TKI治疗有效,需要明确20号外显子插入突变具体突变位点(2A类推荐证据)。
ALK的检测应与EGFR突变检测平行进行,一线检测方法为免疫组织化学和荧光原位杂交(fluorescence in situ hybridization,FISH)。ALK Ventana免疫组织化学(D5F3)CDx检测为FISH检测的有效替代方法,被美国FDA批准为选择接受克唑替尼治疗的伴随诊断。NGS和RT-PCR技术也能检测大部分ALK融合,但不能检测全部融合类型。ALK最常见的融合类型是EML4-ALK。免疫组织化学可用作晚期肺腺癌ROS1融合基因突变筛选检测(2B类推荐证据);但是阳性病例应该以其他分子检测方法(如FISH、RT-PCR或NGS)证实。常见的ROS1融合分子有CD47、SLC34A2、CCDC6和FIG。
为了避免样本浪费和节约检测时间,对于晚期NSCLC活组织检查样本,应根据所选用的技术特点,一次性切出需要诊断组织学类型和进行EGFR突变、ALK融合和ROS1融合基因检测的样本量,避免重复切片浪费样本。
在标本量有限的情况下,可采用同时检测多个驱动基因突变的技术,如PCR技术或NGS技术。在NSCLC选择除EGFR、ALK和ROS1以外的其他靶点进行治疗时,NGS优于多个单基因检测(2A类推荐证据)。
原发肿瘤和转移灶都适于进行EGFR突变、ALK融合、ROS1融合检测。
肿瘤免疫治疗患者的筛选方法:(1)免疫组织化学检测程序性死亡受体配体1(PD-L1)用于发现可能对一线免疫治疗有效的患者。多种用于免疫组织化学检测PD-L1表达的抗体中,一些与治疗效果相关。阳性和阴性的判定需参阅各试剂盒和使用的检测平台,每种试剂盒和检测平台对应一种特定的抑制剂治疗方法(1类推荐证据)。(2)肿瘤突变负荷(tumor mutation burden,TMB)是能够预测免疫治疗效果的又一标志物。目前在检测方法及cut off值还无统一的方式和定义,并且临床研究显示不同大小的测序Panel会影响TMB准确度(3类推荐证据)。(3)全基因组测序预测新抗原(3类推荐证据)。
5 肺癌的治疗
5.1 Ⅰ、Ⅱ期NSCLC患者的综合治疗(图5)
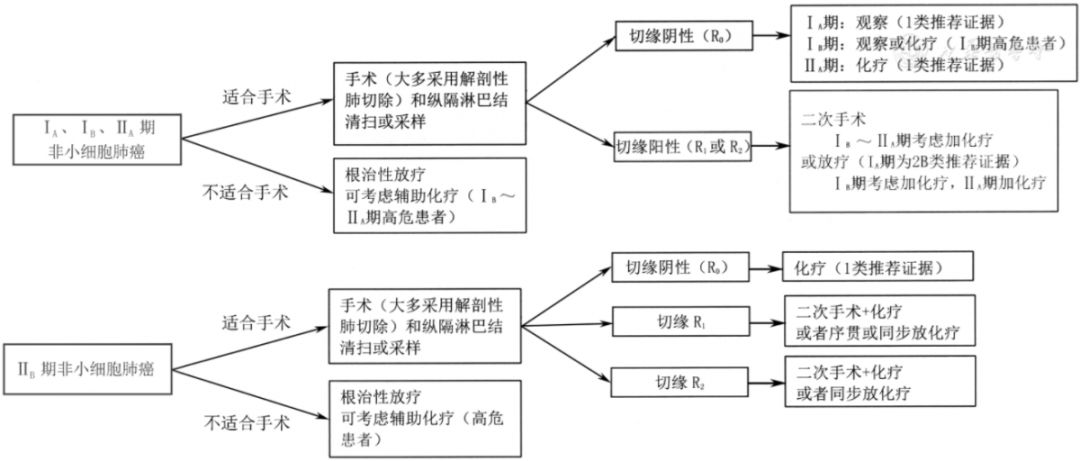
注:若未特别标注,所有推荐均为2A类推荐证据;R0为完整切除;R1为镜下发现不完整切除;R2为肉眼可见肿瘤残余
▲图5 Ⅰ、Ⅱ期非小细胞肺癌治疗流程图
5.1.1 基本原则
外科手术根治性切除是早期NSCLC的推荐优选局部治疗方式。
5.1.2 外科治疗的重要性
(1)外科医师应积极参与对患者的临床分期、切除可能性判断和功能评估,根据肿瘤进展程度和患者的功能状况决定手术指征和手术方式。(2)高危患者功能状况可能无法耐受根治性手术切除,在考虑立体定向体部放疗(stereotactic body radiotherapy,SBRT)、冷冻、射频消融等其他局部治疗方式时,应首先由包括外科医师在内的多学科团队讨论决定。
5.1.3 手术方式
(1)原则:完整彻底切除是保证手术根治性、分期准确性、加强局控和长期生存的关键。(2)手术方式:解剖性肺切除仍是标准术式(1类推荐证据)。1995年LCSG821前瞻性研究结果显示,T1期肺癌肺叶切除的局部复发率明显低于亚肺叶切除,生存率显著高于亚肺叶切除,因此目前早期肺癌的标准术式仍是解剖性肺叶切除(1类推荐证据)。对于部分中央型肺癌,在手术技术能够保证切缘的情况下,支气管和(或)肺动脉袖式肺叶切除等保留肺组织解剖性切除围术期风险小而疗效优于全肺切除,为推荐术式(1类推荐证据)。亚肺叶切除目前仍处于临床研究阶段,日本JCOG0802/WJOG4607L和北美洲CALGB 140503两项早期肺癌肺叶切除与亚肺叶切除比较的前瞻性多中心随机对照试验均已完成入组,并有围术期结果报道,未发现两种切除范围之间手术并发症或死亡率差异有统计学意义,目前正在等待长期随访结果,在此之前意向性亚肺叶切除仅适用于以下情况(2B类推荐证据),①患者功能状况无法耐受肺叶切除。②直径≤2 cm的周围型小结节、同时具备以下条件,磨玻璃(ground-glass opacity,GGO)成分>50%;长期随访肿瘤倍增时间≥400 d;病理为AIS或MIA。③亚肺叶切除要求(2B类推荐证据):应保证切缘≥2 cm或≥病灶直径;相比于楔形切除更推荐解剖性肺段切除;除非患者功能状况不允许,否则同样应行肺门、纵隔淋巴结采样。(3)手术路径:①开胸和微创手术具备同样的肿瘤学效果,外科医师可根据习惯和熟练程度选择手术方式(1类推荐证据)。②已证实胸腔镜(包括机器人辅助)等微创手术安全可行,围术期结果优于开胸手术,长期疗效不亚于开胸手术。因此在外科技术可行且不牺牲肿瘤学原则的前提下推荐胸腔镜手术路径(1类推荐证据)。(4)淋巴结清扫标准(2A类推荐证据):①淋巴结清扫及采样是外科手术的必要组成部分,常规至少应整块清除或系统采样3组纵隔淋巴结(左侧:第4L、5、6、7、8、9组,右侧第2R、4R、7、8、9组)。对于淋巴结清扫或采样个数,至少清扫或采样纵隔+肺内共12个淋巴结。②Ⅰ~Ⅲ期肺癌在术前规范纵隔分期未发现淋巴结转移(PET或EBUS、纵隔镜检查阴性)的前提下,淋巴结清扫较采样并未明显升期或带来术后生存优势,但术前仅行影像学分期(未行PET或EBUS、纵隔镜分期)的,仍推荐行淋巴结清扫(1类推荐证据)。③术前影像学显示纯GGO为主(成分>50%),且术中冰冻为伏壁生长为主的浸润型腺癌,纵隔淋巴结转移概率极低,可选择性采样1~3组(左侧第5、7、9组,右侧第2或4、7、9组)纵隔淋巴结。
5.1.4 手术切除标准
(1)完整切除包括阴性切缘(支气管、动脉、静脉、支气管周围、肿瘤附近组织)、系统性淋巴结清扫或采样且最上纵隔淋巴结阴性。无论何时,如有出现切缘受累、未切除的阳性淋巴结、淋巴结外侵犯或转移性胸腔或心包积液,即为不完整切除。(2)完整切除为R0,镜下发现不完整切除为R1,肉眼可见肿瘤残余为R2,镜下切缘阴性但纵隔淋巴结清扫未达到标准或最上纵隔淋巴结阳性为Rx。
5.1.5 术后辅助治疗
(1)完整切除切缘阴性(R0切除)NSCLC后续治疗:①ⅠA(T1a/b/c N0)期患者术后定期随访(1类推荐证据)。②ⅠB(T2a N0)期患者术后可随访。ⅠB期患者术后辅助治疗需行多学科评估,对每一例患者评估术后辅助化疗的益处与风险,有高危险因素者[如低分化肿瘤(包括神经内分泌肿瘤,但不包括分化良好的神经内分泌肿瘤)、脉管侵犯、肿瘤直径>4 cm、脏层胸膜侵犯、楔形切除]推荐进行术后辅助化疗(2A类推荐证据)。病理亚型以实体型或微乳头为主的ⅠB期腺癌患者也可以考虑辅助化疗(2B类推荐证据)。③ⅡA和ⅡB期患者,推荐以铂类为基础的方案进行辅助化疗,不建议行术后辅助放疗(1类推荐证据)。(2)非完整切除切缘阳性NSCLC后续治疗:①ⅠA(T1a/b/c N0)期患者,无论是R1或是R2切除,均应首选再次手术,放疗也可供选择(2B类推荐证据)。②ⅠB(T2a N0)和ⅡA(T2b N0)期患者,无论是R1或是R2切除,均应首选再次手术,放疗也可供选择,后续化疗视情况而定。ⅠB期有高危险因素者[如低分化肿瘤(包括神经内分泌肿瘤,但不包括分化良好的神经内分泌肿瘤)、脉管侵犯、楔形切除、脏层胸膜侵犯、未知的淋巴结状态Rx]可考虑进行术后辅助化疗,病理亚型以实体型或微乳头为主的ⅠB期腺癌患者也可考虑辅助化疗(2B类推荐证据)。ⅡA期患者均应进行辅助化疗(2A类推荐证据)。③ⅡB期R1切除患者可选择再次手术和术后辅助化疗,或者同步或序贯放化疗;R2切除患者可选择再次手术和术后辅助化疗,或者同步放化疗(2A类推荐证据)。
5.1.6 同期多原发癌(2B类推荐证据)(图6)
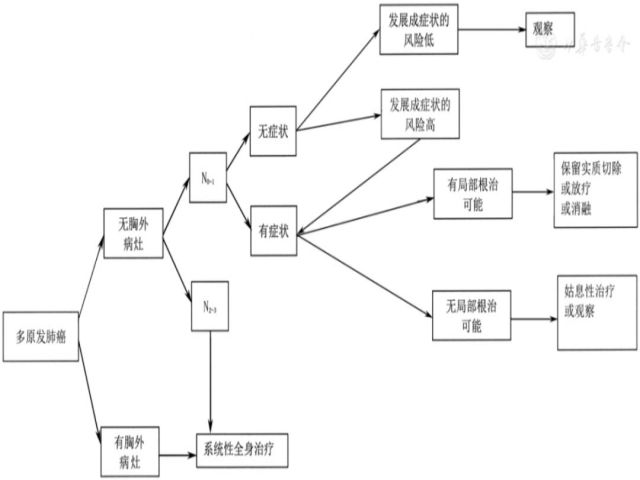
▲图6 多原发肺癌诊治流程图
(1)诊断:病理组织类型不同时,基因变异不同或为不同的AIS;若病理组织类型相同,肿瘤位于不同肺叶,且不能有纵隔淋巴结转移。(2)分期:针对每一个病灶进行TNM分期(2A类推荐证据)。(3)治疗:首选外科手术治疗。①优先处理主病灶,兼顾次要病灶,在不影响患者生存及符合无瘤原则的前提下尽量切除病灶,并尽可能保留肺功能(如亚肺叶切除)(2A类推荐证据)。②次要病灶若为纯GGO,受限于心肺功能无法全部切除病灶时,建议6~12个月随访1次,若无变化,每2年随访1次(2A类推荐证据)。③心肺功能不佳、不能耐受手术者,可考虑SBRT(2A类推荐证据)。
5.2 Ⅲ期NSCLC患者的综合治疗
Ⅲ期NSCLC是一类异质性明显的疾病。根据国际肺癌研究学会(International Association for the Study of Lung Cancer,IASLC)第8版Ⅲ期非小细胞肺癌分为ⅢA、ⅢB、ⅢC期。ⅢC期和绝大部分ⅢB期归类为不可切除的Ⅲ期NSCLC。治疗以根治性同步放化疗为主要治疗模式(1类推荐证据)。ⅢA和少部分ⅢB期NSCLC的治疗模式分为不可切除和可切除。对于不可切除者,治疗以根治性同步放化疗为主,对于可切除的,治疗模式是以外科为主导的综合治疗(2A类推荐证据)。
5.2.1 可切除类Ⅲ期NSCLC(图7)
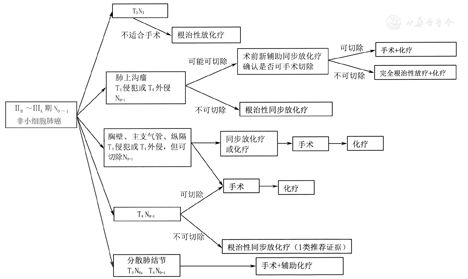
注:若未特别标注,所有推荐均为2A类推荐证据;T3包括侵犯壁层胸膜(PL3)、胸壁(包括肺上沟瘤)、膈神经、心包壁;T4包括侵犯横膈、纵隔、心脏、大血管、气管、喉返神经、食管、椎体、隆突
▲图7 ⅡB~ⅢA期N0~1非小细胞肺癌治疗流程图
Ⅲ期NSCLC可切除类是指T3N1、T4N0~1和部分T1~2N2,少部分ⅢB期(指T3N2,N2为单一淋巴结转移且直径<3 cm)。外科的角色主要取决于肿瘤的可切除性。多学科综合治疗的模式是以外科为主的综合治疗。因此,临床分期(可切除性评估)、手术耐受性评估及手术时机和方式是可切除类Ⅲ期NSCLC外科治疗的重要内容。(1)临床分期:对所有怀疑为ⅢA期的患者均推荐行胸部高分辨增强CT检查,以评估纵隔淋巴结情况(2A类推荐证据)。强烈推荐有条件的患者进行PET-CT检查,以评估纵隔淋巴结及远处淋巴结转移情况(2A类推荐证据)。可疑阳性淋巴结标准为短径≥1 cm或PET-CT提示氟代脱氧葡萄糖(fluorodexyglucoses,FDG)高代谢,对此类淋巴结建议通过超声内镜引导下的经支气管针吸活组织检查(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)或纵隔镜明确病理分期(2A类推荐证据)。对于新辅助治疗后降期重新评估的患者,可行PET-CT替代有创检查(2A类推荐证据)。新辅助治疗模式(化疗、序贯化放疗、同步化放疗等)仍待进一步研究。患者在接受根治性治疗前,推荐行脑部增强MRI检查,以评估脑转移情况(2A类推荐证据)。脑部增强CT可作为替代检查(2A类推荐证据)。(2)手术耐受性评估:术前必须评估患者的心肺功能,推荐使用心电图及肺功能检查进行评估(1类推荐证据)。由于ⅢA期患者术后须行辅助治疗,因此术前应考虑到患者的残肺功能是否可以耐受化疗及放疗(2A类推荐证据)。术前须排除患者其他器官的严重合并症,包括6个月内心脑血管事件(心肌梗死、中风等)、心力衰竭、心律失常、肾衰竭等(2A类推荐证据)。高龄患者的数据报道较少,行手术应谨慎(2A类推荐证据)。(3)手术时机和方式:可以和(或)能完全切除的肿瘤患者,新辅助治疗的最佳模式尚未确定,是否接受术前新辅助治疗对生存的改善差异不明显,但均建议接受术后辅助治疗(2B类推荐证据)。外科医师可在综合评估患者情况后决定手术时机(2B类推荐证据)。推荐进行彻底的纵隔淋巴结清扫,即右侧清扫2R、4R、7、8、9组淋巴结,左侧清扫4L、5~9组淋巴结(1类推荐证据)。推荐整块切除淋巴结(2A类推荐证据)。
手术的原则为在完全切除肿瘤的基础上尽可能保留肺组织(1类推荐证据)。在术前充分评估的基础上,根据肿瘤浸润范围可行肺叶、复合肺叶、袖状以及全肺切除,推荐到有条件的大型医院进行此类手术(2A类推荐证据)。ⅢA期可手术的NSCLC术后推荐辅助含铂两药化疗(1类推荐证据)。不常规推荐术后辅助放疗,建议进行多学科会诊,评估术后辅助放疗对于N2患者的治疗获益与风险(2B类推荐证据)。对于术后发现驱动基因阳性的患者,可行术后辅助EGFR-TKI靶向治疗(2A类推荐证据)。
5.2.2 不可切除类Ⅲ期NSCLC(图8)
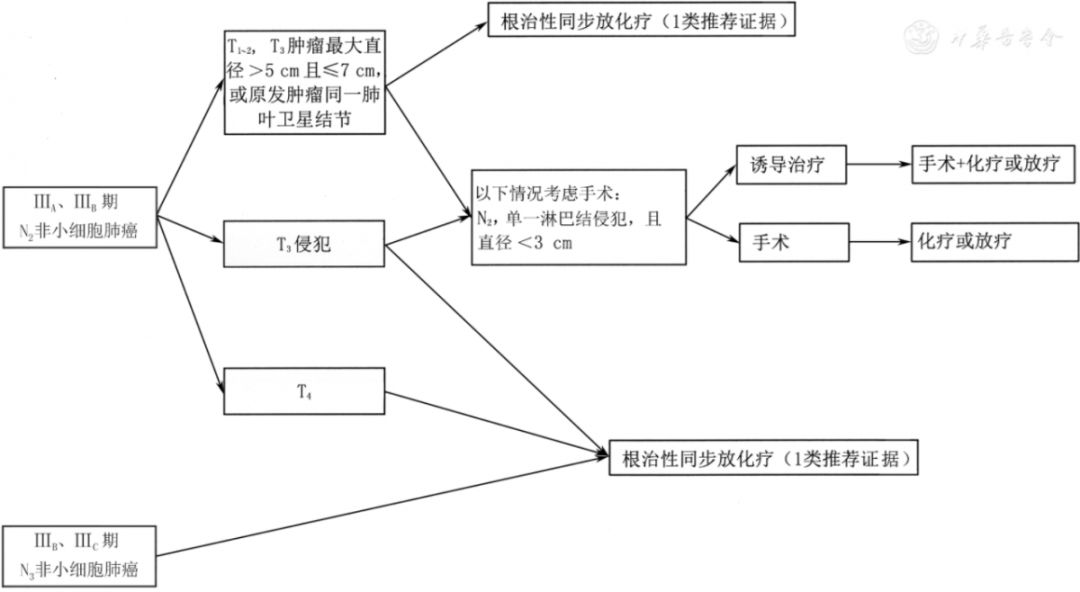
注:若未特别标注,所有推荐均为2A类推荐证据;T3包括侵犯壁层胸膜(PL3)、胸壁(包括肺上沟瘤)、膈神经、心包壁
▲图8 ⅢA、ⅢB期N2及ⅢB、ⅢC期N3非小细胞肺癌治疗流程图
Ⅲ期不可切除的NSCLC包括以下几类:(1)同侧多枚成团或多站纵隔淋巴结转移[ⅢA(T1~3N2)或ⅢB(T4N2)]。(2)对侧肺门、纵隔淋巴结,或同侧、对侧斜角肌或锁骨上淋巴结转移[ⅢB、ⅢC(T1~4N3)]。(3)不可或不适合切除肿瘤包括部分肺上沟瘤[主要指肿瘤侵犯椎体超过50%;臂丛神经受侵犯,食管、心脏或气管受侵犯等,ⅢA(T3N1、T4N0~1)]。
局部晚期不能手术患者治疗方法选择,除了需要考虑到肿瘤因素外,还需要结合患者一般情况和治疗前有无明显体质量下降,以及对放疗的正常组织器官(如肺、脊髓、心脏、食管和臂丛神经等)耐受剂量等进行综合考虑,根据实际情况选择放化疗剂量。
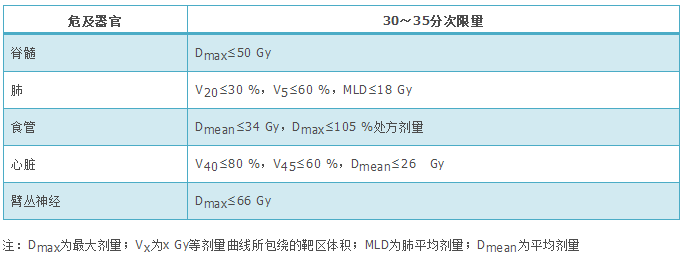
(1)推荐根治性同步放化疗(1类推荐证据)。①同步放疗。放疗靶区:原发灶+转移淋巴结累及野放疗,累及野放疗可以更优化肿瘤组织剂量和正常组织的毒性剂量;PET-CT图像能明显提高靶区勾画的准确性,特别是存在明显肺不张或者静脉增强禁忌的患者。放疗剂量:根治性处方剂量为60~70 Gy,2 Gy/次,最小处方剂量至少60 Gy,但最佳放疗剂量仍不确定,74 Gy不推荐作为常规用量。可以采用更新的放疗技术保证根治性放疗的实施,如调强适形放疗(intensity-modulated Radiotherapy,IMRT)/容积旋转调强疗法(volumetric-modulated arc therapy,VMAT)、影像引导放疗(image guided radiotherapy,IGRT)及质子放疗等,可减少毒性及提高疗效。临床常规采用三维适形放疗(three-dimensional conformal radiotherapy,3DCRT)、IMRT技术,但IMRT是更好的选择,它能降低高级别放射性肺炎的发生。②以铂类为主的同步化疗方案(2A类推荐证据)。E方案:顺铂50 mg/m2,第1、8、29、36天;依托泊苷50 mg/m2,第1天至第5天,第29天至第33天。NP方案:顺铂75 mg/m2,第1、29天;长春瑞滨5 mg/m2,每周1次,共5次。AC方案:卡铂时间曲线下面积(area under the curve,AUC)=5,第1天;培美曲塞500 mg/m2,第1天;每3周重复,共4个周期(非鳞状细胞癌)。AP方案:顺铂75 mg/m2,第1天;培美曲塞500 mg/m2,第1天;每3周重复,共3个周期(非鳞状细胞癌)。TC方案:每周紫杉醇40~50 mg/m2,卡铂AUC=2,同步胸部放疗±序贯2个周期紫杉醇150~175 mg/m2,卡铂AUC=5~6。(2)序贯放化疗。若无法耐受同步化放疗时,序贯放化疗优于单纯放疗(2A类推荐证据)。放疗方案同前,增加放疗剂量有可能改善患者生存(2B类推荐证据),最佳放疗剂量不确定。序贯化疗方案如下,①NP方案:顺铂75 mg/m2,第1天;长春瑞滨25 mg/m2,第1、8天;每3周重复,2~4个周期,随后放疗。②TC方案:紫杉醇150~175 mg/m2,第1天;卡铂AUC=6,第1天,至少滴注1 h;2~4个周期,随后放疗。③AC方案:卡铂AUC=5,第1天;培美曲塞500 mg/m2,第1天,每3周重复,2~4个周期(非鳞状细胞癌),随后放疗。④AP方案:顺铂75 mg/m2,第1天;培美曲塞500 mg/m2,第1天,每3周重复,2~4个周期(非鳞状细胞癌),随后放疗。(3)诱导和巩固化疗。①若无法耐受化放疗综合性治疗[患者一般情况差,伴其他内科疾病,体质量明显下降和(或)患者意愿],单纯放疗是标准治疗(2A类推荐证据)。放疗方案同根治性同步放化疗中放疗方案(放疗剂量见表3):增加放疗剂量有可能改善生存(2B类推荐证据),最佳放疗剂量不确定。②尽管对于大负荷肿瘤,临床上通过诱导化疗来降低肿瘤体积,获得化放疗同步治疗机会,但无证据显示诱导化疗能提高生存获益(2A类推荐证据)。③同步化放疗后巩固化疗未能进一步提高临床疗效,但对于潜在转移风险大或同步期间化疗未达到足量患者,可以考虑应用巩固化疗(2A类推荐证据)。
表3 Ⅲ期非小细胞肺癌常规分割放疗正常组织器官剂量-体积限制
5.3 Ⅳ期NSCLC患者的全身治疗(图9)
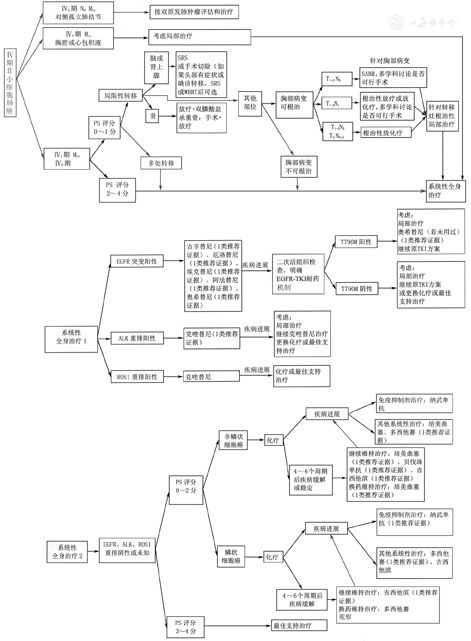
注:若未特别标注,所有推荐均为2A类推荐证据;PS为功能状态;SRS为立体定向放射外科;WBRT为全脑放疗;SABR为立体定向消融放疗;EGFR为表皮生长因子受体;ALK为间变性淋巴瘤激酶;TKI为酪氨酸激酶抑制剂
▲图9 Ⅳ期非小细胞肺癌治疗流程图
5.3.1 一线治疗
(1)非鳞状细胞癌驱动基因阳性且不伴有耐药基因突变患者的治疗。①EGFR敏感驱动基因阳性的患者:推荐使用EGFR-TKI,包括吉非替尼、厄洛替尼、埃克替尼、阿法替尼、奥希替尼(1类推荐证据),脑转移患者推荐奥希替尼(2A类推荐证据);对于G719X、L861Q、S768I等少见突变的患者,首先推荐阿法替尼。一线已经开始化疗的过程中发现EGFR驱动基因阳性的患者,推荐完成常规化疗(包括维持治疗)后换用EGFR-TKI,或者中断化疗后开始靶向治疗(2A类推荐证据)。②ALK融合基因阳性的患者:推荐选择克唑替尼(1类推荐证据);一线已经开始化疗的过程中发现ALK融合基因阳性的患者,推荐完成常规化疗,包括维持治疗后换用靶向治疗或者中断化疗后开始靶向治疗(2A类推荐证据)。③ROS1融合基因阳性的患者:ROS1融合基因阳性的患者一线治疗推荐选择克唑替尼。
(2)非鳞状细胞癌驱动基因阴性或未知患者的治疗。①功能状态(PS)评分0~1分的患者:推荐含铂两药联合的方案化疗,化疗4~6个周期,铂类可选择卡铂或顺铂,与铂类联合使用的药物包括培美曲塞、紫杉醇、吉西他滨或多西他赛(1类推荐证据);培美曲塞联合顺铂可以明显延长患者生存期,且在疗效及降低毒性方面优于吉西他滨联合顺铂(2A类推荐证据);对不适合铂类药物治疗的患者,可考虑非铂类两药联合方案化疗,包括吉西他滨联合长春瑞滨]或吉西他滨联合多西他赛(1类推荐证据)。对于无以下禁忌患者可选择贝伐单抗或重组人血管内皮抑素与化疗联用并进行维持治疗(2A类推荐证据),贝伐单抗联合紫杉醇及卡铂为推荐方案(1类推荐证据),禁忌包括中央型肺癌、近期有活动性出血(如咯血)、血小板降低、难以控制的高血压、肾病综合征、有动脉血栓栓塞事件、充血性心力衰竭、抗凝治疗。②PS评分2分的患者:推荐单药治疗。与最佳支持治疗相比,单药化疗可以延长患者生存期并提高生命质量。可选的单药包括吉西他滨、长春瑞滨、紫杉醇、多西他赛、培美曲塞(2A类推荐证据)。③PS评分3~4分的患者:不建议使用细胞毒类药物化疗。此类患者一般不能从化疗中获益,建议采用最佳支持治疗或参加临床试验。④一线化疗4~6个周期达到疾病控制(完全缓解、部分缓解和稳定)、且PS评分好、化疗耐受性好的患者可选择维持治疗。同药维持治疗的药物为培美曲塞、吉西他滨或贝伐单抗(1类推荐证据);换药维持治疗的药物为培美曲塞(1类推荐证据)。
(3)鳞状细胞癌驱动基因阴性或未知患者的治疗。①PS评分0~1分的患者:推荐含铂两药联合的方案化疗,化疗4~6个周期,铂类可选择卡铂、顺铂或奈达铂,与铂类联合使用的药物包括紫杉醇、吉西他滨或多西他赛(1类推荐证据);对不适合铂类药物治疗的患者,可考虑非铂类两药联合方案化疗,包括吉西他滨联合长春瑞滨或吉西他滨联合多西他赛。②PS评分2分的患者:推荐单药化疗,与最佳支持治疗相比,单药化疗可以延长生存期,并提高生命质量,可选的单药包括吉西他滨、长春瑞滨、紫杉醇、多西他赛(2A类推荐证据)。③PS评分3~4分的患者:建议采用最佳支持治疗或参加临床试验。④一线化疗4~6个周期达到疾病控制(完全缓解、部分缓解和稳定)且PS评分好、化疗耐受性好的患者:可选择维持治疗。同药维持治疗的药物为吉西他滨(1类推荐证据),也可选择多西他赛(2A类推荐证据)。
(4)鳞状细胞癌驱动基因阳性患者的治疗。①尽管晚期NSCLC中的腺癌EGFR突变率明显高于非腺癌,但在非腺癌中检测的EGFR突变结果支持对所有NSCLC患者进行EGFR检测。推荐对不吸烟、小标本或混合型的鳞状细胞癌患者进行EGFR、ALK基因检测(2A类推荐证据),也推荐对鳞状细胞癌患者进行ROS1融合基因检测(2A类推荐证据)。②EGFR驱动基因、ALK融合基因和ROS1融合基因阳性患者的治疗分别参照非鳞状细胞癌驱动基因阳性患者治疗方法。
5.3.2 二线及后线治疗
首先积极鼓励患者参加新药临床研究。
(1)非鳞状细胞癌驱动基因阳性患者的治疗。①EGFR驱动基因阳性的Ⅳ期非鳞状细胞癌患者:如果一线未使用EGFR-TKI,二线治疗时建议首先使用EGFR-TKI(1类推荐证据)。一线使用EGFR-TKI后疾病进展患者,根据进展类型分为缓慢进展型、局部进展型、快速进展型。若为缓慢进展型,推荐继续原EGFR-TKI治疗(2A类推荐证据)。治疗后再次进展,推荐二次活组织检查检测T790M突变状态。若为局部进展型,推荐继续原EGFR-TKI治疗+局部治疗(2A类推荐证据)。治疗后再次进展,推荐二次活组织检查检测T790M突变状态。若为快速进展型,推荐二次活组织检查检测T790M突变状态,T790M阳性者,口服奥希替尼,T790M阴性者推荐含铂双药化疗(1类推荐证据)。若未进行T790M状态检测,推荐含铂双药化疗。三线可接受单药化疗或在无禁忌证的情况下推荐使用安罗替尼(2A类推荐证据)。②ALK融合基因阳性的Ⅳ期非鳞状细胞癌患者:如果一线未使用克唑替尼,二线治疗时建议首先使用克唑替尼,也可使用含铂双药化疗(1类推荐证据)。一线克唑替尼治疗出现疾病进展者,若为缓慢进展,可继续口服克唑替尼(2A类推荐证据);若为局部进展型者,推荐继续口服克唑替尼+局部治疗(2A类推荐证据);若为快速进展者,可接受含铂双药化疗(2A类推荐证据)。在无禁忌证的情况下,三线推荐使用安罗替尼(2A类推荐证据)。③ROS1基因重排阳性的Ⅳ期非鳞状细胞癌患者:如果一线未使用克唑替尼,二线治疗时建议首先使用克唑替尼(2B类推荐证据)。若一线接受克唑替尼治疗后进展者,建议接受含铂双药化疗(2A类推荐证据)。在无禁忌证的情况下,三线推荐使用安罗替尼(2A类推荐证据)。
(2)非鳞状细胞癌驱动基因阴性或不详患者的治疗:PS评分0~2分、驱动基因阴性的非鳞状细胞癌患者一线治疗进展后,如果未接受过免疫治疗,推荐二线治疗使用纳武单抗(nivolumab)(1类推荐证据)。PS评分0~2分、驱动基因阴性的非鳞状细胞癌患者一线进展后也可使用多西他赛(1类推荐证据)或培美曲塞(2A类推荐证据)单药化疗。对于PS评分>2分患者,二线建议最佳支持治疗。若前期未使用培美曲塞或多西他赛单药治疗者,三线可接受培美曲塞或多西他赛单药治疗(2A类推荐证据),或在无禁忌证的情况下推荐使用安罗替尼(2A类推荐证据),后线建议最佳支持治疗。
(3)鳞状细胞癌驱动基因阳性患者的治疗。对于EGFR驱动基因阳性的Ⅳ期鳞状细胞癌患者,如果一线治疗未使用EGFR-TKI,二线治疗时建议首先使用EGFR-TKI(2B类推荐证据)。若一线治疗使用EGFR-TKI后疾病进展,参照非鳞状细胞癌驱动基因阳性患者的治疗。三线建议单药化疗,或在无禁忌证的情况下,非中央型的鳞状细胞癌推荐使用安罗替尼(2A类推荐证据)。
(4)鳞状细胞癌驱动基因阴性或不详患者的治疗。PS评分0~2分、驱动基因阴性的鳞状细胞癌患者一线治疗进展后,如果未接受过免疫治疗,推荐二线治疗使用纳武单抗(nivolumab)(1类推荐证据)。PS评分0~2分驱动基因阴性的鳞状细胞癌患者一线进展后也可使用多西他赛单药化疗(1类推荐证据)。三线在无禁忌证的情况下,非中央型鳞状细胞癌患者推荐使用安罗替尼(2A类推荐证据),对于PS评分>2分的患者,二线建议最佳支持治疗。后线建议最佳支持治疗。
5.4 寡病灶转移的Ⅳ期NSCLC患者的治疗
寡转移是指单个器官的孤立转移病灶,寡转移又分为同时性寡转移和异时性寡转移。同时性寡转移是指初次确诊时已经出现的寡转移灶,异时性寡转移是指经过治疗后一段时间出现的寡转移灶。NSCLC寡转移的治疗目前尚缺乏大样本的前瞻性随机对照临床研究数据,多为小样本回顾性研究,证据级别不高。但可以明确的是,外科、放疗等局部治疗手段可以给部分寡转移患者带来临床获益,多学科综合治疗策略可以使肺癌寡转移患者获益最大化。
肺部手术前存在孤立性脏器(脑、肾上腺或骨)转移者,应根据肺部病变分期原则进行手术或放疗和术后治疗。孤立性脏器转移灶治疗按照部位进行:(1)脑或肾上腺转移者积极行局部治疗,包括手术切除脑或肾上腺转移瘤,或者脑或肾上腺转移瘤行放疗/立体定向放疗(SRT)(2A类推荐证据)。若患者已合并明显的中枢神经系统症状,影像学检查提示有脑转移瘤压迫水肿显著或中性结构偏移严重等情况,建议先行脑转移瘤手术解除颅脑问题,择期再行肺原发瘤手术(2A类推荐证据)。(2)骨转移者接受放疗联合双膦酸盐治疗。对于承重骨转移推荐转移灶手术加放疗(2A类推荐证据)。
肺部手术后出现孤立性脏器(脑、肾上腺或骨)转移者,应根据孤立性脏器转移灶部位进行治疗:(1)脑转移或肾上腺转移者积极行局部治疗,包括手术切除脑或肾上腺转移瘤,或者脑或肾上腺转移瘤行放疗/SRT,根据情况联合全身治疗(2A类推荐证据)。(2)骨转移者接受放疗联合双膦酸盐治疗。对于承重骨转移患者推荐转移灶手术加放疗,根据情况联合全身治疗(2A类推荐证据)。
总之,对于寡转移晚期NSCLC患者,在全身规范治疗基础上,应采取积极的局部治疗,使患者生存获益达到最大化。
5.5 SCLC和LCNEC的治疗
5.5.1 SCLC患者的治疗
(1)局限期SCLC患者的治疗(图10)。①可手术局限期SCLC患者(T1~2N0)的治疗:经系统的分期检查后提示无纵隔淋巴结转移的T1~2N0患者,推荐根治性手术,术式为肺叶切除术+肺门、纵隔淋巴结清扫术(2A类推荐证据);术后病理提示N0的患者推荐辅助化疗,方案包括依托泊苷+顺铂、依托泊苷+卡铂(2A类推荐证据);术后病理提示N1和N2的患者,推荐行辅助化疗合并胸部放疗(2A类推荐证据),同步或序贯均可。辅助化疗方案推荐依托泊苷+顺铂(1类推荐证据)。可以根据患者的实际情况决定是否行预防性脑照射(prophylactic cranial irradiation,PCI)(1类推荐证据)。②不可手术局限期SCLC患者(超过T1~2N0或不能手术的T1~2N0)的治疗:美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)PS评分0~2分的患者:化疗同步胸部放疗为标准治疗(1类推荐证据)。化疗方案为依托泊苷+顺铂(1类推荐证据)和依托泊苷+卡铂(1类推荐证据)。胸部放疗应在化疗的第1个至第2个周期尽早介入。如果患者不能耐受,也可行序贯化放疗。放疗最佳剂量和方案尚未确定,推荐胸部放疗总剂量为45 Gy,1.5 Gy/次,2次/d,3周;或总剂量为60~70 Gy,1.8~2.0 Gy/次,1次/d,6~8周。对于特殊的临床情况,如肿瘤巨大、合并肺损害、阻塞性肺不张等,可考虑2个周期化疗后进行放疗。放化疗后疗效达完全缓解或部分缓解的患者,可考虑行PCI(1类推荐证据)。ECOG PS评分3~4分(由SCLC所致)患者:应充分综合考虑各种因素,谨慎选择治疗方案,如化疗(单药方案或减量联合方案),如果治疗后PS评分能达到2分以上,可考虑给予同步或序贯放疗,如果PS评分仍无法恢复至2分以上,则根据具体情况决定是否采用胸部放疗。放化疗后疗效达完全缓解或部分缓解的患者,可考虑行PCI(1类推荐证据)。ECOG PS评分3~4分(非SCLC所致)患者:推荐最佳支持治疗。
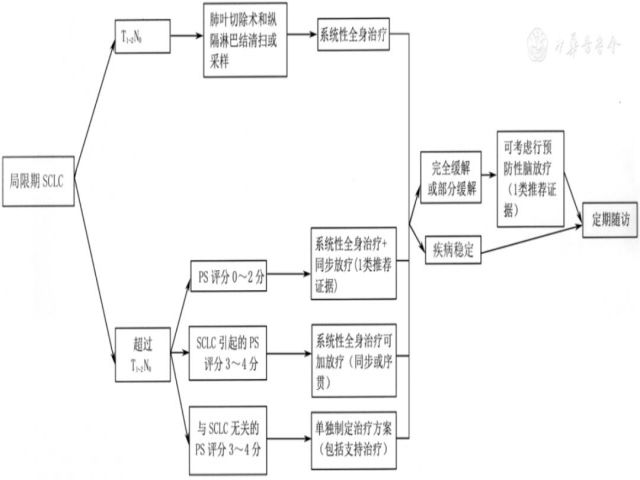
注:若未特别标注,所有推荐均为2A类推荐证据;SCLC为小细胞肺癌;PS为功能状态
▲图10 局限期SCLC治疗流程图
(2)广泛期SCLC患者的一线治疗(图11)。①无症状或无脑转移的广泛期SCLC患者的治疗:ECOG PS评分0~2分或3~4分(由SCLC所致)患者:推荐化疗+支持治疗。化疗方案包括EP方案(依托泊苷+顺铂)(1类推荐证据)、EC方案(依托泊苷+卡铂)(1类推荐证据)、IP方案(伊立替康+顺铂)(1类推荐证据)、IC方案(伊立替康+卡铂)(1类推荐证据),也可以选择依托泊苷+洛铂(2A类推荐证据)。化疗后疗效达完全缓解或部分缓解的患者,如果远处转移灶得到控制,且一般状态较好,可以加用胸部放疗(2A类推荐证据);酌情谨慎选择PCI(2A类推荐证据)。ECOG PS评分3~4分(非SCLC所致)患者:推荐最佳支持治疗。②有症状的广泛期SCLC患者的治疗:对于上腔静脉综合征,临床症状严重者推荐先放疗后化疗(2A类推荐证据);临床症状较轻者推荐先化疗后放疗(2A类推荐证据),同时给予吸氧、利尿、镇静、止痛等对症治疗。局部放疗的放射野应包括原发灶、整个纵隔区及两锁骨上区,要将上腔静脉包括在照射野内;放疗初期可有局部水肿加重,可配合激素和利尿剂辅助治疗;首次化疗剂量要大,应具有冲击性。放化疗结束后,根据患者具体情况决定是否行PCI(2A类推荐证据)。对于脊髓压迫症,如无特殊情况,患者应首先接受局部放疗,控制压迫症状,并给予EP方案、EC方案、IP方案或IC方案化疗(2A类推荐证据)。由于脊髓压迫症的患者生存期较短,生命质量较差,所以对于胸部放疗和PCI的选择需综合考量多方因素,慎重选择(如完全缓解或部分缓解的患者可以放疗),但通常不建议手术减压治疗。对于骨转移,推荐EP方案、EC方案、IP方案或IC方案化疗+局部姑息外照射放疗±双膦酸盐治疗(2A类推荐证据);骨折高危患者可采取骨科固定。对于阻塞性肺不张,推荐EP方案、EC方案、IP方案或IC方案化疗+胸部放疗(2A类推荐证据)。2个周期化疗后进行放疗是合理的,其易于明确病变范围,缩小照射体积,使患者能够耐受和完成放疗。③脑转移患者的治疗:对于无症状脑转移患者,推荐EP方案、EC方案、IP方案或IC方案化疗,全身化疗结束后接受全脑放疗(2A类推荐证据),治疗后疗效达完全缓解或部分缓解的患者,可给予胸部放疗(2A类推荐证据)。对于有症状脑转移患者,推荐全脑放疗与EP方案、EC方案、IP方案或IC方案化疗序贯进行(2A类推荐证据),治疗后疗效达完全缓解或部分缓解的患者,可给予胸部放疗(2A类推荐证据)。
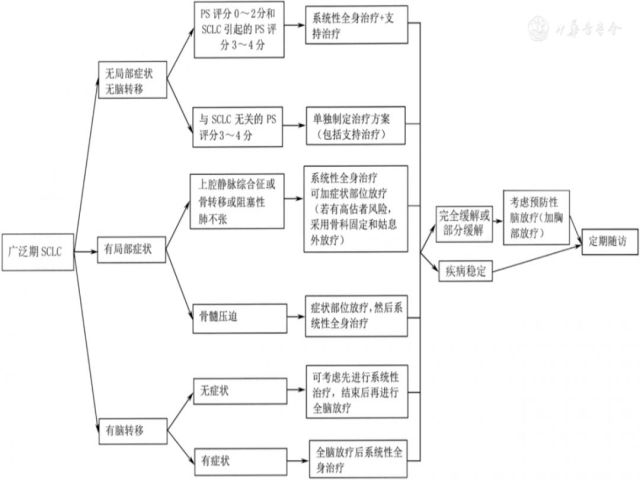
注:若未特别标注,所有推荐均为2A类推荐证据;SCLC为小细胞肺癌;PS为功能状态
▲图11 广泛期SCLC治疗流程图
(3)SCLC患者的PCI。制定PCI的治疗决策时应与患者及家属充分沟通,根据患者的具体情况,权衡利弊后确定。对于完全切除的局限期SCLC,根据实际情况决定是否接受PCI治疗(1类推荐证据);对于获得完全缓解、部分缓解的局限期SCLC,推荐PCI(1类推荐证据);对于广泛期SCLC,酌情考虑PCI(2A类推荐证据)。不推荐年龄>65岁、有严重的合并症、PS评分>2分、神经认知功能受损的患者行PCI。PCI应在化放疗结束后3周左右时开始,PCI之前应该行脑增强MRI检查,如证实无脑转移,可开始PCI。PCI的剂量为25 Gy,2周内分10次完成。
(4)二线治疗(图12)。①一线治疗后6个月内复发的ECOG PS评分0~2分患者:推荐选择静脉或口服拓扑替康化疗(2A类推荐证据),也可推荐患者参加临床试验或选用以下药物,包括伊立替康(2A类推荐证据)、紫杉醇(2A类推荐证据)、多西他赛(2A类推荐证据)、长春瑞滨(2A类推荐证据)、吉西他滨(2A类推荐证据)、替莫唑胺(2A类推荐证据)、环磷酰胺联合多柔比星及长春新碱(2A类推荐证据)。ECOG PS评分2分的患者可酌情减量或应用生长因子支持治疗。②一线治疗后6个月以上复发患者:选用原一线治疗方案。
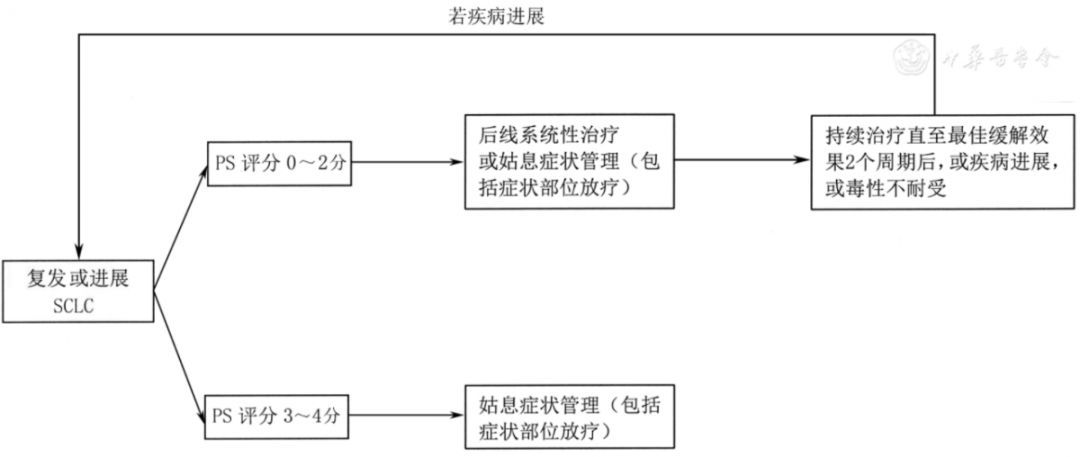
注:若未特别标注,所有推荐均为2A类推荐证据;SCLC为小细胞肺癌;PS为功能状态
▲图12 复发或进展SCLC治疗流程图
(5)老年SCLC患者的治疗。对于老年SCLC患者,不能仅根据年龄确定治疗方案,根据机体功能状态指导治疗更有意义。如果老年患者有日常生活自理能力、体力状况良好、器官功能相对较好,应当接受标准联合化疗(如果有指征也可放疗),但因老年患者可能出现骨髓抑制、乏力和器官功能储备较差的概率更高,所以在治疗过程中应谨慎观察,以避免过高的风险。
5.5.2 肺LCNEC患者的治疗
肺LCNEC的发病率低,占肺癌的3%,目前尚无统一的治疗标准,推荐参考非鳞状细胞NSCLC的治疗原则,内科治疗可采用依托泊苷+铂类方案治疗(2B类推荐证据)。
6 随访
6.1 Ⅰ~Ⅱ期(初始治疗为外科手术±化疗或SBRT治疗后)和可手术切除ⅢA期NSCLS R0切除术后,无临床症状或症状稳定者
6.1.1 治疗结束后的前3年
3~6个月随访1次;吸烟情况评估(鼓励患者戒烟);病史、体格检查、胸部CT±增强扫描。
6.1.2 治疗结束后第4、5年
每年随访1次;吸烟情况评估(鼓励患者戒烟);病史、体格检查、胸部CT±增强扫描。
6.1.3 治疗结束后5年以上
每年随访1次;吸烟情况评估(鼓励患者戒烟);病史、体格检查;低剂量非增强胸部CT(2B类推荐证据)。
6.2 局部晚期NSCLC(不可手术的ⅢA期和ⅢB期)放化疗后、无临床症状或症状稳定者
6.2.1 治疗结束后的前3年
3~6个月随访1次;吸烟情况评估(鼓励患者戒烟);病史、体格检查、胸腹部CT±增强扫描(在12个月和24个月时最好进行增强扫描)。
6.2.2 治疗结束后第4、5年
6个月随访1次;病史、体格检查、胸腹部CT±增强扫描。
6.2.3 治疗结束后5年以上
每年随访1次;病史、体格检查、胸腹部增强CT扫描(2B类推荐证据)。
6.3 Ⅳ期NSCLC患者全身治疗结束后
6.3.1 无临床症状或症状稳定者
每8~12周随访1次;病史、体格检查、胸腹部增强CT;伴有脑、骨转移者需复查脑MRI和全身骨扫描;参加临床研究者,随访应遵循临床研究方案进行。
6.3.2 临床出现新的症状和(或)症状加重者
立即随诊,是否行CT、MRI检查由临床医师决定(2B类推荐证据)。
中华医学会肺癌临床诊疗指南(2018版)专家委员会
顾问(按姓氏汉语拼音排序) 赫捷(中国医学科学院肿瘤医院)、孙燕(中国医学科学院肿瘤医院)、于金明(山东省肿瘤医院)
名誉主任委员 徐惠绵(中国医科大学附属第一医院)
主任委员(按姓氏汉语拼音排序) 高树庚(中国医学科学院肿瘤医院)、韩宝惠(上海市胸科医院)、林冬梅(北京大学肿瘤医院)、邢力刚(山东省肿瘤医院)
委员(按姓氏汉语拼音排序) 白冲(上海长海医院)、白春梅(北京协和医院)、操乐杰(安徽省立医院)、常建华(复旦大学附属肿瘤医院)、程颖(吉林省肿瘤医院)、范云(浙江省肿瘤医院)、方文涛(上海市胸科医院)、冯继锋(江苏省肿瘤医院)、傅小龙(上海市胸科医院)、郭其森(山东省肿瘤医院)、韩昱晨(上海市胸科医院)、焦顺昌(解放军总医院)、李函玥(上海市胸科医院)、李凯(天津市肿瘤医院)、李晓琳(山东省肿瘤医院)、刘晓晴(解放军第三○七医院)、刘怡茜(江苏省人民医院)、柳菁菁(吉林省肿瘤医院)、邱斌(中国医学科学院肿瘤医院)、任丽(天津市肿瘤医院)、邵晋晨(上海市胸科医院)、束永前(江苏省人民医院)、宋秀宇(天津市肿瘤医院)、孙冰生(天津市肿瘤医院)、滕昊华(上海市胸科医院)、庹培昱(天津市肿瘤医院)、王洁(中国医学科学院肿瘤医院)、王晶(天津市肿瘤医院)、王瑞(上海市胸科医院)、吴凤英(上海市肺科医院)、吴世凯(解放军第三○七医院)、肖建宇(天津市肿瘤医院)、徐文贵(天津市肿瘤医院)、姚烽(上海市胸科医院)、于壮(青岛大学附属医院)、张帆(中国医学科学院肿瘤医院)、张琴(上海市胸科医院)、张新(复旦大学附属中山医院)、赵亮(中国医学科学院肿瘤医院)、钟华(上海市胸科医院)、钟润波(上海市胸科医院)、周彩存(上海市肺科医院)、周德俊(天津市肿瘤医院)
学术秘书(按姓氏汉语拼音排序) 高启翔(中华医学会杂志社)、郝秀原(中华医学会杂志社)、牛艳洁(上海市胸科医院)、钱洁(上海市胸科医院)、杨婷婷(中华医学会杂志社)
本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论