子宫内膜癌诊治规范(2018年版)
一、概述
子宫内膜癌是发生于子宫内膜的一组上皮性恶性肿瘤,又称子宫体癌,是女性生殖道三大常见恶性肿瘤之一。其多发生于围绝经期及绝经后妇女。随着人口平均寿命的增加以及生活习惯的改变,子宫内膜癌的发病率近20年呈持续上升和年轻化趋势。在西方国家,子宫内膜癌已经占据女性生殖系统恶性肿瘤发病率首位,在我国,作为继宫颈癌之后第二个常见的妇科恶性肿瘤,约占妇科恶性肿瘤的20%~30%。部分发达城市的子宫内膜癌发病率已达妇科恶性肿瘤第一位。
二、诊断技术和应用
(一)危险因素人群的监测筛查
根据发病机制和生物学行为特点将子宫内膜癌分为雌激素依赖型(Ⅰ型)和非雌激素依赖型(Ⅱ型)。雌激素依赖型子宫内膜癌大部分病理类型为子宫内膜样腺癌,少部分为黏液腺癌;非雌激素依赖型子宫内膜癌病理类型包括浆液性癌、黏液性癌、透明细胞癌、癌肉瘤等。
大部分子宫内膜癌属于雌激素依赖型。Ⅰ型子宫内膜癌的发生与无孕激素拮抗的雌激素持续刺激直接相关。缺乏孕激素对抗,子宫内膜长期处于过度增生的状态,进一步发展为子宫内膜癌。Ⅱ型子宫内膜癌的发生机制至今尚不完全不清楚。
主要危险因素如下。
1.生殖内分泌失调性疾病:如无排卵性月经异常、无排卵性不孕、多囊卵巢综合征(PCOS)等。由于无周期性排卵,子宫内膜缺乏孕激素拮抗,长期的单一雌激素作用致使子宫内膜发生增生,甚至癌变。
2.肥胖、高血压、糖尿病,又称为子宫内膜癌三联征:有研究表明体重指数(BMI)每增加1个单位(kg/m2),子宫内膜癌的相对危险增加9%。与BMI<25的女性相比,BMI在30~35期间的女性发生子宫内膜癌的风险大约增加1.6倍,而BMI>35的女性发生子宫内膜癌的风险增加3.7倍。糖尿患者或糖耐量不正常者患病风险比正常人增加2.8倍;高血压者增高1.8倍。
3.初潮早与绝经晚:晚绝经的妇女在后几年大多为无排卵月经,因此延长了无孕激素协同作用的雌激素刺激时间。
4.不孕不育:不孕不育会增加子宫内膜癌的风险,而与之相反,每次妊娠均可一定程度降低子宫内膜癌的发病风险。此外,末次妊娠年龄越高患子宫内膜癌的概率也越低。
5.卵巢肿瘤:有些卵巢肿瘤,如卵巢颗粒细胞瘤、卵泡膜细胞瘤等,常产生较高水平的雌激素,引起月经不调、绝经后出血、子宫内膜增生甚至内膜癌。应对存在上述疾病患者常规行子宫内膜活检。
6.外源性雌激素:单一外源性雌激素治疗如达5年以上,发生子宫内膜癌的风险增加10~30倍。采用雌孕激素联合替代治疗则不增加罹患内膜癌的风险。
7.遗传因素:约20%内膜癌患者有家族史。遗传性非息肉样结肠直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC,又称Lynch综合征)患者发生结肠外癌的风险增高,主要包括子宫内膜癌、卵巢癌和胃癌等。Lynch综合征相关子宫内膜癌占全部子宫内膜癌2%~5%,有Lynch综合征的女性,其终生发生子宫内膜癌的风险为70%。有子宫内膜癌家族史的其他家庭成员子宫内膜癌的发生危险也相应增加,一级亲属患子宫内膜癌的女性发生子宫内膜癌的风险大约为对照组的1.5倍。
8.其他:三苯氧胺是一种选择性雌激素受体修饰剂,既可表现出类雌激素作用,也可表现为抗雌激素作用,与不同的靶器官有关。三苯氧胺是乳腺癌内分泌治疗药物,有研究表明,长期服用可导致内膜增生,发生子宫内膜癌危险性增加。
9.生活方式:目前已知有些生活方式因素与子宫内膜癌相关,包括饮食习惯、运动、饮酒、吸烟等。
为减少子宫内膜癌的发生,应对有危险因素的人群进行宣教,包括规范生活习惯、在医师指导下的HRT等。对存在上述子宫内膜癌的危险因素者,对有遗传性家族史的患者、长期口服三苯氧胺的乳腺癌患者等坚持定期检查。但目前为止,尚没有推荐的可以对子宫内膜癌进行常规筛查的手段。超声是可选择的检查方法。主要筛查方式为经阴道或经腹超声,监测子宫内膜厚度及异常情况。血液学方面没有特异性血清标志物,因此无常规监测筛查指标。
(二)临床表现
1.发病年龄
70%~75%的患者为绝经后妇女,平均年龄约55岁。
2.症状
(1)阴道流血:少数早期子宫内膜癌可能无任何症状,临床上难以发现。但90%子宫内膜癌的主要症状为各种阴道流血。
1)绝经后阴道流血:绝经后阴道流血为子宫内膜癌患者的主要症状,90%以上的绝经后患者以阴道流血症状就诊。阴道流血于肿瘤早期即可出现,因此,初次就诊的子宫内膜癌患者中早期患者约占70%。
2)月经紊乱:约20%的子宫内膜癌患者为围绝经期妇女,40岁以下的年轻妇女仅占5%~10%。患者可表现为月经周期紊乱,月经淋漓不尽甚至阴道大量出血。
(2)阴道异常排液:早期可为少量浆液性或血性分泌物。晚期因肿瘤体积增大发生局部感染、坏死,排出恶臭的脓血样液体。
(3)疼痛:多为下腹隐痛不适,可由宫腔积脓或积液引起,晚期则因病变扩散至子宫旁组织韧带或压迫神经及器官,还可出现下肢或腰骶部疼痛。
(4)其他:晚期患者可触及下腹部增大的子宫,可出现贫血 、消瘦、发热 、恶病质等全身衰竭表现。
3.体征
在子宫内膜癌早期,多数患者没有明显的相关阳性体征。因多数患者合并糖尿病、高血压或心血管疾病,因此应关注相关系统体征。一般查体中,应注意是否因长期失血导致贫血而出现贫血貌。触诊锁骨上、颈部及腹股沟淋巴结是否肿大。
专科查体时应行妇科三合诊检查。早期患者盆腔检查大多正常,有些患者子宫质地可稍软。晚期病变侵及宫颈、宫旁组织韧带、附件或淋巴结显著增大者,三合诊检查可触及宫颈或颈管质硬或增大、主韧带或骶韧带增厚及弹性下降、附件肿物以及盆壁处肿大固定的淋巴结。
(三)辅助检查
子宫内膜癌的辅助诊断技术包括经腹或经阴道超声、MRI、CT、PET-CT检查等。血清肿瘤标记物检查也有助于鉴别良恶性病变。但最终确诊需要依赖病理学检查。
1.血液生化检查
子宫内膜癌可以出现血色素下降。因多数患者合并糖尿病、高血压或心血管疾病,需重视血糖、血脂等方面结果。还要进行肝肾功能检查。
2.肿瘤标志物检查
子宫内膜癌无特异敏感的标志物。部分患者可出现CA125或CA19-9、CA153或HE4异常,与组织学类型、肌层浸润深度及子宫外受侵等因素具有相关性,对疾病诊断及术后病情监测有一定的参考价值。
3.影像学检查
(1)超声检查:目前比较强调绝经后出血患者进行超声检查作为初步检查。经阴道超声检查(TVS)可以了解子宫大小、宫腔内有无赘生物、内膜厚度、肌层有无浸润、附件肿物大小及性质等,为最常用的无创辅助检查方法。绝经后妇女内膜厚度<5mm时,其阴性预测值可达96%。如子宫内膜厚度>5mm时,应对绝经后患者进行子宫内膜活检。
(2)磁共振(盆腔MRI):是子宫内膜癌首选影像学检查方法。MRI能够清晰显示子宫内膜及肌层结构,用于明确病变大小、位置,肌层侵犯深度、宫颈、阴道是否侵犯,是否侵犯子宫体外、阴道、膀胱及直肠,以及盆腔内的肿瘤播散,观察盆腔、腹膜后区及腹股沟区的淋巴结转移情况。有助于肿瘤的鉴别诊断(如内膜息肉、黏膜下肌瘤、肉瘤等)。评价化疗的疗效及治疗后随诊。
(3)电子计算机断层成像(CT):CT对早期病变诊断价值仍有限。CT优势在于显示中晚期病变,评价病变侵犯子宫外、膀胱、直肠情况,显示腹盆腔、腹膜后及双侧腹股沟区淋巴结转移、以及腹盆腔其他器官及腹膜转移情况。对于有核磁禁忌证的患者应选择CT扫描。子宫内膜癌常规行胸部X线摄片,但为了排除肺转移,必要时应行胸部CT检查。
(4)正电子发射计算机断层成像(PET-CT):较少用于子宫内膜癌初诊患者。但存在下列情况时,可推荐有条件者在疗前使用PET-CT:① 有临床合并症不适合行手术治疗的患者;②可疑存在非常见部位的转移,比如骨骼或中枢神经系统;③活检病理提示为高级别肿瘤,包括低分化子宫内膜癌、乳头状浆液性癌、透明细胞癌和癌肉瘤。PET-CT不推荐常规应用于子宫内膜癌治疗后的随访,仅当可疑出现复发转移时考虑行PET-CT检查。
4.子宫内膜活检
子宫内膜的组织病理学检查是诊断的最后依据。获取子宫内膜的方法主要为诊断性刮宫和宫腔镜下活检。
诊断性刮宫应分别从宫颈管和宫腔获得组织,即分段诊刮术。以便了解宫腔和宫颈管情况。
宫腔镜直视下活检可直接观察宫内及颈管内病灶的外观形态、位置和范围,对可疑病灶进行直视下定位活检或切除,降低了漏诊率。适用于病变局限者。但膨宫液可能导致部分肿瘤细胞循输卵管进入腹腔,其是否导致腹腔种植病灶的发生尚有争议。
子宫内膜活检的指征包括:绝经后或绝经前不规则阴道出血或血性分泌物,排除宫颈病变者;无排卵性不孕症多年的患者;持续阴道排液者;影像学检查发现子宫内膜异常增厚或宫腔赘生物者。对一些能产生较高水平的雌激素的卵巢肿瘤患者,如颗粒细胞瘤等,也应行子宫内膜活检。
5. 细胞学检查
子宫内膜细胞在月经期外不易脱落,而宫腔脱落的癌细胞容易发生溶解、变性,染色后不易辨认,因此,阴道脱落细胞学检查阳性率不高。另一种方法为经宫腔获取内膜脱落细胞,常用子宫内膜细胞采集器结合液基细胞学制片技术,准确性较高。
(四)子宫内膜癌的诊断标准
病理学诊断标准:子宫内膜的组织病理学检查及子宫外转移灶活检或手术切除组织标本,经病理组织学诊断为子宫内膜癌,此为金标准。
(五)鉴别诊断
(1)异常性子宫出血:以经期延长、经量增多或阴道不规则出血为特点,与子宫内膜癌症状相似。对于此类患者,尤其是围绝经期患者及合并不孕、月经稀发或PCOS的年轻患者,即使妇科检查无阳性发现,亦应获取子宫内膜进行病理学检查排除内膜癌变。
(2)老年性阴道炎:常见于绝经后女性,表现为血性白带。查体阴道黏膜萎缩变薄、充血、可见出血点,激素局部治疗后可好转。对此类患者,需先行超声及宫颈细胞学检查排除内膜增厚、内膜赘生物及宫颈病变。
(3)子宫内膜息肉或黏膜下子宫肌瘤:表现为月经过多或经期延长,或出血同时伴有阴道排液或血性分泌物,与子宫内膜癌相似。超声或MRI检查可见宫腔内赘生物,宫腔镜检查及赘生物切除后可明确病理诊断。
(4)子宫颈癌、子宫肉瘤及输卵管癌:上述疾病也可表现为不规则阴道流血及排液。颈管型宫颈癌经三合诊可触及宫颈管增粗、质硬呈桶状,分段诊刮病理学检查及免疫组化有助于诊断。如术前无法鉴别可行人乳头瘤状病毒(human papillomavirus,HPV)DNA检测,如HPV阳性则倾向为宫颈癌。子宫肉瘤有子宫短期内增大,变软,超声及MRI可见肿物大多位于子宫肌层,有助于初步判断。输卵管癌以阵发性阴道排液、阴道出血、腹痛为主要症状,查体可触及附件区包块,影像学检查子宫内膜多无异常。
(六)病理学诊断
病理学是子宫内膜癌诊断的金标准。
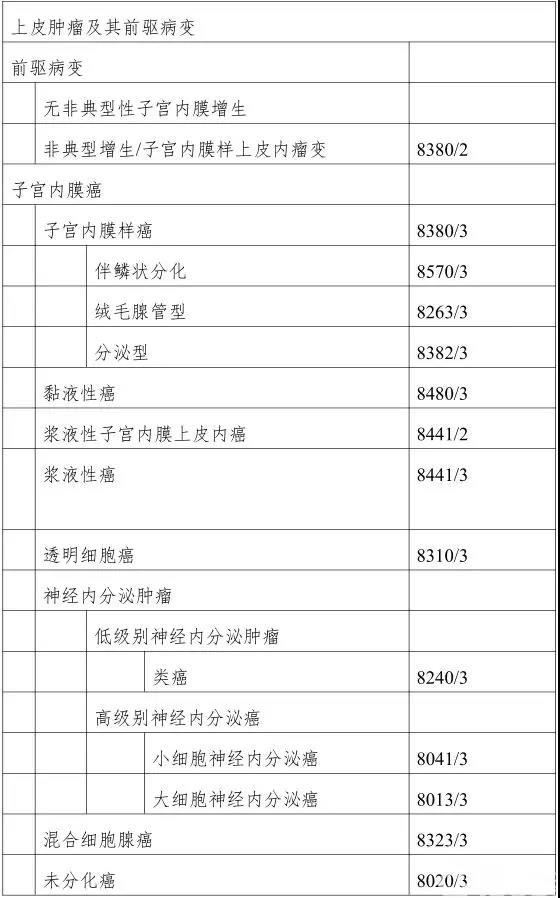
根据2014版女性生殖器官肿瘤分类的划分,子宫内膜癌的病理类型包括
1. 癌前病变
在2014版女性生殖器官肿瘤分类中将子宫内膜增生分为两类,即非典型增生和不伴有非典型性的增生两类。
无非典型性的子宫内膜增生是指腺体和内膜间质的比例失调,内膜腺体增多,腺体形状不规则,但没有细胞学的非典型性。约有1%~3%的无非典型的子宫内膜增生可以进展为分化好的内膜样腺癌。
非典型增生子宫内膜是指腺体上皮细胞具有细胞学上的非典型性(atypical hyperplasia,AH)以及子宫内膜上皮内瘤(endometrioid intraepithelial neoplasia,EIN)。活检标本中AH/EIN中约1/4~1/3的患者在快速病理中即可以见到内膜样癌。长期危险因素评估中显示从AH发生癌变的概率为14倍,而EIN则为45倍左右。
2.子宫内膜癌
在病理诊断时,应明确以下5种主要病理类型。
(1)子宫内膜样癌(endometrioid carcinoma):是最常见的子宫内膜癌的组织学类型(约占子宫内膜癌的60%~65%。子宫内膜样癌通常表现腺性或绒毛腺管状结构,伴有拥挤复杂的分支结构。核非典型性常为轻度至中度,核仁不明显,但分化差的癌除外。核分裂指数变化很大。间质浸润是区分高分化子宫内膜样癌与AH/EIN的关键,表现为缺乏分隔间质(腺体融合或筛状结构)、子宫内膜间质改变(促结缔组织反应)或乳头状结构(绒毛腺性结构)。
子宫内膜样癌伴鳞状分化:10%~25%的子宫内膜样癌可见到灶性鳞状分化。鳞状分化灶可位于间质交界处,或呈桑椹状,桥接相邻腺体。对鳞状分化的识别非常重要,必须与子宫内膜样癌分级时所描述的实性生长区域相鉴别。
子宫内膜样癌伴分泌性改变:典型的伴有分泌改变的子宫内膜样癌几乎总是高分化癌。这种现象偶可见于年轻的生育期女性,或接受孕激素治疗者,但多数为绝经后且未接受孕激素治疗者。
分级:子宫内膜样癌组织学分级主要依据肿瘤中的实性范围来分级,以帮助判断预后并选择合理的治疗方案。标准如下:1级,实性生长区≤5%;2级,实性生长区占6%~50%;3级,实性生长区>50%。表现为3级核的区域超过瘤体50%者更具侵袭性,这样的肿瘤在分级时应上升1级。
(2)黏液性癌(mucinous carcinoma)
黏液性癌衬覆一致的黏液柱状上皮,复层排列轻微。黏液表现为嗜碱性小球,或为稍淡染的颗粒状胞质,黏液卡红和CEA阳性,有丝分裂活性低。肌层浸润一般仅限于内1/2。免疫组织化学检查有助于鉴别子宫颈管内膜癌。在绝经或围绝经期女性的子宫内膜活检标本中,由于缺乏相应的子宫内膜间质,增生的黏液性病变常难以与非典型增生和高分化子宫内膜癌鉴别。若存在腺体融合或筛状结构,即使细胞学非典型性轻微,也应诊断为癌。
(3)浆液性癌(serous carcinoma)
浆液性癌可表现为复杂的乳头和(或)腺性结构,伴有弥漫而显著的核多形性。浆液性癌多有TP53突变,因此p53异常表达(至少75%瘤细胞弥漫强阳性表达,或完全不表达),有助于与高级别子宫内膜样癌鉴别,后者常呈野生型TP53的表达模式,表现为不足75%的瘤细胞不同程度阳性表达p53,但少数高级别子宫内膜样癌也可伴有TP53突变。Ki-67指数非常高者倾向于浆液性癌,但与TP53突变一样,也不能完全除外高级别子宫内膜样癌。一部分子宫内膜样癌中可以伴有浆液性癌,称为这混合性浆液性-子宫内膜样癌,其预后取决于其中的浆液性癌成分。子宫内膜浆液性上皮内癌(SEIC)常直接发生于息肉表面或萎缩性子宫内膜中,但不出现子宫肌层及间质侵犯,这些异型肿瘤细胞对TP53呈强阳性表达,这种癌细胞也可脱落并发生子宫外广泛转移。SEIC并非为子宫浆液癌的癌前病变,患者的预后取决于手术后的临床分期,临床需要按浆液性癌来处理。
(4)透明细胞癌(clear cell carcinoma)
透明细胞的特征是出现多角形或鞋钉样细胞,胞质透明,少数为嗜酸性胞质,这些细胞排列成管囊状、乳头状或实性结构。约2/3的病例可见胞外致密的嗜酸性小球或透明小体。透明细胞癌倾向于高度恶性,组织学上不再进行分级,诊断时常处于晚期病变。
(5)神经内分泌肿瘤(neuroendocrine tumorus)
具有神经内分泌形态学表现的一组异质性肿瘤。分为两大组:低级别神经内分泌肿瘤,其组织学表现为类癌,形态同胃等器官发生在同名肿瘤;高级别神经内分泌癌,又分为两种类型:小细胞神经内分泌癌和大细胞神经内分泌癌,前者类似于肺小细胞癌,后者细胞大,多角形,核空泡状或深染,单个显著核仁,有丝分裂活性高,可见广泛的地图状坏死。
(6)混合细胞腺癌(mixed cell adenocarcinoma)
是指混合有2种或2种以上病理类型的内膜癌,至少有1种是Ⅱ型子宫内膜癌。并且第二种成分至少要达到5%。此类型的内膜癌的预后取决于混合成分中的高级别癌的成分,即使只有5%的浆液性癌混合在普通型的内膜样腺癌中,预后仍然较差。混合性癌时应在病理报告中详细说明各型肿瘤的组织类型以及所占的比例。
(7)未分化癌和去分化癌(undifferentiated carcinoma and dedifferentiated carcinoma)
子宫内膜未分化癌是一种没有分化方向的上皮性恶性肿瘤。细胞缺乏黏附性,大小相对一致,小至中等大小,成片排列,无任何明显的巢状或小梁状结构,无腺样结构。大多数病例核分裂像>25个/10HPF。在背景中偶可见到多形性核。去分化癌由未分化癌和FIGO1级或2级子宫内膜样癌混合构成。分化型子宫内膜样成分一般衬覆于子宫腔面,而未分化癌成分在其下方生长。
子宫内膜的病理报告强调规范化和标准化。内容应包括肿瘤分化程度、组织学类型、浸润深度、侵犯范围(是否侵犯宫颈管间质、宫旁、附件、阴道、膀胱、直肠等)、宫颈或阴道切缘、宫旁切缘、淋巴结转移情况、免疫组化以及分子病理学指标等。此外,还可附有与子宫内膜癌药物靶向治疗、生物学行为、错配修复基因突变以及判断预后等相关的分子标志物的检测结果,提供临床参考。
三、子宫内膜癌的分类及分期
(一)子宫内膜癌的组织学分类
表1 子宫内膜癌及癌前病变组织学分类(WHO,2014)

(二)子宫内膜癌的分期
手术-病理分期能较全面准确地反映子宫内膜癌的转移浸润状况,并由此制定正确的术后治疗方案,便于不同的肿瘤治疗中心进行疗效的比较。目前采用国际妇产科联盟(Federation of International Gynecology Obstetrics,FIGO)2009年发布的手术病理分期标准(表2)。
但不是全部的子宫内膜癌患者都适合行目前推荐的手术-病理分期,如部分年轻的希望保留生育功能的患者;有严重的内科疾患、且有手术禁忌征的患者;单纯放疗或因宫颈肿瘤累及而需要术前放疗患者,这类患者仍采用FIGO1971年发布的临床分期标准(表3)。
表2 子宫内膜癌的国际妇产科联盟(FIGO2009)分期(手术病理分期)
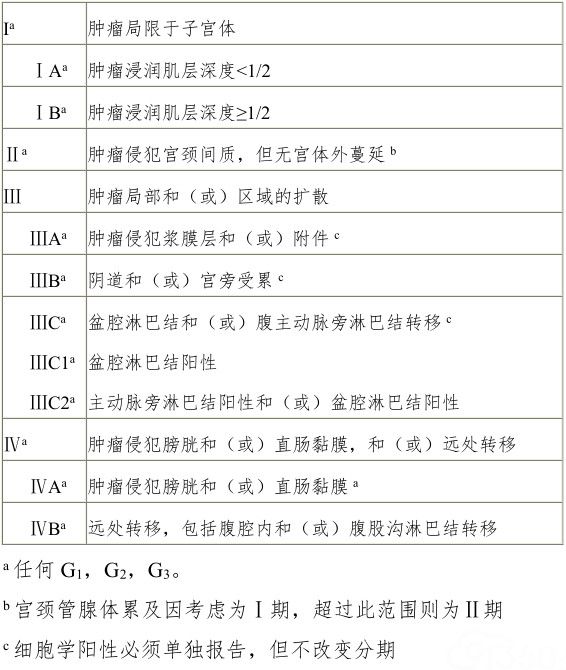
表3 子宫内膜癌临床分期(FIGO 1971)

四、治疗
子宫内膜癌治疗原则:子宫内膜癌的治疗以手术治疗为主,辅以放疗、化疗和激素等综合治疗。治疗方案应根据病理诊断和组织学类型,以及患者的年龄、全身状况、有无生育要求、有无手术禁忌证、有无内科合并症等综合评估以制订治疗方案。手术是子宫内膜癌的主要治疗手段,除不能耐受手术或晚期无法手术的患者外,都应进行全面的分期手术。对于伴有严重内科并发症、高龄等不宜手术的各期子宫内膜癌,可采用放射治疗和药物治疗。严格遵循各种治疗方法指征,避免过度治疗或治疗不足。强调有计划的、合理的综合治疗,并重视个体化治疗。
(一)外科治疗
1.全面分期手术及辅助治疗方式选择
(1)临床Ⅰ期(子宫内膜癌局限于子宫体):①进入盆腹腔后首先行腹腔冲洗液细胞学检查;②术式:筋膜外全子宫双附件切除术±盆腔及腹主动脉旁淋巴结切除术;③根据术后病理明确手术病理分期及辅助治疗的应用。
(2)临床Ⅱ期(子宫内膜癌侵犯宫颈间质):①进入盆腹腔后首先行腹腔冲洗液细胞学检查;②术式:广泛性/改良广泛子宫切除术+双侧附件切除术+盆腔及腹主动脉旁淋巴结切除术;③根据术后病理明确手术病理分期及辅助治疗的应用。
(3)临床Ⅲ期及以上:应以综合治疗为主。建议行包括子宫+双附件切除在内的肿瘤细胞减灭术。手术目标是尽可能达到没有肉眼可测量的病灶;也可考虑新辅助化疗后再手术。病变超出子宫但局限在盆腔内(转移至阴道、膀 胱、肠/直肠、宫旁、淋巴结)无法手术切除者,可行外照射放疗和(或)阴道近距离放疗±全身治疗,也可单纯化疗后再次评估是否可以手术治疗,或者根据治疗效果选择放疗。病变超出腹腔或转移到肝脏者,可行化疗和(或)外照射放疗和(或)激素治疗,也可考虑姑息性子宫+双附件切除术。
(4)Ⅱ型子宫内膜癌:包括浆液性腺癌,透明细胞癌及癌肉瘤。其治疗遵循卵巢癌的手术原则和方式。除包括腹水细胞学检查、全子宫双附件切除术及盆腔淋巴结和腹主动脉旁淋巴结切除术外,还应行大网膜切除术及腹膜多点活检。如为晚期,则行肿瘤细胞减灭术。
(5)分期手术中需行全面探查。推荐入腹后取腹水/腹腔冲洗液细胞学检查并单独报告;电凝或钳夹双侧子宫角处输卵管峡部,避免术中操作造成宫腔内肿瘤循输卵管扩散至盆腔;进行全腹腔至盆腔的全面探查,评估腹膜、膈肌及浆膜层有无病灶,在任何可疑部位取活检 以排除子宫外病变;切除子宫后剖视子宫检查,必要时行冰冻切片病理检查。术中取下子宫后应先剖视,手术记录应明确癌瘤大小、部位(宫底部或子宫下段/宫颈)、肌层浸润深度(占整个肌层的比例),宫颈峡部及双侧附件有无受累等。仍推荐取腹水/腹腔冲洗液细胞学并单独报告。
2.几个特殊问题
(1)全子宫双附件切除术是治疗局限于宫体之内膜癌的主要手术方式,可以应用开腹、经阴道或腹腔镜、机器人腹腔镜等技术。但避免用粉碎器和分块取出子宫。子宫破碎可导致肿瘤溢出,增加局部或腹腔复发风险。
(2)淋巴结切除术和前哨淋巴结活检评估淋巴结状态是全面分期手术的重要组成。临床Ⅰ期中,多数转移为组织学转移而非肉眼转移,因此建议进行系统性淋巴结清扫术。对于术前全面评估病灶局限于子宫内膜层或浅肌层,且为高、中分化的子宫内膜癌患者,淋巴结转移概率低,是否需行淋巴结切除尚有争议。
具备下列任一条件:①盆腔淋巴结阳性;②深肌层浸润;③G3;④浆液性腺癌、透明细胞腺癌或癌肉瘤需评估盆腔淋巴结及至少肠系膜下动脉水平(最好至肾血管水平)的腹主动脉旁淋巴结。有时可以根据患者情况进行选择性进行分区域淋巴结取样或前哨淋巴结定位。若腹膜后淋巴结有明显增大,疑有转移者可行术中冰冻病理,以明确诊断,确定淋巴结手术方式。
前瞻性随机研究发现早期子宫内膜癌淋巴结切除的程度与生存无关。但由于淋巴结切除的数目、范围以及辅助治疗方法的不同,8%~50%子宫内膜癌淋巴清扫后患者会出现下肢淋巴水肿。因此,前哨淋巴结定位逐渐成为手术分期的一种方法。NCCN指南推荐对病变局限子宫的子宫内膜癌可考虑前哨淋巴结活检,以替代系统淋巴结切除术。
(3)年轻子宫内膜癌患者是否保留卵巢:子宫内膜癌发病呈年轻化趋势,对于年轻患者,如果要求保留卵巢,则须符合以下条件:①年龄<40岁;患者要求保留卵巢;②ⅠA期,高分化;③腹腔冲洗液细胞学阴性;④术前和术中评估无可疑淋巴结转移;⑤具有随访条件。
3.手术并发症及处理:经腹全子宫切除术或广泛子宫切除术的主要并发症为周围脏器如输尿管、膀胱、直肠等损伤。术中应该仔细解剖,避免损伤。一旦出现,需要及时行输尿管支架及脏器修补等手术。腹腔镜手术并发症主要为血管、肠管及膀胱损伤和皮下气肿,此外还可发生穿刺孔疝。文献报道腹腔镜穿刺孔疝的发生率为0.2%~3.1%,对直径超过10 mm的穿刺孔予以筋膜层的缝合可以减少疝的发生。其他并发症包括出血(腹腔出血,阴道残端出血)、感染(泌尿系统、盆腹腔、淋巴囊肿感染等)、肠梗阻 、切口裂开、血栓及栓塞等,少数可能出现肿瘤种植转移。术中需严格无菌及无瘤操作。注意缝合、结扎有效及牢固。术后预防性应用抗菌药物,注意术后护理。
(二)放射治疗
除对于不能手术的子宫内膜癌可行根治性放疗,包括体外放疗联合近距离放疗。放射治疗在子宫内膜癌中常为对术后患者的辅助治疗。
1.体外放疗
针对原发肿瘤和盆腔内转移实体肿瘤部位,还要包括髂总、髂外、髂内淋巴结引流区、宫旁及上段阴道和阴道旁组织。宫颈受侵者还应包括骶前淋巴结区。腹主动脉旁淋巴结受侵者行延伸野照射,包括髂总和腹主动旁淋巴结区域。延伸野的上界取决于具体的临床情况,至少达到肾血管水平上1~2cm。NCCN指南建议采用CT图像为基础的多野适形技术或IMRT技术的放疗计划,但需注意精确放疗技术中的质量验证(QA)和分次照射期间的器官移动的问题(详见宫颈癌体外放疗章节内容)。
2.近距离放疗
传统子宫内膜癌的腔内治疗,没有一个公认的剂量参照点。以内膜受量、子宫体肌层[内膜下5mm、10mm或通过A点与子宫中轴平行线的点(A-Line)]作为剂量参照点。现在建议采用三维影像为基础的治疗计划,根据临床肿瘤实际情况个体化给予放疗剂量。治疗靶区包括全部宫体、宫颈和阴道上段组织。2015年美国近距离放疗协会(ABS)提出了CT或MRI引导下的子宫内膜癌根治性放疗靶区的定义。GTV主要是指MRI中T2加权影像中可见病灶范围。CTV是指MRI或CT上的全部宫体、宫颈和阴道上段部分。危及器官OAR需包括MRI或CT中乙状结肠、直肠、膀胱、肠管及未累及的阴道部分。
3.术后辅助治疗的推荐建议
ⅠA(G1),无高危因素:观察,不需辅助治疗。
ⅠA(G1),有高危因素,或ⅠA(G2~3)无高危因素:可随诊观察或腔内放疗。
ⅠA(G2),有高危因素:可随诊观察或腔内放疗±体外放疗(2B类证据)。
ⅠA(G3),有高危因素:腔内放疗±体外放疗±化疗(2B类证据)。
ⅠB(G1~2),无高危因素:可随诊观察或腔内放疗。
ⅠB(G3),无高危因素:腔内放疗±体外放疗±化疗(2B类证据)。
ⅠB(G1~2),有高危因素:可随诊观察或腔内放疗±体外放疗。
ⅠB(G3),有高危因素:体外放疗±腔内放疗±化疗。
Ⅱ(G1):腔内放疗±体外放疗。
Ⅱ(G2):体外放疗+腔内放疗。
Ⅱ(G3):体外放疗±腔内放疗±化疗(2B类证据)。
ⅢA:化疗±体外放疗±腔内放疗。
ⅢB:化疗±体外放疗+腔内放疗。
ⅢC:化疗±体外放疗±腔内放疗。
ⅣA~ⅣB期(减瘤术后无或仅有微小残留者):化疗±体外放疗±腔内放疗。
4.治疗技术及剂量推荐
参照NCCN指南给出子宫内膜癌放疗的治疗手段,包括体外放疗(EBRT)和(或)近距离放疗。放疗前诊断影像评价肿瘤局部区域的范围及是否有远处转移。体外放疗主要针对盆腔包括或不包括腹主动脉旁淋巴结区域。近距离放疗主要针对:①子宫(术前或根治性放疗中);②阴道(全子宫切除术后的辅助治疗中)。
盆腔放疗针对原发肿瘤和盆腔内转移实体肿瘤部位,还要包括髂总、髂外、髂内淋巴结引流区、宫旁及上段阴道和阴道旁组织。宫颈受侵者还应包括骶前淋巴结区。延伸野应该包括盆腔野同时还要针对髂总和腹主动旁淋巴结区域。延伸野的上界取决于具体的临床情况,至少达到肾血管水平。对于放疗野亚临床病灶剂量在45~50Gy。建议采用CT图像为基础的多个适形野技术的放疗计划(详见宫颈癌体外三维放疗章节)。
近距离放疗的剂量也与患者的具体临床分期和肿瘤情况相关。如果宫颈受侵,除了子宫体肌层剂量参考点,还要考虑A点剂量。可参考宫颈癌A点放疗总剂量。如果近距离放疗采用MRI影像勾画靶区,GTV区域的EQD2总剂量≥80Gy。根据不同分期,联合体外放疗,GTV及CTV区域的EQD2总剂量分别达到80~90Gy和48~75 Gy。而OAR限量建议,乙状结肠&直肠D2cc:不超过70~75Gy,膀胱D2cc:80~100Gy,肠管D2cc:65Gy。
对于术后辅助放疗,只要阴道残端愈合就可以开始近距离放疗,一般在手术后12周以内进行。剂量参考点在阴道黏膜表面或黏膜下0.5cm。针对阴道上段。高剂量率近距离治疗。体外放疗后补充近距离放疗者,常用剂量为4~6Gy×2~3f(黏膜表面)。术后只补充近距离放疗者,通常方案为7Gy×3f(黏膜下0.5cm处),或6Gy×5f(黏膜表面)。
(三)全身化疗和激素治疗
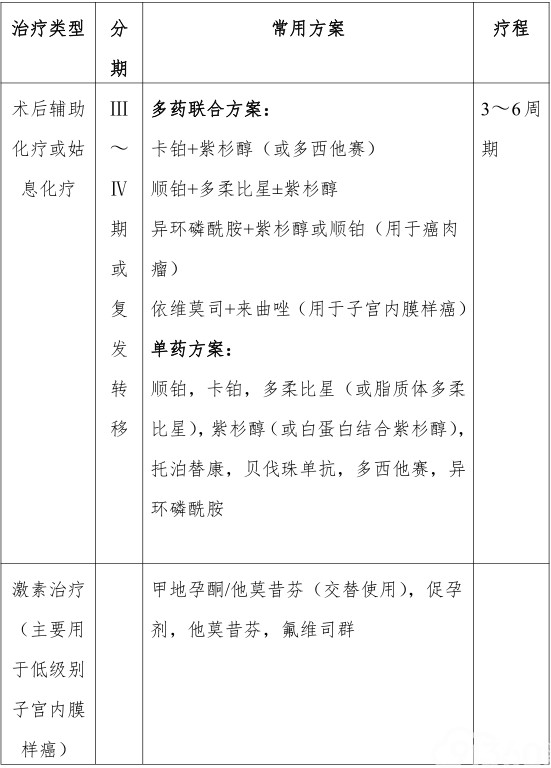
1.全身化疗主要应用于晚期(Ⅲ~Ⅳ期)或复发患者以及特殊病理类型患者。近年来也用于一些具有高危因素(IB期、G3)的早期患者的术后辅助治疗。研究表明对于这类患者,即便行辅助放疗后,仍有相当一部分出现远处转移。故大多数学者认为应该加用化疗。方案推荐为紫杉醇+卡铂。
对于晚期患者,ⅢA~ⅢC期推荐的方案为全身化疗和(或)体外放疗±腔内放疗。ⅣA/ⅣB期主要治疗为全身化疗。
若患者能耐受,推荐多药联合化疗方案。推荐的化疗方案及药物如下:卡铂/紫杉醇,顺铂/多柔比星,顺铂/多柔比星/紫杉醇(因为未改善总体生存率且毒性较大未被广泛使用),卡铂/多西他赛,异环磷酰胺/紫杉醇(用于癌肉瘤,1类证据),顺铂/异环磷酰胺(用于癌肉瘤),依维莫司/来曲唑。单药如顺铂、卡铂、多柔比星、脂质体阿霉素、紫杉醇、白蛋白紫杉醇、PD-1阻断剂帕姆单抗、拓扑替康、贝伐单抗、多烯紫杉醇(2B级证据)、异环磷酰胺(用于癌肉瘤)等。 使用细胞毒性药物仍然不能控制病情的患者可考虑加用贝伐珠单抗靶向治疗。
常用的子宫内膜癌药物治疗方案如表4所示。
表4 子宫内膜癌常用方案
2.新型靶向治疗
随着个性化肿瘤治疗和靶向研究热度不断升温,几种新型疗法已被开发和应用于子宫内膜癌的治疗,特别是在Ⅰ型子宫内膜癌治疗中。雷帕霉素类似物依维莫司、西罗莫司,已获批为子宫内膜癌Ⅱ期临床试验的单药治疗药物,目前在联合治疗方案中正进行评估。
血管内皮生长因子(VEGF)的过表达导致血管增生和给肿瘤供氧和营养的增多。贝伐单抗是一种针对VEGF的单克隆抗体,GOG在复发子宫内膜癌妇女中已将其作为应用药物之一。索拉非尼和舒尼替尼是2种阻断VEGFR的化合物。舒尼替尼已被证明部分缓解率为15%,血管内皮生长因子(VEGF)和VEGFR抑制剂的效用仍待评估。表皮生长因子受体(EGFR)和人表皮生长因子受体2(HER2)的抑制剂完成了复发或转移性子宫内膜癌的Ⅱ期临床试验。
3.激素治疗
激素治疗包括甲地孕酮及他莫昔芬(两者可交替使用)、孕激素类、芳香化酶抑制剂、他莫昔芬等。激素治疗仅用于子宫内膜样腺癌,主要为孕激素,用于早期子宫内膜癌需保留生育功能的年轻患者及晚期、复发性或无法手术的患者。以高效药物、大剂量、长疗程为佳,4~6周可显效。对肿瘤分化良好、孕激素受体阳性者疗效较好,对远处复发者疗效优于盆腔复发者。治疗时间尚无统一标准,但至少应用1年以上。总有效率25%~30%。最常用的孕激素主要有3 种:①醋酸羟孕酮(MPA),每日500~1000mg口服;②醋酸甲地孕酮(MA),每日160mg口服;③已酸羟孕酮(HPC),每日250~500mg。不推荐早期患者术后常规应用激素治疗。
(四)综合治疗
1.手术后的辅助治疗
Ⅰ期患者的术后治疗需结合患者有无高危因素、浸润肌 层深度和组织学分级进行评估。高危因素包括:年龄>60 岁、淋巴脉管间隙浸润、肿瘤较大(一般指肿瘤直径超过2cm)、子宫下段或宫颈间质浸润。补充治疗以放疗为主,阴道顶端愈合后尽早开始放疗,最好不超过术后12周。对于具有高危因素(ⅠB期、G3)的早期患者的可辅以化疗。Ⅱ、Ⅲ期患者的术后处理需结合手术方式和组织分化辅以放疗±化疗。ⅣA、ⅣB期:已行减瘤术并无肉眼残存病灶或显微镜下腹腔病灶时,行全身治疗±外照射放疗±阴道近距离放疗。具体见放疗部分术后辅助治疗的推荐建议。
2.不全手术分期/意外发现子宫内膜癌的后续治疗
不全手术分期指手术范围不足但可能存在高危因素,如深肌层浸 润或宫颈侵犯等。处理方法如下:①ⅠA期,G1~2级,肌层浸润小于50%,无淋巴脉管间隙浸润,肿瘤小于2cm者,术后可观察。②ⅠA期,G1~2级者(肌层浸润超过50%,淋巴脉管间隙浸润或肿瘤≥2cm),ⅠA期,G3级,ⅠB及Ⅱ期者,可选择先行影像学检查,若影像学检查结果阴性,则按照完全手术分期后相应方案治疗,若影像学检查结果为可疑或阳性,则对合适的患者进行再次手术分期或对转移病灶进行病理学确诊;也可直接选择再次手术分期,术后辅助治疗方案选择与上述完全手术分期后相同。
3.复发性子宫内膜癌的治疗
Ⅰ期和Ⅱ期患者术后复发率约15%,其中50%~70%的复发有症状。大多数复发发生在治疗后3年内。局限于阴道或盆腔的复发经过治疗后仍有较好的效果。孤立的阴道复发经放疗后5年生存率达50%~70%。超出阴道或盆腔淋巴结复发则预后较差。复发后的治疗与复发位置、既往是否接受过放疗相关。
影像学检查证实没有远处转移的局部复发。①复发位置既往未接受过放疗者,可选择外照射放疗±阴道近距离放疗或手术探查+切除±术中放疗。手术后发现病灶局限于阴道,可行外照射放疗±阴道近距离放疗±全身治疗;手术后发现病灶超出阴道,到达盆腔淋巴结者可行外照射放疗±阴道近距离放疗±全身治疗,若到达腹主动脉旁或髂总淋巴结者行外照射放疗±全身治疗。复发到达上腹部,残留病灶较小时可选择全身治疗±外照射放疗,巨大复发灶按如下播散性病灶处理。②复发位置既往接受过放疗者,若原来仅接受过阴道近距离放疗,其处理方法与复发位置既往未接受过放疗者相同。若原来接受过盆腔外照射放疗,考虑手术探查+切除±术中放疗和(或)全身治疗±姑息性放疗。
孤立转移灶:①考虑手术切除和(或)外照射放疗或消融治疗。②考虑全身治疗。对于不能切除的病灶或再次复发者,按如下播散性病灶处理。
播散性病灶:①低级别或无症状或雌激素受体、孕激素受体(ER/PR)阳性者可行激素治疗,继续进展时则行化疗,治疗后再进展则支持治疗。②有症状或G2~3级或巨块病灶时行化疗±姑息性外照射放疗,再进展则支持治疗。
(五)特殊类型子宫内膜癌(浆液性癌、 透明细胞癌)的综合治疗
子宫浆液性腺癌与子宫内膜透明细胞癌:子宫浆液性腺癌较少见。其病理形态与卵巢浆液性乳头状癌相同,以含沙粒体的浆液性癌、有或无乳头状结构为其诊断特征。恶性程度高,分化低,早期可发生脉管浸润、深肌层受累、盆腹腔淋巴结转移。预后差,Ⅰ期复发转移率达31%~50%;早期5年存活率40%~50%,晚期则低于15%。子宫内膜透明细胞癌的预后亦差,二者均为子宫内膜癌的特殊亚型(Ⅱ型)。
治疗原则:无论临床诊断期别早晚,均应进行同卵巢癌细胞减灭缩瘤术的全面手术分期,包括盆腹腔冲洗液细胞学检查、全子宫双附件切除术、盆腔淋巴结及腹主动脉旁淋巴结清扫术、大网膜切除术及腹膜多点活检术。晚期则行肿瘤细胞减灭术。术后治疗以化疗为主,除局限于内膜的部分ⅠA期患者可观察外,其余有肌层受侵的ⅠA~Ⅳ期患者均应化疗+盆腔外照射。GOG组曾比较子宫浆液性腺癌、透明细胞癌与子宫内膜样癌对化疗的反应,结果无显著性差异,因此认为前两者化疗方案同子宫内膜癌。但普遍认为子宫浆液性腺癌术后宜选用与卵巢浆液性乳头状癌相同的化疗方案,如紫杉醇+卡铂等。对于晚期患者,可采用术前新辅助化疗,再行肿瘤细胞减灭术,之后再行化疗。放疗多选用盆腔外照射+阴道腔内照射控制局部复发。
子宫癌肉瘤:病理学家认为子宫癌肉瘤属化生癌,应属上皮癌,故WHO 2003年提出归于子宫内膜癌的范畴,2010年NCCN病理分类中,将癌肉瘤列入子宫内膜癌Ⅱ型。其恶性程度高,早期即可发生腹腔、淋巴、血循环转移。
治疗原则:无论临床诊断期别早晚,均应进行同卵巢癌的全面分期手术,晚期行肿瘤细胞减灭术。与子宫浆液性乳头状癌相同,术后除局限于内膜层的ⅠA期患者可选择观察或化疗,其余有肌层受侵的ⅠA~Ⅳ期患者均应盆腔外照射+化疗。推荐应用紫杉醇+异环磷酰胺。如患者无法耐受,可应用单药异环磷酰胺化疗。异环磷酰胺是子宫内膜癌肉瘤最有效的单药,缓解率达29%~36%。联合治疗方案还可以采用异环磷酰胺+铂类的化疗方案。术后盆腔照射可有效控制复发提高生存率。
(六)保留生育功能患者指征和方法
约5%的子宫内膜癌患者在40岁之前诊断。多数年轻的子宫内膜患者在诊断时并未生育,对于准备保留生育功能的患者,进行子宫内膜病理检查是必要的(推荐行宫腔镜检查),宫腔镜检查更可靠,G1病变中仅23%级别升高。还应该对肌层浸润的深度进行增强MRI评估。
保留生育功能只适用于子宫内膜样腺癌。符合下列所有条件才能保留生育功能:①分段诊刮标本经病理专家核实,病理类型为子宫内膜样腺癌,G1级。②MRI检查(首选)或经阴道超声检查发现病灶局限于子宫内膜。③影像学检查未发现可疑的转移病灶。④无药物治疗或妊娠的禁忌证。⑤经充分解释,患者了解保留生育功能并非子宫内膜癌的标准治疗方式并在治疗前咨询生殖专家。⑥对合适的患者进行遗传咨询或基因检测。⑦可选择甲地孕酮、醋酸甲羟孕酮和左炔诺孕酮宫内缓释系统治疗。最常用的口服孕激素包括醋酸甲羟孕酮(400~800mg,每日口服)或醋酸甲地孕酮(160mg/d,分2或4次每天)。⑧治疗期间每3~6个月分段诊刮或取子宫内膜活检,若子宫内膜癌持续存在6~12个月,则行全子宫+双附件切除+手术分期,术前可考虑行MRI检查;若6个月后病变完全缓解,鼓励患者受孕,孕前持续每3~6个月进行内膜取样检查;若患者暂无生育计划,予孕激素维持 治疗及定期监测。⑨完成生育后或内膜取样发现疾病进展,即行全子宫+双附件切除+手术分期。许多子宫内膜样癌的年轻患者还有其他影响生育功能的因素,包括肥胖与多囊卵巢综合征。强烈建议减肥。咨询不孕不育专家可能对成功妊娠非常必要。在患者激素治疗后可能需要应用一些辅助生殖技术,包括克罗米酚、人工授精和体外受精。
(七)中医治疗
中医从整体观念出发,实施辨证论治,有助于减轻子宫内膜癌患者术后功能的恢复,减少放、化疗的不良反应,增强放疗、化疗的效果,提高机体的免疫力,减少并发症的发生,改善癌症相关症状和生活质量,对防止肿瘤复发转移及延长生存期起到一定作用。可以配合西医补充与完善子宫内膜癌的治疗。
中医学认为子宫内膜癌主要是痰浊湿热瘀毒蕴结胞宫,阻塞经脉,损伤冲任,日久成积,暗耗气血,败损脏腑。调理冲任、清热利湿解毒,祛痰化瘀为主要治疗方法。晚期患者多见肾阴虚亏虚,治以育阴滋肾、固冲止血为主。近年来常用现代中药制剂,包括西黄丸、消平胶囊、大黄䗪虫丸、复方斑蝥胶囊、复方苦参注射液等用于治疗子宫内膜癌,在临床上得到广泛应用,具有一定疗效,安全性和耐受性均较好。其中复方苦参注射液被来自美国国家癌症中心及澳大利亚阿德莱德大学的实验研究证实其抗癌作用,但这些药物尚缺乏高级别的循证医学证据支持,需要积极进行深入研究。
五、预后
子宫内膜癌的预后影响因素和分期明显相关。早期患者影响预后的高危因素包括深肌层受侵、淋巴间隙受累、肿瘤分化差(G3)、特殊肿瘤类型、宫颈受侵等。术后最重要的预后因素是有无淋巴结转移,即手术病理分期的提高。肿瘤分级和肌层受浸深度可反应淋巴结转移的概率,淋巴间隙受累则淋巴结转移的概率增加。有鳞状细胞成分的恶性肿瘤,肿瘤的侵袭性主要和其中腺体的分化程度相关。而Ⅱ型子宫内膜癌较Ⅰ型子宫内膜癌预后差。
六、随访
完成治疗后患者前2~3年每3~6 个月随访1次,以后每6~12个月随访1次。随访内容包括:关于可能的复发症状、生活方式、肥胖、运动、戒烟、营养咨询、性健康、阴道扩张器及阴道润滑剂使用的健康宣教;若初治时CA125升高则随访时复查;有临床指征行影像学检查。因为对于Ⅰ期患者而言,无症状阴道复发只有2.6%,术后无症状患者不推荐阴道细胞学检查。
本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论