作者:何乐健
志谢:图17~20由洛杉矶儿童医院病理科王亮教授提供
本文来源:中华病理学杂志, 2018,47(11) : 817-821.
近年来,文献中陆续报道了一些好发于儿童及青少年的罕见肿瘤或疾病,这些疾病大多具有独特的临床病理、分子生物学特点,其治疗方案及预后也各有不同,因此,认识并准确诊断这些疾病尤为重要,本文将介绍几种在日常病理诊断工作中所遇到的一些儿童罕见肿瘤或疾病,以便广大病理工作者特别是儿科病理医师进一步了解这些疾病的病理特点,为病理诊断和研究提供依据。
伴有CIC-DUX4易位的未分化圆形细胞肉瘤(undifferentiated round cell sarcoma with CIC-DUX4 translocation)
外周原始神经外胚层瘤类的肿瘤,儿童和青年人多见,好发部位为四肢,其他如躯干、头颈部、脑、骨盆等也有报道;临床表现为快速生长的、表浅或深部软组织肿块,预后差,多数患者2年内死亡,肿瘤转移率高。组织学特点是见片状致密小圆形瘤细胞,中度核多形性,染色质粗糙、核仁明显,胞质界限不清,瘤细胞可见局灶性透明胞质,核分裂象易见,有时可见梭形瘤细胞及地图样坏死,局部可呈黏液样,或索状排列;免疫组织化学染色无特殊,CD99、WT1、Fli-1、ERG、INI1等阳性,S-100蛋白、细胞角蛋白(CK)、结蛋白、myogenin、TLE1等阴性;分子遗传学检查多数病例发现染色体t(4;19)(q35;q13、1)易位,其他少数病例可有t(10;q26;q13)易位,荧光原位杂交(FISH)检查可有CIC-DUX4易位(图1,图2)。
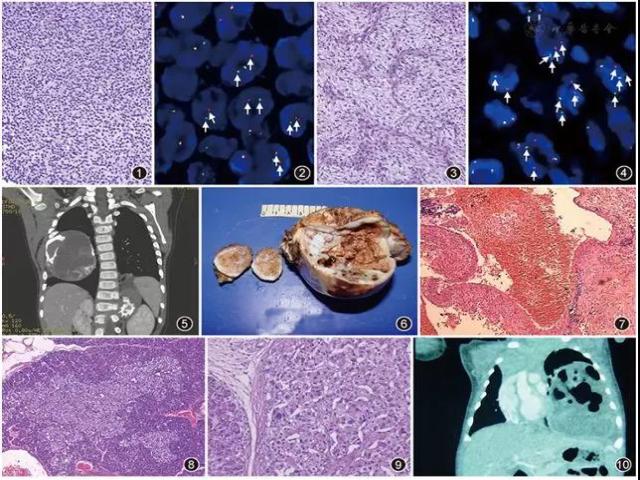
▲图1 小圆细胞未分化肿瘤,瘤细胞片状排列 HE 低倍放大
▲图2 FISH检测CIC基因状况(双色分离探针),图中箭头示CIC基因断裂阳性,细胞中存在分离的红绿信号点 FISH ×1 000
▲图3 梭形瘤细胞,胞质透明,实性片状排列,其间见丰富、纤细、弯曲血管结构 HE 低倍放大
▲图4 FISH检测FUS基因状况(双色分离探针),图中箭头示FUS基因断裂易位阳性细胞中分离的红绿信号点 FISH ×1 000
▲图5 CT检查示胸壁肿物,占据大部右胸腔,内见少数密度高的骨、软骨组织
▲图6 大体照片示囊实性肿物,见软骨、骨组织
▲图7 血管样囊腔,囊壁为纤维组织 HE 低倍放大
▲图8 巨大胰岛结构,界限尚清 HE 低倍放大
▲图9 示部分胰岛细胞核增大、深染 HE 中倍放大
▲图10 大体照片显示囊实性肿物,部分呈海绵状,有纤维包膜,与周围肺组织分界清楚
低度恶性纤维黏液样肉瘤(low grade fibromyxoid sarcoma)
梭形细胞、胶原或黏液基质组成的低度恶性纤维母细胞性肿瘤,多数病例具有特异性FUS-CREB3L2或FUS-CREB3L1融合基因异常。好发于青年人,20%的病例小于18岁,四肢、躯干多见,偶见于内脏器官;临床表现为无痛性、缓慢生长的肿物,常长达1年以上,肿物多位于软组织深部,儿童患者多发生于表浅软组织;肿物进展缓慢,手术后数年内局部复发和转移率较低,但随着随访时间增加,复发和转移率增高,常见转移部位有肺、胸膜和胸壁,表浅肿物预后较好。镜下观察肿物界限清楚,显微镜下常显示肿瘤浸润周围软组织,瘤细胞梭形、胞质不清,核稍大或深染,核分裂象少见,纤维和黏液区混合存在;纤维区细胞稀少,富有纤细纤维或胶原基质,见短束状和旋涡状结构,有时可见由稀少细胞胶原围绕的菊形团结构;黏液区细胞较多,血管更明显,血管周围细胞可富于细胞,小血管周围可见不同程度的血管周围硬化;坏死罕见,可见囊性变、骨化生、鹿角血管等;有时复发或转移瘤中更易见到灶状细胞密集区、核分裂象、多形性或上皮样瘤细胞;亚型:伴有巨大菊形团形成的玻璃样变梭形细胞肿瘤;免疫组织化学染色MUC4、上皮细胞膜抗原(EMA)、CD34、平滑肌肌动蛋白(SMA)、Claudin-1阳性,结蛋白、S-100蛋白、角蛋白(CK)、β-catenin阴性。75%的肿瘤有t(7;16)(q33;p11)特异性染色体易位,形成FUS-CREB3L2融合基因;还可见t(11;16)(q11;p11)特异性染色体易位,形成FUS-CREB3L1融合基因及EWSR1-CREB3L1融合基因(图3,图4)。
婴儿胸壁错构瘤(chest wall hamartoma of infancy)
良性、非肿瘤性病变,表现为肋骨膨胀性病变,结节性软骨、间叶组织、继发动脉瘤样骨囊肿样改变;也叫胸壁婴儿型错构瘤(infantile hamartoma of the chest wall)、软骨间叶错构瘤、间叶瘤、胸壁间叶错构瘤、婴儿血管错构瘤等。多数病例见于新生儿,97%的病例为1岁以内的婴儿,男女比例为2∶1;病变位于前部或侧部肋骨,偶见鼻道的报道,9%为多灶性和双侧病变[5],多无症状,也可有产程困难、呼吸困难等;肿物可生长较快。影像学特点为膨胀性肿块,常伴有软骨型钙化,累及单一或多块肋骨,骨质破坏常提示"恶性";超声检查显示混合性囊实性均质性回声;偶有肿物进展或消退的报道,但多发生于1岁以内的婴儿;症状明显可选择外科手术切除肿物。肿瘤由实性和囊性区组成,囊性区形态类似动脉瘤样骨囊肿:出血空腔、囊壁为梭形间质细胞伴有多核巨细胞,细胞未见异形核、异常核分裂象;外周实性部分,细胞密集的软骨结节伴骨化,软骨成熟,细胞密集和较原始形态;还可见软骨母细胞瘤增生、编织骨和骨样组织区域;分子遗传学特点,1例患儿伴有Widemann-Beckwith综合征,提示11p15.5环形基因的可能(图5,图6,图7)。
伴有B细胞ATP敏感性钾通道异常的胰岛素分泌增多(hyperinsulinism with B-cell ATP-sensitive potassium channel abnormalities)
过去也叫胰岛母细胞增生症(nesidioblastomatosis),ATP敏感性钾通道异常是最常见先天性胰岛素分泌增多原因之一,对通道拮抗剂二氮嗪治疗无效,需手术切除胰腺治疗方有效。
表现为单个或成束的胰岛细胞增生伴有反复发作的、持续性、症状性胰岛素增高性低血糖,可为局灶或弥漫性,胰岛母细胞增生。发病率为新生儿1/50 000~1/2 500,大多数病例为新生儿或1岁以内的婴儿;临床表现为反复发作、持续性、症状性、胰岛素增高性低血糖血症、巨大胎儿、肝大、多血症;影像学检查胰腺可正常或略增大;该病分3型,镜下观察胰腺β细胞增生和肥大,弥漫型:胰腺可见β细胞核增大和深染,呈弥漫性分布,导管样胰岛复合体,胰腺腺泡组织中可见各种大小和形状的胰岛;局灶型:异常胰岛聚集,局灶或多灶性结节性病变,大的β细胞呈束状分布,细胞核增大、深染,β细胞被腺泡细胞分割,病变可含有其他胰腺内分泌细胞,常见导管胰腺复合体,应充分取样;分子遗传学特点可见ABCC8和KCNJ1基因突变(β钾通道蛋白),局灶性常伴ABCC8突变(图8,图9)。第3型为显性ATP敏感性钾通道突变,罕见,临床症状轻,ABCC8和KCNJ11基因显性表达。
胎儿肺间质性肿瘤(fetal lung interstitial tumor,FLIT)
FLIT是一种新近认识的孤立性、先天性肺良性占位性病变,由不成熟的气道及间质构成,表面被覆扁平或立方上皮,上皮下为形态温和的不成熟间质细胞。该病极为罕见,至今文献报道的病例不足15例。临床可无症状,仅由常规产检时B超发现;或者患儿在生后出现呼吸困难、喂养困难等症状;伴或者不伴有发热。大多无特异性实验室检查阳性结果,可有缺氧导致的氧分压降低。影像学检查见局限于一个肺叶的、界限清楚的孤立性肿物,实性或囊实性(图10);镜下观察肿瘤与周围正常肺组织分界清楚,可见纤维包膜;镜下观察肿瘤由大小不等的肺泡样囊腔构成,部分囊腔与管状结构相互移行(类似终末呼吸性细支气管及肺泡管结构);囊壁表面被覆扁平或立方上皮细胞,胞质浅染,细胞核形态温和、无明显异型;囊壁间隔增宽,间质细胞呈卵圆形、多角形或梭形,胞质丰富透明,核圆形或卵圆形,染色质细腻(图11);表面被覆上皮细胞阳性表达CK、EMA、甲状腺转录因子(TTF)1及β-catenin;间质细胞阳性表达波形蛋白、SMA、β-catenin(细胞质着色),Ki-67阳性指数5%~10%;结蛋白、CD34、突触素、HMB45、间变性淋巴瘤激酶(ALK)、S-100蛋白、CD56、CD30等均为阴性。FISH检测发现部分FLIT病例存在ALK基因重排。
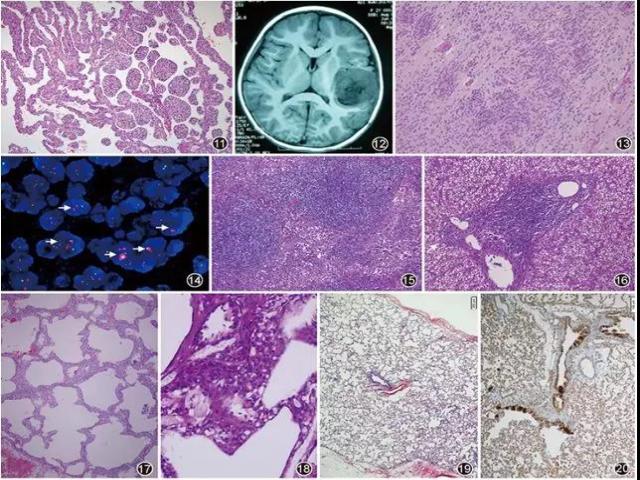
▲图11 肿物由不成熟的气道构成,间隔增宽,宽度不等,略呈海绵状 HE 低倍放大
▲图12 MRI显示颞叶占位
▲图13 多个真菊形团 HE 中倍放大
▲图14 FISH检测C19MC基因状况(扩增探针),红点代表C19MC基因,绿点为参考基因ZNF443,箭头所示细胞C19MC基因扩增(C19MC/ZNF443>2),点簇状分布 FISH ×1 000
▲图15 显示淋巴结副皮质区扩大,淋巴滤泡增生 HE低倍放大
▲图16 显示汇管区淋巴细胞浸润 HE 低倍放大
▲图17 肺间质弥漫性增厚,肺间质少量组织细胞增生和浸润HE 低倍放大
▲图18 可见肺间质细胞内的糖原 PAS染色 中倍放大
▲图19 显示正常小叶肺泡和远端小气道 HE 低倍放大
▲图20 远端小气道神经内分泌细胞增生 蛙皮素染色 中倍放大
伴有多层菊形团和C19MC变化的胚胎性肿瘤(embryonal tumor with multilayered rosettes,C19MC-altered,ETMR)
一种侵袭性生长、伴有多层菊形团和19q13.32位点C19MC基因变化(扩增或融合)的中枢神经系统胚胎性肿瘤。以往将大部分儿童中枢神经系统胚胎性肿瘤归为一组肿瘤,包括富有神经毡和真菊形团的胚胎性肿瘤、室管膜母细胞瘤以及髓上皮瘤,多发生在4岁以下儿童,临床表现为颅内压增高,如头痛、恶心、呕吐和视力障碍,CT和MRI显示为对比增强的大肿块,可有囊变或钙化。病理学特征是菊形团,表现为多层、核分裂活跃的假复层神经上皮围成中央圆形或裂隙状的腔结构,菊形团围成的腔往往是空的或含有嗜酸性碎屑,有些菊形团的腔面细胞有清晰的内界膜,围成菊形团的细胞核从腔面推挤朝向外层细胞边界,大多数肿瘤缺乏菊形团外层界膜;肿瘤细胞表达巢蛋白和波形蛋白,小细胞可局灶表达上皮细胞角蛋白、EMA以及CD99,通常不表达神经元和胶质细胞标志物,但有些胚胎性肿瘤细胞也可表达胶质纤维酸性蛋白(GFAP);神经毡和肿瘤性神经元突触素表达阳性,Neu N在肿瘤性神经元也可以阳性表达;肿瘤细胞INI1表达阳性,Ki-67阳性指数为20%~80%,LIN28A是ETMR诊断性标志物。分子遗传学特点发现有19q13.42局灶高水平扩增是该肿瘤特异性和敏感性的标志物(图12,图13,图14)。
自身免疫性淋巴增生性综合征(autoimmune lympholiferative syndrome,ALPS)
由于FAS基因介导的凋亡缺陷导致淋巴细胞自身稳定紊乱性疾病。临床分为:Ⅰ型约占65%,又分三亚型:Ⅰa,胚系FAS(TNFRSF6,CD95,APO1)基因突变;Ⅰb,FAS(FASLG)连接基因突变;Ⅰs,体细胞FAS基因突变;Ⅱ型:编码半胱天冬酶的基因突变;Ⅲ型FAS通路未见基因突变;Ⅳ型:罕见,NRAS功能获得性突变,患者有ALPS表型,但FAS介导多为正常。患儿常常在出生1年内出现慢性非恶性淋巴组织增殖,反复发作或慢性淋巴结病,85%的患儿有脾大及脾功能亢进,45%的患儿有肝大,淋巴细胞间质性肺炎;70%的患儿有自身免疫性疾病;ALPS患儿增加患各种恶性肿瘤的危险:霍奇金及非霍奇金淋巴瘤、癌。ALPS的非恶性淋巴组织增生性疾病可以消退或改善,一生中有患淋巴瘤的危险性。病理检查:淋巴结常有副皮质区明显扩大,生发中心增生(滤泡增生、萎缩),生发中心进行性转化,类似Rosai-Dorfman样等改变(图15,图16)。脾可见白髓扩大、红髓扩大。肝脏可见汇管区炎性病变。
诊断ALPS标准:主要症状:(1)慢性非恶性淋巴组织增生;(2)超过6个月、至少两组淋巴结肿大和/或脾大;(3)外周血双标阴性细胞明显升高5%以上;(4)体外FAS介导凋亡缺陷;(5)FAS、FASL、CASP10、NRAS基因突变。次要症状:(1)自身免疫性细胞减少;(2)外周血双标阴性细胞中度升高;(3)血清IgG升高;(4)血清IL-10升高;(5)维生素B12升高;(6)血浆FAS连接水平升高;诊断标准是3个主要症状或2个主要症状加2个次要症状即可诊断ALPS。
分子遗传学特点:患儿发现有FAS、FASLG、CASP10等基因突变。
肺间质糖原沉积症(pulmonary interstitial glycogenosis,PIG)
多发生在出生后数小时新生儿,表现为突然出现呼吸急促、呼吸困难和低氧血症;胸片检查表现为肺过度充气伴弥漫性肺间质浸润改变;高分辨率CT:弥漫型主要表现为磨玻璃样斑片状阴影,小叶间隔增厚和网状改变。镜下观察:肺间质一般无或少量组织细胞增生和浸润,肺间质伴弥漫性增厚,可见丰富波形蛋白阳性的梭形未分化间质细胞,PAS染色阳性。间质不伴有胶原沉积,肺泡腔内无炎性渗出,梭形未分化间质细胞PAS染色阳性(图17,图18)。
婴儿神经内分泌细胞增生症(neuroendocrine cell hyperplasia of infancy, NEHI)
婴幼儿时期特有的间质性肺疾病,临床表现为持续性呼吸困难,病理上以远端气道神经内分泌细胞增生,常常伴有神经上皮小体形成为特征。常见健康足月儿或近足月儿(大约85%患者为足月儿),早产儿患者常常没有慢性肺疾病的病史。1岁以内起病多见,一般生后正常,起病相对隐匿,多于生后或感染后逐渐出现持续性呼吸困难,可持续数月至数年不等,平均2~3年,有低氧血症;高分辨率CT可见特征性改变:一是地图样分布的磨玻璃影,多见于右肺中叶及左肺舌叶,另一个主要特征是呼气位气体滞留的马赛克征象,多见于下叶。镜下观察:肺正常或仅见少许间质轻度非特异性变化,包括气道平滑肌细胞增生,肺泡巨噬细胞和气道清除细胞的增多;典型病理改变是蛙皮素(Bombesin)阳性的肺神经内分泌细胞增多,主要分布于远端小气道,并可在小叶实质内的肺泡管成簇分布,形成增多和/或增大的神经上皮小体;蛙皮素及5-羟色胺染色显示神经内分泌细胞增生;分子遗传学特点与TTF1/NKX2基因突变有关(图19,图20)。















共0条评论