作者:黄慧
与先天性畸形、炎性肿块和转移性肿瘤相比,儿童原发性肺肿瘤比较少见。一篇综述报道,儿童原发性肺肿瘤与肺转移性肿瘤及非肿瘤性病变的比例是1:5:60。大多数文献报道,在儿童原发性肺肿瘤中,恶性肿瘤的发生率高于良性肿瘤。但是数目根据患者人数和良性肿瘤的定义而有所不同,其中一些报道包括血管/淋巴管畸形和炎性肌纤维母细胞瘤(IMT)。儿童原发性肺肿瘤占儿童所有恶性肿瘤的0.2%左右。
20岁以下的儿童和青少年极少发生成人常见的肺上皮性肿瘤,所占比例不到该年龄段原发性肺肿瘤的0.2%。包括类癌和黏液表皮样癌在内的支气管内肿瘤是儿童最常见的肺上皮性恶性肿瘤,大多数病例发生于大龄儿童和青少年。这些支气管内肿瘤通常为低度恶性,很少有神经内分泌癌和高级别黏液表皮样癌的病例报道,腺泡细胞癌极为罕见。支气管内有代表性的肿瘤是炎性肌纤维母细胞瘤(大龄儿童好发)和婴儿型血管瘤(婴儿好发)。值得注意的是,儿童1型先天性肺气道畸形可伴发原位腺癌。肺母细胞瘤(不同于胸膜肺母细胞瘤)在儿童时期很少发现。
好发于儿童的原发性肺肿瘤主要包括胸膜肺母细胞瘤(pleuropulmonary blastoma,PPB)、先天性支气管周围肌纤维母细胞瘤(congenital peribronchial myofibroblastic
Tumor,CPMT)、胎儿肺间质瘤(fetal lung interstitial tumor,FLIT)。这组肿瘤具有明显起源于原始肺间充质和发病年龄小的特征(均发生在围产期/婴儿期,PPB也可发生于年龄稍大的儿童,甚至是成人),但是临床生物学行为却大不相同。今天首先通过一病例来认识胸膜肺母细胞瘤。
病例介绍:
患儿女,3岁。全身皮疹、咳嗽1周,间断发热3天入院。CT所见:右侧胸腔内见一椭圆软组织块影,CT值约30HU,内见条状稍高密度影,CT值约62HU,边界清楚。增强后,肿块内见条状血管影,呈中度强化,CT值约58.8HU,邻近骨质结构未见破坏,右侧胸腔内见积液征,右侧肺野见片状密度影,余(-)。大体所见:结状组织一个:9*6*3cm,切面灰红紫红,部分区域坏死,质软,鱼肉样。显微镜下组织学形态如图1--图7;免疫表型:肿瘤细胞表达波形蛋白、CD99、desmin(图8)、INI1和TLE1(核阳性)(图9),不表达CK(上皮阳性)(图10)、EMA、WT1、S100、NSE、Syn、SMA、CgA;荧光原位杂交:SYT基因断裂阴性。
病理诊断:胸膜肺母细胞瘤(III型)。
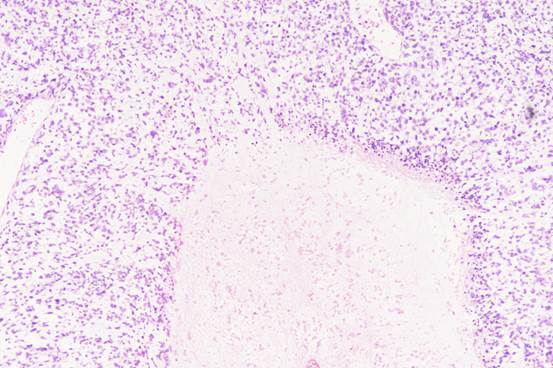
图1:胚胎性横纹肌肉瘤及坏死区域(图片来源作者)

图2:实体型腺泡状横纹肌肉瘤区域(图片来源作者)
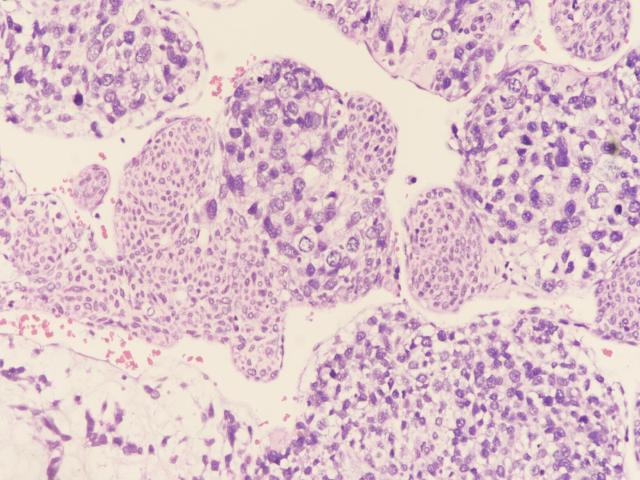
图3:肉瘤样区域和原始细胞区域(图片来源作者)
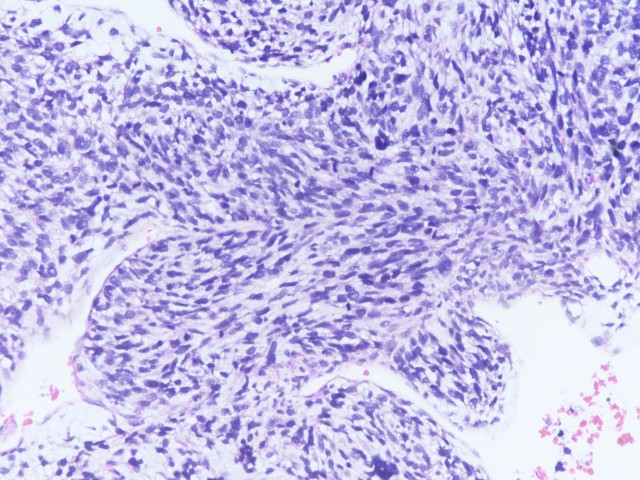
图4:纤维肉瘤样区域(图片来源作者)
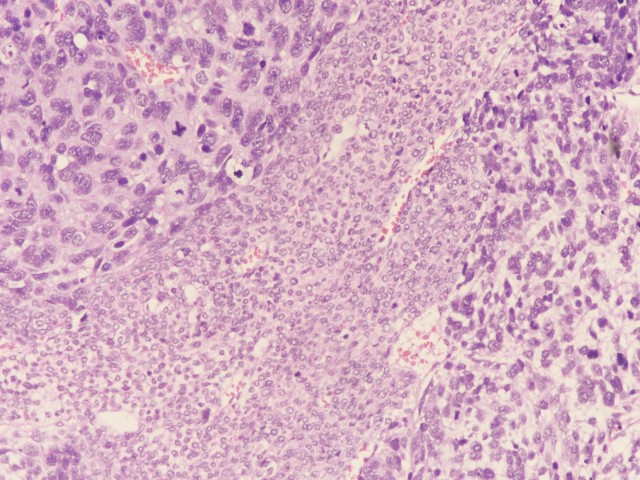
图5:左上角可见核分裂象,中间为原始细胞,右边肉瘤样细胞(图片来源作者)

图6:中间可见上皮成分(图片来源作者)
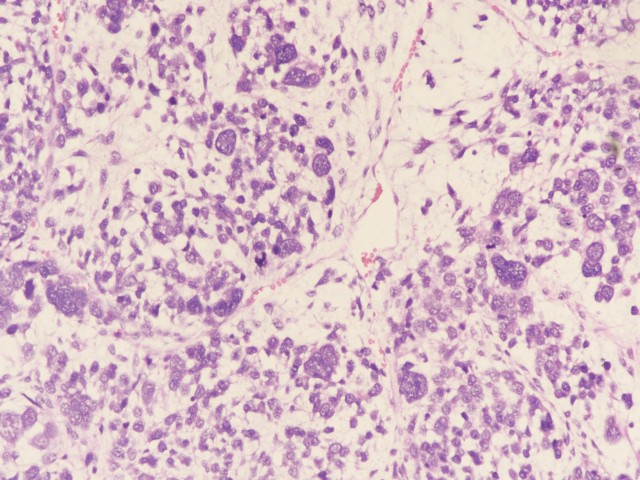
图7:可见大量间变细胞(图片来源作者)
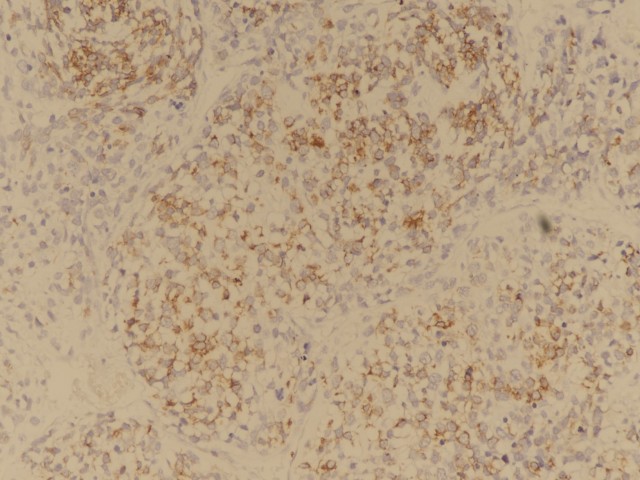
图8:肿瘤细胞desmin阳性(图片来源作者)

图9:肿瘤细胞TLE1阳性(图片来源作者)
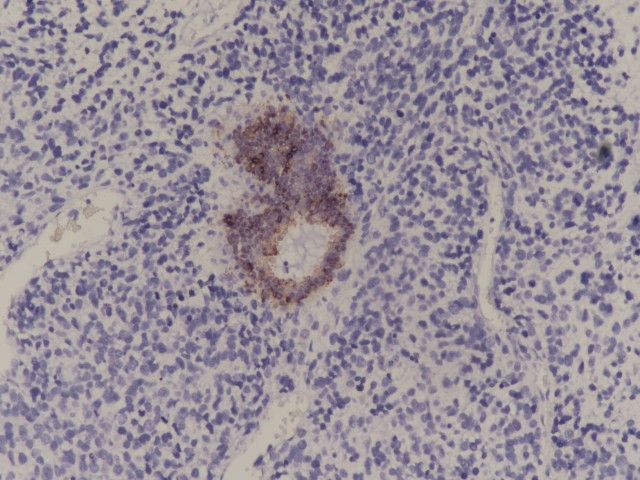
图10:肿瘤细胞CK阴性,上皮细胞CK阳性(图片来源作者)
讨论:
胸膜肺母细胞瘤(pleuropulmonary blastoma,PPB)虽然少见,但是儿童最常见的原发性恶性肺肿瘤。1988年PPB首次被描述为一实体肿瘤,是一种胚胎异常/发育异常的间叶性肿瘤,类似于肾母细胞瘤、视网膜母细胞瘤和肝母细胞瘤。之前PPB被命名为如起源于先天性肺囊肿的胚胎性横纹肌肉瘤和恶性间叶瘤。PPB也曾作为肺母细胞瘤被报道过,但PPB缺乏恶性上皮成分,临床上与双相型肺母细胞瘤也不同。
DICE1基因参与早期发育过程中的各种器官间质-上皮间相互作用。25%的PPB与DICE1家族性肿瘤易感性综合征有关,三分之二的PPB有DICE1基因杂合性胚系突变。恶性转化被认为是体细胞DICE1突变的“二次打击”。除了PPB外,与DICE1家族性肿瘤易感性综合征有关的肿瘤还有囊性肾瘤、卵巢性索间质肿瘤、葡萄状胚胎型横纹肌肉瘤、甲状腺肿瘤和鼻软骨间叶性错构瘤。
【临床特征】PPB分为三型:I型是完全囊性,II型是囊实性,III型是完全实性,显示从非转移性单纯囊性病变到高度侵袭性恶性肿瘤的生物学进展。近年来,从I型肿瘤中剔除了Ir型病变。Ir型为非进展性/退化的囊性病变,即PPB I退化型(type I regressed,Ir)。PPB的临床特征总结见表1。
表1:PPB的临床特征
性别 和 年龄 分布 | I型主要发生于男孩,中位发病年龄为8月,多在3岁内诊断; Ir型无性别差异,发病年龄从婴儿到成人,中位发病年龄为46.5月; II型无性别差异,中位发病年龄为35月,多在6岁内诊断,婴儿罕见; III型无性别差异,中位发病年龄为41月,多在7岁内诊断,婴儿罕见; |
临床 表现 | 临床表现有胸痛、发热、咳嗽、呼吸窘迫(气胸), 约10%病例有远处(如CNS和骨)转移症状; |
治疗 及 预后 | I型外科完整切除,化疗作用不明确;5年生存率达91%; Ir型外科完整切除;5年生存率达100%; II型外科完整切除+化疗;5年生存率为59%; III型外科完整切除+化疗;5年生存率为37%; 与预后有关的因素:肿瘤类型及是否有远处转移; |
【病理学特征】PPB的大体特征、显微镜下表现及免疫表型见表2。
表2:PPB的病理学特征及鉴别诊断
大体特征 | I型:表现为边界清楚的薄壁含气囊肿,单房或有间隔的多房,未见肉眼结节; II型:部分呈囊性改变,实性区域同III型; III型:肿瘤完全呈实性,表面可呈结节状,切面灰白鱼肉样,可见出血; |
镜下形态 | I型:可见细纤维组织间隔的多房囊肿,囊壁表面被覆良性呼吸道上皮,囊壁间隔内可见原始间叶小细胞、形成层细胞、梭形细胞或软骨小岛、胚基成分和横纹肌分化,肉瘤样区域为横纹肌肉瘤和纤维肉瘤,间变比较少见; Ir型:同I型,但囊壁/间隔完全缺乏原始小细胞和横纹肌母细胞; II型和III型:II型实性区域和III型组织学改变相似,主要成分为或多或少的良性呼吸道上皮,以及原始肉瘤样成分,包括胚胎性横纹肌肉瘤、梭形细胞或纤维肉瘤或未分化肉瘤成分及软骨肉瘤等,胚基小岛围绕原始间叶细胞,基质黏液变性明显,软骨样结节可见幼稚软骨小岛至肉瘤样分化。间变和坏死常见,间变细胞的判断标准同肾母细胞瘤; |
免疫表型 | 肿瘤细胞波形蛋白阳性,部分病例肿瘤细胞可表达TLE1(滑膜肉瘤相关基因SYT断裂阴性)和CD99;呼吸道上皮CK和TTF1阳性,横纹肌肉瘤成分表达desmin和myogenin,间叶成分表达不定,软骨成分表达S100; |
遗传学改变 | PPB除了有DICE1基因突变外,部分病例还有2号和8号染色体三体。 |
鉴别诊断 | I型主要与先天性肺气道畸形、先天性肺气肿和支气管源性囊肿进行鉴别; II型主要与囊性滑膜肉瘤进行鉴别(联合免疫表型和基因检测结果); III型主要与滑膜肉瘤、横纹肌肉瘤、纤维肉瘤和尤文肉瘤/PNET进行鉴别; |
【参考文献】
[1] Pulmonary Pathology: Foundations in Diagnostic Pathology[M].2017.
[2] 儿童肿瘤病理学诊断图谱[M].2016.























共0条评论