肺癌脑(膜)转移诊断治疗共识
全文刊登于《循证医学》2018年 第18卷 第4期
执笔专家
吴一龙, 陆舜, 王长利, 陈晓媛, 程颖, 范云, 赵明芳, 刘晓晴, 陈明, 周彩存, 王洁, 黄诚, 伍钢, 杨帆, 毛伟敏, 许林, 王绿化, 张力, 周清华, 陈椿, 邬麟, 王启鸣, 黄飚, 江本元, 张绪超, 陈丽昆, 刘云鹏, 胡洁, 冯继锋, 杨衿记, 张力, 胡成平, 傅小龙, 周清, 常建华, 刘安文, 周建英, 宋启斌, 朱广迎, 宋勇, 蔡修宇, 黄云超, 胡艳萍, 董晓荣, 陈克能, 张真发, 陈元, 韩宝惠, 马智勇, 陈海泉, 徐世东, 赵琼, 王丽萍, 李强, 涂海燕, 李峻岭, 杨学宁, 崔久嵬, 牟巨伟, 周德祥, 钟文昭, 王群, 乔贵宾, 揣少坤, 阎海, 廖美琳, 管忠震, 孙浩
2018年3月8-9日, 中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)和中国抗癌协会肺癌专业委员会联合主办了第15届“ 中国肺癌高峰论坛”。本次论坛的主题为 “ 聚焦中枢神经系统转移:精确诊断, 精准治疗”。
晚期肺癌患者往往合并脑转移, 在1 000多例的肺癌尸检结果中, 肺癌脑转移发生率23%~36%, 是脑转移性肿瘤中最常见的类型, 且通常预后较差[1]。目前肺癌脑(膜)转移的综合治疗管理和治疗结果, 仍不令人满意, 治疗效果不佳, 中位总生存时间16个月, 其中脑膜转移的患者则仅为4.5个月左右[2-5]。近10年肺癌的治疗出现了革命性的改变, 但肺癌脑转移的诊断和治疗成了提高肺癌长期生存率的瓶颈。临床医师及科研工作者, 应如何对脑转移进行准确及时的诊断?在众多的分型分类体系中, 又该如何参考应用?如何全面地对脑转移患者的颅内/颅外病灶进行合理评估?对于伴有驱动基因敏感突变的脑转移患者群体, 应怎样对待酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗的定位和应用时机?随着血管生成抑制剂和免疫检查点Checkpoint抑制剂的应用发展, 新的治疗选择在肺癌脑转移治疗应用中又该如何管理?以上都是肺癌脑转移综合管理中的疑点和难点, 急需解答和形成共识以指导临床实践。本次肺癌高峰论坛, 综合近年来发表的前瞻性及回顾性重要研究结果、结合我国肺癌脑转移治疗管理的实际情况, 与会专家们就肺癌脑转移的综合管理进行了详细的讨论和各抒己见的争辩, 最后达成了以下四点共识。
本共识的共识级别为:
1A 级:基于高水平证据(严谨的Meta分析或RCT结果),专家组有统一认识;
1B 级:基于高水平证据(严谨的Meta分析或RCT结果),专家组有小争议;
2A 级:基于低水平证据,专家组有统一认识;
2B 级:基于低水平证据,专家组无统一认识, 但争议不大;
3级: 专家组存在较大争议。
1.共识一:肺癌脑(膜)转移的诊断需结合中枢神经功能、颅脑影像学和脑脊液细胞学检查结果三要素综合考虑, 一旦诊断成立, 推荐使用GPA进行分级分型; 有条件者可考虑行CSF的二代测序检查
共识级别:2A。
基于目前的临床证据, 提高脑转移及脑膜转移诊断的准确性, 需要综合考虑患者的临床神经症状、神经影像学以及脑脊液(cerebrospinal fluid, CSF)细胞学信息。对于脑膜转移, CSF细胞学资料具有重要诊断价值。Chamberlain等在《Neuro Oncol》发表的结果表明, CSF检测对于脑膜转移诊断的敏感性及特异性均高于神经影像学(90.5%)及神经功能症状的提示(57.1%)[6]。但是, 目前CSF检测时机往往较为滞后, 诸多患者在出现明显神经症状和影像学表现后才完善CSF检查。基于目前的临床数据, 适当提前CSF检测时机, 将有效提高脑膜转移的诊断效率, 同时对患者的预后及治疗措施产生更为积极的影响。
广东省肺癌研究所的研究表明, CSF基因突变谱的检测, 上清液ctDNA检测的敏感性和特异性高于细胞沉渣的DNA检测。CSF ctDNA检测结果表明, 脑膜转移具有不同于原发肿瘤病灶的独特基因突变谱, 对于转移病灶特有基因突变谱的分析, 为了解和进一步定义脑膜转移提供了重要证据支持, 为探讨脑膜转移的发生机制和治疗策略打开了全新的大门。完善CSF二代测序(next generation sequencing, NGS)检查, 对于脑膜转移的精确诊断、分型和后续治疗, 具有重要指导意义[7]。
明确诊断是治疗的第一要务, 而进一步对脑(膜)转移的评分评级有助于及时发现预后良好的亚群并给予及时准确的临床干预。Arvold等在2016年提出的分级预后评估(graded prognosis evaluation, GPA)评分标准中纳入了年龄、KPS评分、转移灶数目等患者临床信息, 根据GPA评分与预后建立匹配, 计算得到0~1、1.5~2、2.5~3和3.5~4四个预后分数分层, 对应3个月、5.5个月、9.4个月和14.8个月的中位生存时间。而对于软脑膜转移, 则可以根据转移病灶数目、伴随神经症状及机体性能状态等方面, 分为良性预后组和不良预后组。Remon等通过影像学特征对脑膜转移进行了细分, 分为弥漫型和结节型。在弥漫型脑膜转移患者群体, 往往会因为增强MRI检查阴性而错失治疗时机, 对此类型的脑膜转移, 尽早完善CSF检查, 有助于对弥漫型脑膜转移这一类预后较好的肺癌患者的诊断和治疗[8]。
随着对肺癌脑转移分子类型和基因背景的深入研究及TKI药物的临床应用, 构建基因背景与预后的联系变得尤为重要。Sperduto等在2017年发布的Molecular-GPA分级标准中, 在传统的GPA系统中加入了EGFR、ALK突变作为预后因子的影响要素。Kaplan-Meier曲线表明, 纳入基因突变数据评估的GPA分数, 可以很好地区分不同亚型对治疗的临床获益[9]。
综上, 本共识认为, 脑和脑膜转移的诊断中, 应重视神经症状、影像学证据及CSF资料的综合评估, 确诊后的脑转移及脑膜转移, 推荐使用GPA系统进行分型分级。鉴于脑膜转移特有的基因状态和环境, 基于CSF的NGS检测, 对指导诊断及治疗具有重要参考意义。
2.共识二:建议临床试验应尽量包括脑转移患者以保证试验结果的普适性; 推荐RECIST结合RANO-BM作为疗效评价标准; 建议临床试验的终点指标应包括脑和脑膜转移的疗效评价指标, 颅内疗效评价和全身疗效评价应联合应用
共识级别:2A。
对于脑(膜)转移的疗效评估, 有赖于现有临床试验的数据证据。但是, 目前开展的临床试验, 大部分在纳入标准中将脑转移患者排除在外, Camidge等综述了现行临床试验对脑转移患者的纳入情况, 研究表明1/2至2/3的临床试验中, 并没有纳入脑转移患者。新药研究的试验中, 也有14%~19%排除了脑膜及脑转移患者。而在纳入了脑转移患者的临床试验中, 其中也有41%将纳入标准限定为接受治疗后病情稳定的脑转移患者。1/2至2/3的晚期脑转移患者被排除在临床试验之外, 其结果不可避免会导致临床试验结果的偏倚。综上, 诸多对脑转移患者的限制, 势必会影响临床试验对实践应用的指导意义, 同时不利于对脑转移治疗情况的真实了解。所以, Camidge在该综述中特别强调了临床试验纳入脑转移患者群体的重要性[10]。
对于脑转移的疗效评价, 待评估病灶的选择及适用性尤为重要。一般根据病变长径及转移位置, 将脑转移病变分为可评估病灶(> 10 mm; 当以5 mm作为标准时, MRI检测应以1.5 mm层厚进行评估)及不可评估病灶(< 10 mm)。同时拟评估病灶的选择应同临床试验的设计终点相匹配, 当以客观缓解率为主要临床试验终点指标时, 可测量病灶应作为必备条件; 当以无进展生存期(progression free survival, PFS)及总生存期(overall survival, OS)为临床终点指标时, 可包括不可测量病灶(非靶病灶)[11]。
目前, 对于脑转移疗效的评估体系繁多, 包括RECIST1.0、RECIST1.1、Macdonald等评估方法。RANO工作组在2015年提出了RANO-BM疗效评估体系, 对比应用较为广泛的RECIST体系, 将靶病灶的评价, 从一维的最长径测量改为对结节大小进行垂直交叉两径的评估, 同时在评估时限、激素应用反应以及临床神经症状改善等方面进行了综合评价。需要注意的是, RANO-BM中强调对脑转移的靶病灶及非靶病灶均应进行有效评估, 同时将两者均纳入到了疗效定义的标准中来。明确的非靶病灶进展, 同样应作为病情进展、中断治疗的标准。
对现在开展的涉及脑转移评价的临床试验, 强调了颅内外病灶独立评估的重要性。颅内病灶评估应避免受到颅外病灶评估的干扰, 在确定疗效时, 颅内病灶评估应依照RANO-BM标准, 而颅外病灶参考RECIST1.1标准。为了进一步独立评估两者的疗效反应及临床获益情况, RANO-BM标准中提出了中枢神经系统(central nervous system, CNS) PFS及non-CNS PFS分别作为临床终点指标, 构建了双相(bi-compartmental) PFS的概念。相对于单方面(颅内或颅外)进展的病灶管理及评估, 双相PFS具有较好的可操作性和指导意义, 既强调了颅内病灶评估的特殊性, 同时考虑了整体病情特征及疾病的发生发展。由于颅内转移灶治疗干预的手段过于繁多, 于是RANO-BM标准中, 增加了局部 CNS PFS和远隔CNS PFS两个概念, 以适用于不同临床试验干预情况下的评估需求[11]。局部CNS指的是经过局部干预的靶病灶, 远隔CNS指的是没有经过局部干预的颅内病灶, 两种情况出现其中一个疾病进展, 都应判断为CNS进展(见表1)。
表1 双相PFS的判别标准

综上, RANO-BM评价标准结合了临床试验需求及颅内转移病灶的特殊性, 在增加评估标准的同时, 为脑转移病灶提供了更多用于评估疗效的方法, 更加全面严谨地反映了临床试验及临床实践中脑转移病灶疗效的真实情况。本共识建议, 应在RECIST评估体系的基础上, 结合RANO-BM评估标准作为评估参考的补充, 强调颅内外独立评价及综合评价的重要性。同时, 目前临床试验应尽量包括脑转移患者以保证临床试验结果的普适性。
3共识三:对于脑(膜)转移伴有EGFR或ALK等驱动基因阳性的NSCLC, 推荐TKI为首选治疗; 建议探索多发脑转移TKI序贯或联合全脑放疗的临床试验
共识级别:2A。
既往对于肺癌脑(膜)转移的治疗, 由于颅脑特有的生理结构血脑屏障的存在, 全身治疗一直被认为疗效欠佳。直到现代小分子靶向药物的问世及长足发展, 肺癌脑转移治疗效果的明显提高, 也促使大家对血脑屏障和小分子靶向药物之间的关系重新思考。一项回顾性研究的数据表明, 现代的全身治疗方法使得患者的OS获益显著提高, 脑转移患者接受现代全身治疗方案的群体死亡风险明显降低(风险比0.24, P=0.007)[12]。Cheng等在一篇综述中系统地总结了肺癌脑转移患者现代全身治疗方案中的主力军——TKI, 在血脑屏障影响下的CSF 浓度水平及相关IC50, 不同TKI药物的CSF水平及CSF的IC50差别显著[13]。Dempke等发表于2015年的综述, 汇总了临床试验中各类TKI药物治疗非小细胞肺癌(non-small cell lung cancer, NSCLC)脑转移的有效缓解率均在70%以上, 疗效差别与CSF的IC50关系并不明显。可见, 血脑屏障并不是TKI对于脑转移病灶疗效的唯一决定因素, 不能简单地依赖CSF药物浓度来评估TKI对脑转移治疗效果的优劣[12]。
目前针对肺癌脑转移的治疗, 临床应用包括多种干预手段和治疗方案, 例如全身化疗、全脑放疗( whole brain radiotherapy, WBRT)等。Ⅲ 期多中心临床研究BRAIN对比了TKI药物与WBRT对于伴有EGFR突变的多发肺癌脑转移患者的疗效, 结果表明, 相比WBRT, Icotinib可以显著提高该患者群体的中位PFS(10个月 vs. 4.8个月, 风险比=0.59, P=0.014)。这说明, TKI药物对比WBRT, 更适用于伴有EGFR敏感突变的肺癌脑转移患者[14]。同时, 基于另一个大型Ⅲ 期临床试验AURA3中脑转移群体的数据分析结果表明, 对比含铂双药化疗方案的临床疗效, 在伴有EGFR T790M突变肺癌脑转移患者群体中, Osimertinib可以显著提高患者的CNS中位PFS(11.7个月vs. 5.6个月, 风险比 0.32, 95%可信区间 0.15~0.69, P=0.004)。Osimertinib组的客观缓解率也明显高于化疗组(40% vs. 17%)[15]。由此可见, 在具备靶基因突变背景的脑转移患者中, TKI治疗优于WBRT及化疗等治疗方案。
由于肺癌脑转移患者往往需要联合应用局部治疗, 以进一步提高患者的临床生存获益, 局部立体定向放疗(stertacitic radiation therapy, SRT)与TKI的治疗时机选择, 成为综合治疗策略中需要解决的重要问题。Magnuson等进行了一项回顾性研究分析, 以明确SRT/WBRT与TKI治疗干预的次序不同, 会对EGFR敏感突变患者的生存获益产生如何的影响。结果表明, SRT干预后, 序贯行EGFR-TKI治疗的患者群体, 具有较长的OS生存获益(46个月)。而推迟放疗时机, 优先选择TKI治疗, 将可能导致OS获益降低(25个月)。但是该研究为回顾性分析, 各亚组中, 临床分期及无症状患者群体分布并不均衡。同时, 该研究对颅外转移病灶、神经症状缓解情况等资料随访缺失, 不利于对脑转移治疗疗效的准确评估[16]。需要考虑的是, 伴有EGFR、ALK突变的脑转移患者群体, 在接受TKI治疗过程中, 往往具有较长的生存获益, 而WBRT的介入和应用, 可造成CNS相关毒副作用, 影响患者的生存质量。就目前临床证据而言, 放疗的最佳时机仍尚未明确, 需综合考虑患者各方面情况, 谨慎制定治疗方案。Martinez等在评价了目前所有的肺癌前瞻性研究结果之后认为, 依据目前的证据, TKI治疗干预应考虑放在优先的位置, WBRT应推迟使用[17]。
对于肺癌脑膜转移患者群体, Tan等综述了既往脑膜转移患者应用TKI治疗的临床获益情况, 结果表明, EGFR-TKI治疗, 可以在初治脑膜转移患者群体, 获得14~19.2 个月的中位OS[18]。
除了常规TKI给药方案之外, 多个小样本回顾性研究表明, 大剂量脉冲式TKI给药, 有望提高一线TKI治疗失败后脑膜转移患者的生存预后。Grommes 等在NSCLC脑转移患者中, 尝试给予1 500 mg每周厄洛替尼脉冲治疗, 获得了12个月的中位生存时间[19]。需要强调的是, 大剂量TKI脉冲治疗, 可作为一线治疗失败后脑膜转移的后续治疗方案, 但应警惕增加剂量所带来的不良反应。
鞘内化疗(intrathecal chemotherapy, ITC)一直作为颅脑肿瘤的治疗选择方案之一, 同样有部分临床试验数据证明其对脑转移患者具有一定疗效。Wu等回顾分析了589例肺癌脑转移患者, 研究表明单独采用ITC治疗干预的37例患者, 得到了7.5个月的中位OS, 优于其他接受多种综合治疗手段的肺癌脑转移患者(3~5 个月)。Beauchesne综述了部分临床试验中, 接受ITC的脑膜转移患者生存获益情况, 结果表明鞘内注射包含甲氨蝶呤、阿糖胞苷等化疗药物, 可以提高脑膜转移患者的生存获益[20]。但是ITC对于肺癌脑膜转移的确切疗效和最适宜患者群体, 尚需临床试验进一步验证。
综上, 基于大样本Ⅲ 期随机对照临床试验数据, 对于携带EGFR、ALK敏感突变的脑(膜)多发脑转移患者, 应将TKI作为首选治疗手段。对于SRT/WBRT等局部干预手段在多发脑转移的合理使用, 应综合考虑患者的整体情况及局部放疗所致的不良预后权衡使用。大剂量TKI冲击治疗可作为复治脑膜转移患者的备选方案。同时临床试验应探索TKI序贯治疗联合WBRT对于多发脑转移患者的疗效。
4.共识四:对于驱动基因阴性的肺癌脑(膜)转移患者, 放疗、全身化疗、鞘内化疗仍是主要的治疗方案。在传统治疗干预的基础上, 可探索联合应用抗血管生成药物或Checkpoint抑制剂
共识级别:2B。
对于不伴有驱动基因的肺癌脑(膜)转移患者群体, 多数情况下, 需依据患者具体疾病特征, 选择包括系统性全身治疗、局部放疗和手术干预等不同的治疗方案。Fenske等综述了世界部分国家地区脑转移患者对于各种治疗方法的不同预后情况, 结果显示, 放疗、系统性治疗及手术干预均能带来临床获益, 但未能说明哪一种治疗方法有压倒性的优势。这说明, 在不含有驱动基因敏感突变背景下的肺癌脑转移患者群体, 目前尚无明确的最佳治疗方案[21]。
化疗作为系统治疗中的经典治疗措施, 在肺癌脑转移治疗中一直作为系统治疗中的重要干预措施。Waqar等系统地比较了一线化疗应用中, 不同含铂双药化疗方案对于脑(膜)转移的疗效差异, 卡铂联合紫杉醇等含铂双药方案的中位OS为5.1个月, 而顺铂联合培美曲塞可以带来更为乐观的中位生存获益(7.4个月)[22]。Moro-Sibilot等开展的FRAME研究中, 培美曲塞联合顺铂化疗, 同样以9.3个月的OS优于紫杉醇、长春瑞滨等含铂化疗方案。综上, 在肺癌脑转移患者治疗中, 培美曲塞联合顺铂似乎优于其他含铂双药联合方案[23]。
除去传统的系统性治疗、局部放疗及手术干预, 以贝伐单抗为代表的血管生成抑制剂, 在肺癌脑转移肿瘤治疗应用中都带来了令人期许的临床获益。Besse等在Ⅱ 期随机对照临床试验BRAIN中, 评估了贝伐单抗在非鳞NSCLC患者群体中的治疗效果, 该试验表明, 贝伐单抗联合紫杉醇, 可以为Ⅳ 期非鳞NSCLC脑转移患者带来6.7个月的中位PFS, 其中56.5%的患者得到了6个月以上的PFS[24]。其余包括PASSPORT、ATLAS、SAIL等临床试验的数据结果均表明, 抗血管生成药物拥有良好的脑(膜)转移治疗疗效。探讨抗血管生成药物联合方案治疗脑转移是未来的重要研究方向[24]。
免疫治疗作为当代治疗最为瞩目的生力军, 在各类肿瘤治疗中攻城拔寨, 势不可挡。在肺癌脑转移治疗中, Checkpoint抑制剂同样表现出异军突起的强劲势头。目前应用较为普遍的三种Checkpoint抑制剂— — Atezolizumab、Nivolumab以及Pembrolizumab, 都有脑转移的疗效评估证据。OAK试验表明, 接受Atezolizumab治疗的肺癌脑转移患者可以获得长达20.1个月的总生存时间, 也是免疫治疗中唯一明确表现出生存获益的Checkpoint抑制剂[25]。而Nivolumab和Pembrolizumab在KEYNOTE024和CheckMate017试验中同样表现出对肺癌脑转移患者群体的有效性。一项前瞻性的小样本临床研究表明, Pembrolizumab对CNS转移患者群体具有可靠的疗效[26, 27]。
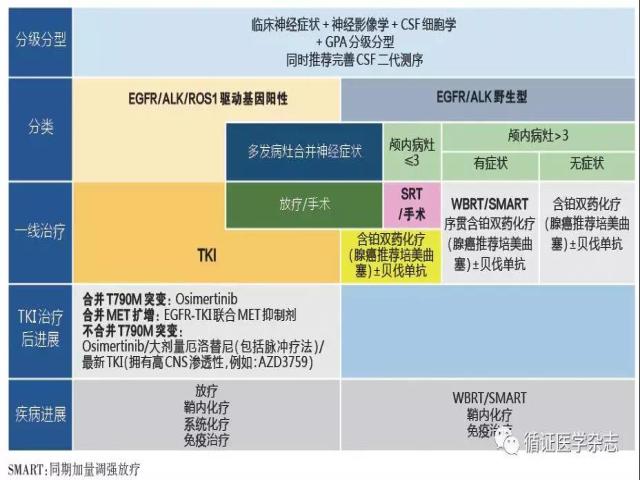
综上, 不同于携带驱动基因敏感突变的肺癌脑转移患者, 驱动基因阴性群体, 对于多发脑转移治疗的主要方案, 仍局限于放疗、全身化疗、ITC等。目前仍无可靠证据确定最佳的化疗方案, 但培美曲塞联合顺铂双药化疗方案在肺癌脑转移群体中表现出更优的临床获益。抗血管生成药物及Checkpoint抑制剂的应用, 为肺癌脑转移患者带来了更多选择和新的希望, 可以谨慎地前瞻性小规模应用于部分脑转移患者群体。 图1为汇总当前肺癌脑和脑膜转移的治疗策略建议, 供临床实践应用。
图1 当前肺癌脑和脑膜转移的治疗策略
5.肺癌脑转移未来的展望
晚期肺癌患者中, 有24%~44%的患者最终会合并脑转移, 导致神经功能障碍和死亡。传统的治疗方法, 很大程度上只能缓解疾病进展所致的功能障碍, 带来较为有限的临床生存获益。然而, 近期不断涌现的基础实验证据和临床应用进展正在不断改善肺癌脑转移治疗的现状。这些进展包含了流行病学、遗传学、转移病灶微环境研究、软脑膜转移、神经功能认知、靶向治疗、免疫治疗及预防等各个方面。
近期, 有多个试验研究表明, 脑转移病灶具有与原发病灶不同的基因突变背景, 这些仅存在于脑转移病灶的突变信息, 表明肿瘤细胞在转移发展中产生了区别于原发肿瘤的分支进化[28, 29]。对于转移病灶进化和特有基因背景的研究, 有助于发现全新的治疗靶点及临床干预方式。转移病灶分子分型信息的完备和研究的进一步深入, 将为肺癌脑转移的精准治疗带来革命性进展[30]。
Checkpoint抑制剂的问世和全面发展, 为“ 沉寂” 良久的肿瘤免疫治疗注入了全新活力。大量已开展的临床试验表明, Checkpoint抑制剂可以为脑转移患者带来确切的临床获益。而其中的潜在作用机制囊括了局部和全身效应, 这包含其诱发的效应免疫细胞激活及颅内病灶的募集作用。Checkpoint抑制剂的问世全面启动了免疫治疗的发展, 近期涌现出来多种利用免疫细胞编辑、肿瘤疫苗预防等治疗手段, 以达到预防及治疗脑转移的作用。同时, 研究发现肺癌脑转移患者颅内病灶的炎性环境明显区别于原发灶, 开发全新的免疫治疗干预手段及对转移灶免疫微环境的深入探究, 将为肺癌脑转移的治疗带来新的突破[30, 31]。
对于脑转移的预防及微转移病灶的监测, 可以使肺癌脑转移的治疗时机得到提前, 同时更大程度上提高其生存期。WBRT作为较为普遍的脑转移预防手段, 可以有效杀伤微转移病灶, 但其往往会带来较为严重的毒副反应和神经功能障碍, 严重降低患者的生存质量。所以, 急需一种可以带来长期有效、耐受性良好的预防策略。其中, TKI的发展和应用, 为预防脑转移提供了希望和契机。而且第二代ALK-TKI可以在脑转移微病灶形成前, 通过与脉管系统相互作用而抑制循环肿瘤细胞的定植和转移起始[32]。
除了全身治疗管理的快速发展和研究进展之外, 局部治疗包括放疗技术的长足发展, 也为脑转移的治疗带来了新的希望。同期加量调强放疗的推广应用, 可以使肺癌脑转移的放射治疗得到剂量的更精准分布, 增强肿瘤杀伤作用的同时, 可以通过对重要器官的保护降低神经功能障碍的发生[33]。综上, NSCLC脑和脑膜转移的治疗已取得了重要进展, 尤其是EGFR突变和ALK融合亚型; 越来越多的来自基础和临床研究的证据表明, 大脑转移灶克隆的形成可能不同于颅外转移的机制, CSF液体活检可能是诊断和监测脑膜转移的有用工具— — 了解其独特的生物学特性, 并确定治疗耐药性的机制; 能通过血脑屏障的新靶向治疗, 改善了经过选择脑转移患者的疾病控制和生存。分子靶向治疗、化疗、放射治疗和支持治疗是治疗大多数脑膜转移的基本策略; 需要进一步研究免疫疗法在治疗脑膜转移中的作用。脑转移的管理包括神经认知功能的维持, 这对目前一些标准治疗方法如WBRT提出了新的思考; 临床前证据表明, 通过几种治疗方法, 预防脑转移是可行的, 然而, 这一实验性策略尚未被转化于临床。
基金项目:国家重点研发计划资助项目(2016YFC1303800)
【中图分类号】R734.2
【文献标识码】A
Doi:10.12019/j.issn.1671-5144.2018.04.001
参考文献:
[1]
OSTROM Q T, WRIGHT C H, BARNHOLTZ-SLOAN J S. Brain metastases: Epidemiology[J]. Hand b Clin Neurol, 2018, 149: 27-42.
[2]
EICHLER A F, KAHLE K T, WANG D L, et al. EGFR mutation status and survival after diagnosis of brain metastasis in non-small cell lung cancer[J]. Neuro Oncol, 2010, 12(11): 1193-1199.
[3]
PARK S J, KIM H T, LEE D H, et al. Efficacy of epidermal growth factor receptor tyrosine kinase inhibitors for brain metastasis in non-small cell lung cancer patients harboring either exon 19 or 21 mutation[J]. Lung Cancer, 2012, 77(3): 556-560.
[4]
LIAO B C, LEE J H, LIN C C, et al. Epidermal growth factor receptor tyrosine kinase inhibitors for non-small-cell lung cancer patients with leptomeningeal carcinomatosis[J]. J Thorac Oncol, 2015, 10(12): 1754-1761.
[5]
ZENG Q, WANG J, CHENG Z, et al. Discovery and evaluation of clinical cand idate AZD3759, a potent, oral active, central nervous system-penetrant, epidermal growth factor receptor tyrosine kinase inhibitor[J]. J Med Chem, 2015, 58(20): 8200-8215.
[6]
CHAMBERLAIN M, JUNCK L, BRANDSMA D, et al. Leptomeningeal metastases: A RANO proposal for response criteria[J]. Neuro Oncol, 2017, 19(4): 484-492.
[7]
JIANG B Y, LI Y S, GUO W B, et al. Detection of driver and resistance mutations in leptomeningeal metastases of NSCLC by next-generation sequencing of cerebrospinal fluid circulating tumor cells[J]. Clin Cancer Res, 2017, 23(18): 5480-5488.
[8]
REMON J, le RHUN E, BESSE B. Leptomeningeal carcinomatosis in non-small cell lung cancer patients: A continuing challenge in the personalized treatment era[J]. Cancer Treat Rev, 2017, 53: 128-137.
[9]
SPERDUTO P W, YANG T J, BEAL K, et al. Estimating survival in patients with lung cancer and brain metastases: An update of the graded prognostic assessment for lung cancer using molecular markers (Lung-molGPA)[J]. JAMA Oncol, 2017, 3(6): 827-831.
[10]
CAMIDGE D R, LEE E Q, LIN N U, et al. Clinical trial design for systemic agents in patients with brain metastases from solid tumours: A guideline by the response assessment in neuro-oncology brain metastases working group[J]. Lancet Oncol, 2018, 19(1): e20-e32.
[11]
LIN N U, LEE E Q, AOYAMA H, et al. Response assessment criteria for brain metastases: Proposal from the RANO group[J]. Lancet Oncol, 2015,16(6): e270-e278.
[12]
DEMPKE W C, EDVARDSEN K, LU S, et al. Brain metastases in NSCLC - are TKIs changing the treatment strategy?[J]. Anticancer Res, 2015, 35(11): 5797-5806.
[13]
CHENG H, PEREZ-SOLER R. Leptomeningeal metastases in non-small-cell lung cancer[J]. Lancet Oncol, 2018, 19(1): e43-e55.
[14]
YANG J J, ZHOU C, HUANG Y, et al. Icotinib versus whole-brain irradiation in patients with EGFR -mutant non-small-cell lung cancer and multiple brain metastases (BRAIN): A multicentre, phase 3, open-label, parallel, rand omised controlled trial[J]. Lancet Respir Med, 2017, 5(9):707-716.
[15]
WU Y L, AHN M J, GARASSINO M C, et al. CNS efficacy of Osimertinib in patients with T790M-positive advanced non-small-cell lung cancer: Data from a rand omized phase Ⅲ trial (AURA3)[J]. J Clin Oncol, 2018, Jul 30.
[16]
MAGNUSON W J, LESTER-COLL N H, WU A J, et al. Management of brain metastases in tyrosine kinase inhibitor-naive epidermal growth factor receptor-mutant non-small-cell lung cancer: A retrospective multi-institutional analysis[J]. J Clin Oncol, 2017, 35(10): 1070-1077.
[17]
MARTINEZ P, MAK R H, OXNARD G R. Targeted therapy as an alternative to whole-brain radiotherapy in EGFR-mutant or ALK-positive non-small-cell lung cancer with brain metastases[J]. JAMA Oncol, 2017, 3(9): 1274-1275.
[18]
TAN C S, CHO B C, SOO R A. Treatment options for EGFR mutant NSCLC with CNS involvement—Can patients BLOOM with the use of next generation EGFR TKIs?[J]. Lung Cancer, 2017, 108: 29-37.
[19]
GROMMES C, OXNARD G R, KRIS M G, et al. “Pulsatile” high-dose weekly Erlotinib for CNS metastases from EGFR mutant non-small cell lung cancer[J]. Neuro Oncol, 13(12): 1364-1369.
[20]
BEAUCHESNE P. Intrathecal chemotherapy for treatment of leptomeningeal dissemination of metastatic tumours[J]. Lancet Oncol, 2010, 11(9):871-879
[21]
FENSKE D C, PRICE G L, HESS L M, et al. Systematic review of brain metastases in patients with non-small-cell lung cancer in the United States, European Union, and Japan[J]. Clin Lung Cancer, 2017, 18(6) : 607-614.
[22]
WAQAR S N, MORGENSZTERN D, GOVINDAN R. Systemic treatment of brain metastases[J]. Hematol Oncol Clin North Am, 2017, 31(1): 157-176.
[23]
MORO-SIBILOT D, SMIT E, de CASTRO CARPEÑO J, et al. Non-small cell lung cancer patients with brain metastases treated with first-line platinum-doublet chemotherapy: Analysis from the European FRAME study[J]. Lung Cancer, 2015, 90(3): 427-432.
[24]
BESSE B, le MOULEC S, MAZIÈRES J, et al. Bevacizumab in patients with nonsquamous non-small cell lung cancer and asymptomatic, untreated brain metastases (BRAIN): A nonrand omized, phase Ⅱ study[J]. Clin Cancer Res, 2015, 21(8): 1896-1903.
[25]
RITTMEYER A, BARLESI F, WATERKAMP D, et al. Atezolizumab versus Docetaxel in patients with previously treated non-small-cell lung cancer (OAK): A phase 3, open-label, multicentre rand omised controlled trial[J]. Lancet, 2017, 389(10066): 255-265.
[26]
RECK M, RODRÍGUEZ-ABREU D, ROBINSON A G, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833.
[27]
BRAHMER J, RECKAMP K L, BAAS P, et al. Nivolumab versus Docetaxel in advanced squamous-cell non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(2): 123-135.
[28]
BRASTIANOS P K, CARTER S L, SANTAGATA S, et al. Genomic characterization of brain metastases reveals branched evolution and potential therapeutic targets[J]. Cancer Discov, 2015, 5(11): 1164-1177.
[29]
DING L, ELLIS M J, LI S, et al. Genome remodelling in a basal-like breast cancer metastasis and xenograft[J]. Nature, 2010, 464(7291): 999-1005.
[30]
VALIENTE M, AHLUWALIA M S, BOIRE A, et al. The evolving land scape of brain metastasis[J]. Trends Cancer, 2018, 4(3): 176-196.
[31]
MANSFIELD A S, AUBRY M C, MOSER J C, et al. Temporal and spatial discordance of programmed cell death-ligand 1 expression and lymphocyte tumor infiltration between paired primary lesions and brain metastases in lung cancer[J]. Ann Oncol, 2016, 27(10): 1953-1958.
[32]
PETERS S, CAMIDGE D R, SHAW A T, et al. Alectinib versus Crizotinib in untreated ALK-positive non-small-cell lung cancer[J]. N Engl J Med, 2017,377(9): 829-838.
[33]
KOOM W S, KIM T H, SHIN K H, et al. SMART (simultaneous modulated accelerated radiotherapy) for locally advanced nasopharyngeal carcinomas[J]. Head Neck, 2008, 30(2): 159-169.
本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论