作者:张建民,杨幼萍,朱扬丽(温岭市第一人民医院病理科)
来源:《临床与实验病理学杂志》 , 2011 , 27 (5) :455-462
宫颈鳞癌的癌前病变与HPV感染关系密切,因发现发病率相当高,正确的病理诊断是合适的临床处理的前题。宫颈鳞癌的癌前病变有多种分类方法,病理改变为一谱系,因而在病理诊断、分级和鉴别诊断方面难免有一些灰区,只有对之具备较充分的知识,才能对这类非常常见的疾病做出较好的病理诊断。
1、癌前病变的分类(classification of premalignant lesions)
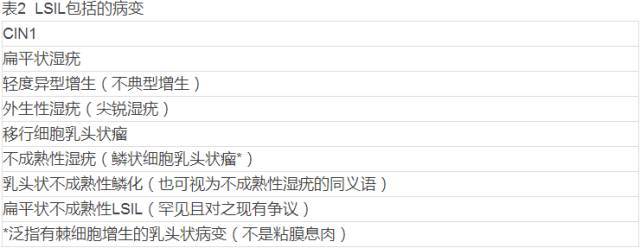
子宫颈鳞状上皮有恶性潜能的改变为癌前病变,近几十年大多数病理学家使用异型增生和原位癌(dysplasia and carcinoma in situ,CIS)系统或子宫颈上皮内肿瘤(cervical intraepithelial neoplasia, CIN)系统,对这类癌前鳞状上皮病变进行分类。近10年又出现仅用鳞状上皮内病变(squamous intraepithelial lesions,SIL)来命名宫颈癌前病变,并分为低级别和高级别两类的Bethesda系统。2003年WHO分类中子宫颈癌前病变采用的名称是宫颈上皮内肿瘤(cervical intraepithelial neoplasia),将异型增生/原位癌和鳞状上皮内病变置于同义语中。目前是异型增生/原位癌、CIN和SIL这三种系统同时并存,病理医师可各取所需,但一致认为与HPV关系密切(表1)。现美国较多采用SIL系统,国内也有些医院开始使用,然而SIL还包括了除CIN以外的其他病变(表2和3),因此不应将SIL与CIN完全等同,特别是低级别病变。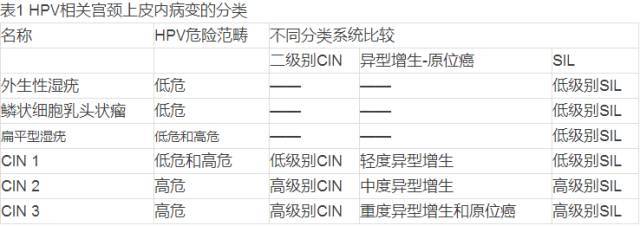

2、子宫颈上皮内肿瘤/鳞状上皮内病变的组织学诊断中几个应注意的问题
2.1 熟悉移行带的组织学特点:CIN多发生在宫颈移行带,有一319例宫颈锥要标本研究显示,CIN仅3.1%发生于外宫颈,10%病变完全被宫颈内膜上皮包围,其余87%均位于移行带。移行带的细胞有多能性和可塑性,因而分化有一较宽的范畴,按局部的PH和对炎性刺激的反应不同,可分化为柱状细胞和鳞状细胞,并常见贮备细胞。在HPV感染时不仅可转化为低和高级别CIN,也可转化为成熟和不成熟性鳞化,后者会有细胞不典型性。
2.2 除外非HPV的感染性病变:如疱诊病毒、巨细胞病毒、支原体和腺病毒感染等,除腺病毒感染外其他现今决非少见。前两种病毒均有特征的病毒包涵体可为诊断依据,支原体感染常有多量的急性和慢性炎细胞浸润,上皮细胞修复性改变,并常有淋巴滤泡增生。因此见到淋巴滤泡(滤泡性宫颈炎)要想到支原体感染。虽然这不是一早期和诊断性的特征,但是一常与阳性支原体培养相关的特征。
2.3 掌握病理诊断的标准和变异:CIN/SIL的病理诊断和分级取决于去分化的鳞状细胞在鳞状上皮中的位置和比例,而鳞状细胞的去分化与细胞的异型性和核分裂活动密切相关。因此,在判断CIN/SIL级别时,一定要把这三方面的特征都考虑进去。但又不能死板地应用上述这些组织学特征做为诊断的指导,因同一级别CIN的不同病例可有不同的形态学特征。如CIN3中有的病例无分化和成熟,核增大且深染但核分裂象却极少;相反有的病例则显示出可识别的分化并有一些核分裂和异常核分裂。因此对不同的病例,上述各项指标应稍有些侧重。如有的学者把上皮基底三分之一细胞的核异型性很显着的CIN归为CIN2。又如鳞状上皮去分化表现为细胞密度显着增高,细胞密度增高涉及的部位越高,去分化越严重,CIN/SIL的级别也越高。但有时细胞密度不高,而细胞异型性显着也可诊断高级别CIN。鳞状上皮的去分化还表现在细胞的层次增多,细胞层次越多则去分化越严重,如CIN3级时常有15-30层细胞。但有时细胞异型性显着的CIN3级可仅有5-10层细胞。
判断CIN/SIL的核分裂活动应注意:
①核分裂的数目;②核分裂在上皮中的高度;③有无异常核分裂。正常鳞状上皮有核分裂活动,但限于基底旁层。核分裂象增多是CIN/SIL的一个特征,而且上皮的不同高度或层次均可出现核分裂象,核分裂活动和病变的严重程度密切相关。因此,在考虑CIN/SIL的级别时,上皮中垂直位置的核分裂是一个有用的指标。同时应注意有无异常核分裂,异常核分裂象中以三极核分裂最多见,其次为不均衡的二极核分裂。Crum(2002)强调异常核分裂的意义,提出有病理性核分裂就应归入CIN2。英国学者则认为有异常核分裂可诊断CIN,但不一定是高级别CIN。此外,有人(Kurman等,1992)认为CIN2病例如核分裂多,且有接近表层的核分裂,应升级为CIN3。
另一点值得注意的是,CIN/SIL中常有空化细胞异型性,有空化细胞异型性的高级别病变可单纯分类为CIN2或CIN3;无论是低级别还是高级别CIN/SIL都无必要报告存在空化细胞异型性与否。一般认为在诊断CIN/SIL时对空化细胞的异型性常不作为诊断依据,特别是低级别CIN/SIL,否则会将CIN/SIL的级别拔高。但有例外 ,如CIN2中有一种成熟或空化细胞性CIN2(mature and koilocytotic CIN2),特点为有突出的以细胞空化为特征的病毒细胞学效应与基底旁细胞异型性同时存在,空化细胞有排列紧密的核周空泡和高的核密度。当然也有学者主张把上皮上三分之一有明确空化细胞(指有大而深染且皱的核和透明胞浆,以及厚的细胞“膜”),而上皮的下三分之一细胞无核异型性也放入轻度异型增生或CIN1,有人主张将扁平状湿疣放入CIN1,但一般认为这种情况诊断LSIL无问题。
诊断CIN时应注意基底细胞层的界限是否清楚,一般来说基底细胞层在CIN1级时界限常不清楚。如栅栏状基底细胞层界限很清楚时,诊断要慎重,特别是诊断高级别CIN。
CIN/SIL常累及腺体,然而并非宫颈表浅部分所有的轮廓平滑的鳞状细胞巢均为CIN累及腺体,应注意腺体鳞化和有推进状浸润缘的鳞癌表浅部分区别。前者细胞分化好,无明显核异型性,但如为不典型性鳞化则很难甚有时无法从组织学水平区别;后者可类似腺体累及,而且可因细胞坏死和细胞巢中央液化而出现“假腺”外观,但是无腺上皮,且细胞巢的细胞极性消失,因而不同于腺隐窝。
2.4 留意有助于低级别CIN/SIL诊断的特征:除了不典型细胞位于上皮的下三分之一外,Crum认缺乏明显的基底旁细胞不典型性(高级别鳞状上皮内病变的特征)才是诊断特征。低级别病变的核特征为:
(1)核虽大小不一,但核轮廓保持某种一致性;
(2)虽核深染,其深染在强度上较一致。次要标准为:①双核,90%的LSIL和湿疣有双核细胞,典型的双核细胞的核大而深染,但即使双核小而深染也有诊断意义;②不规则的核周空晕,有时多个细胞的核周空晕构成网状外观(Crum,2005)。
同时还要注意鳞状上皮上部的细胞是否有些不典型性,虽然CIN1级的鳞状上皮上三分之二均成熟,但一直到浅层都可有轻微的核不典型性。如上皮下三分之一的细胞密度增高,而上三分之二如同正常鳞状上皮,则可能是基底细胞增生而非CIN1级。此外,CIN1级极少有腺体累及。
2.5 观察有助于诊断高级别CIN/SIN的一些改变:
(1)CIN2和3的上皮表面有水平排列的角化不全细胞,其核不正常;
(2)在高级别CIN/SIL中其核大小和染色不一有时没有低级别CIN/SIL中明显,但一般核更密集、增大、深染,并有较高的核分裂指数;
(3)高级别CIN/SIL与低级别CIN/SIL相比,核有质的不同,表现为:①细胞不仅大小,而且轮廓更不一致;②核不仅深染,而且不规则和颗粒粗,且伴全核染色质密度不规则;
(4)诊断高级别鳞状上皮内病变的特征,包括核不典型性和细胞拥挤,很重要的是核的不典型性一直持续到表面的细胞,而且上皮层上部的核仍拥挤,这与反应性过程的表层上皮正常化不同,后者的胞浆增多且核之间的空间增大;
(5)高级别鳞状上皮内病变可伴化生性分化,如黏液上皮化生,因此要与不成熟性鳞化区别。这种情况Crum(2006)称为复层上皮内病变有柱状细胞分化(stratified intraepithelial lesions with columnar cell differentiation)。
此外,乳头状鳞癌的乳头衬覆上皮改变与HSIL类似,在证明了无间质浸润后,可诊断为原位乳头状鳞癌,属HSIL。
以下几点有助于高级别CIN/SIL区别低级别CIN/SIL:①较下层(不是最下层)上皮有核不典型性;②核分裂指数增高伴上皮上一半有核分裂;③细胞极性丧失;④异常核分裂;以及在有些病例中有显着异型的奇异核。
有些妇产科医师会要求将CIN3/SIL3中的原位癌在诊断中注明,认为临床处理有些不同。
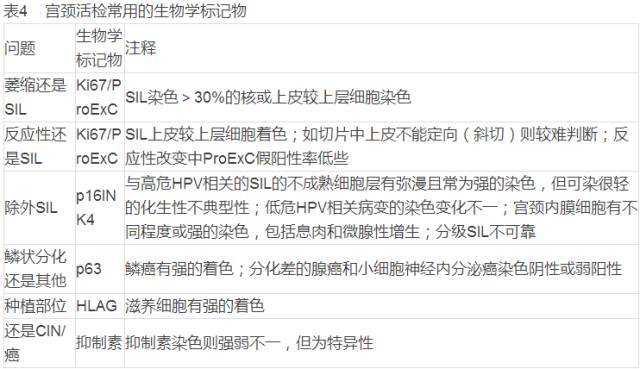
2.6 应用免组染色帮助诊断CIN:对CIN诊断最有用的两个免疫标记为p16和ki67,有助于区别CIN与其他情况。p16是一种对HPV相关CIN最有吸引力的标记,它的过表达可与HPVE7的持续表达有直接的联系。最近有研究表明p16在CIN的诊断中的价值比ki67大,p16的过表达不取决于与CIN相关的特殊类型高危HPV。不仅如此,而且p16在鳞化和反应/修复性病变中阴性。大约三分之二的低级别SIL与高危HPV相关,因此三分之一到一半的低级别CIN/SIL有弥漫的基底细胞阳性,三分之一的低级别CIN/SIL有局灶的基底细胞阳性。
当然也有的研究认为低级别CIN为局灶性阳性。虽然p16阴性不意味着病变不是CIN1,但上皮下一半p16阳性是病变为CIN的一相当好的指征。Ki67是一细胞增殖标记,可用于证实CIN,正常鳞状上皮仅基底旁细胞有局限性阳性染色,而CIN的阳性细胞可达上皮的上三分之二。但HPV阴性鳞化和反应性/修复性改变有时也可ki67阳性,从而使之逊色于p16。
2.7 一些特殊CIN
(1)角化性HSIL是HSIL的一变异型,特点为突出的异常表面上皮角化伴核密度增高和核深染,有不成熟化生表型的HSIL。这是另一种HSIL的变异型,这型HSIL最难识别,特别需要与反应性不成熟性鳞化区别,其特点为上皮的上部细胞核密度不减少,且可有核合体外观,以及核深染。偶而这类异常的鳞状细胞可长到柱状上皮的下方。
(2)子宫颈嗜酸性异型增生(eosinophilic dysplasia of the cervix),Ma等(2004)描述并相信它是高级别鳞状上皮内病变的一种变异型,设想系鳞化的宫颈上皮其后感染中或高危HPV所致。组织学特征为:①鳞状上皮缺乏正常的成熟;②与常规的HSIL相比,细胞有较丰富的嗜酸性胞浆;③细胞的核浆比轻度增加;④有局灶性的细胞核显示核增大、深染、不同程度的核膜不规则和可见核仁。在他们所收集的44例中,大多数病例在整个病变中有3个以上的不典型细胞,但无明显的高级别CIN/SIL特征。病变周围常有宫颈鳞化和/或常规SIL(LSIL或HSIL),90%以上病例有高的P16和MIB1阳性,45%伴HSIL,34%伴LSIL或湿疣病变,13%的标本中无SIL。
(3)意义不能确定的基底细胞异常(basal abnormalities of uncertain significance,BAUS): 这个概念指的是尚不能归为CIN的细胞“不典型性”,表现形式有三:其一为在无严重炎症情况下,仅限于基底层的细胞有轻微的多形性;其二为虽具有CIN1的形态特征,但有严重的炎症存在;其三为薄层上皮有CIN(无法定级别)的特征,但有严重的炎症存在。(4)CIN(级别难定)(CIN(grade not specified)): 当上皮仅少数几层细胞,虽有CIN的组织学一般特征,但因上皮太薄不能很有把握地进行CIN定级别时,可用此名称。然而前提是没有严重的炎症存在,如有则应归入不能确定的基底细胞异常。
2.8 CIN病变为一谱系,各级别之间无绝然的分界:CIN与不足CIN的鳞状上皮很轻微异型改变之间也无绝然的分界,因而在CIN的诊断中尽然存在一些灰区,常常成为诊断的困难之处。如在几种介于低级别CIN/SIL和高级别CIN/SIL之间的病变:①基底旁细胞富于细胞性增加的CIN1;②有轻微核大小不一的扁平性不成熟性病变(flat immature lesions with minimal nuclear anisokaryosis)。他们将这类情况称之为‘难准确分级的SIL(SIL,not amenable to precise grading)’(CIN1-2);③有异常核分裂或单个奇异核的等同于湿疣的病变(lesions identified to condyloma but containing abnormal mitoses or single bizarre nuclei)。关于这种改变在没有较下层细胞的其他的核异常性的情况下,是否可诊断为CIN2尚有争议。
3、宫颈上皮内肿瘤(鳞状上皮内病变)的鉴别诊断
3.1 反应性和修复性改变:反应性和修复性改变特别需要与低级别的CIN或SIL区别。反应性的核异型性包括核增大、深染和双核或多核,与CIN或SIL不同的是这些核通常限于上皮的较下部分,有正常的成熟过程,上皮上部的细胞核仅轻微增大,下部的轻度不典型细胞和上部的成熟细胞之间有清楚的界限。
不像典型的CIN或SIL细胞,反应性细胞常有海绵化(细胞间水肿),胞界清楚,核间隔规则,可有突出的核仁或染色中心,但核的大小和轮廓无显着的不一致,也无粗块状深染。胞浆如有空晕,则空晕圆而一致,核位于其中央。
反应性鳞状细胞常伴急慢性炎细胞,如有许多中性白细胞、溃疡和坏死细胞,应寻找有无疱疹病毒包涵体。如有致密的急性和慢性炎细胞伴淋巴滤泡,则示衣原体感染之可能。
Ki67指数在反应性细胞中明显低于CIN1或LSIL细胞,一般基底层细胞不足15%Ki67阳性,上皮的上一半几乎无阳性细胞。
当上皮的较表浅层有核异型以及超过通常程度的核增大和核深染,又存在上述的反应性改变,要考虑低或高级别SIL的诊断。特别是见到以下两点,应注意是否为SIL这一问题:①核间距不规则或极性丧失;②有分散的核增大且深染细胞和核大小不一,以及表层有核增大且深染的细胞存在。
在有些病例中,不可能在良性的反应性改变与有或无反应性改变的CIN或SIL二者之间做出明确的区别(如意义不能确定的不典型鳞状上皮),对这类病例应联系细胞学检查结果和结合免疫组化诊断。
3.2 基底细胞增生(basal cell hyperplasia):基底细胞增生表现为基底层细胞的复制有规律地增加并伴增大,但一般无核多形性和核深染,鳞状上皮的上半部分分化大致正常。基底细胞增生的意义尚不明,可能反映了原始鳞状上皮的不典型增生的早期状态。在某些情况下,区别基底细胞增生和CIN可能很困难,并且很大程度上取决于病理医师的观念。特别是中和上三分之二鳞状上皮完全正常,而基底和旁基底细胞形态明显异常时,如强调鳞状上皮上半部分正常,就诊断基底细胞增生;如强调基底和旁基底细胞的形态异常,则诊断CIN。
3.3 不成熟性鳞化:宫颈鳞化是内宫颈柱状上皮被鳞状上皮取代的一正常过程,在这个过程中早期化生的鳞状上皮常由单一性的高核浆比的细胞组成,这类细胞在表层无胞浆成熟。与CIN或SIL不同的是不成熟性鳞化虽有轻微的细胞拥挤,但一般无细胞异型性或仅具轻度反应性不典型性,其核大小基本一致,多形性不显着,核染色稍深,染色质细,核轮廓光滑,核分裂不常见且限于基底层,无异常核分裂。如核分裂多应考虑高级别CIN。不成熟性鳞化表面可有柱状上皮和黏液滴,这在HSIL中少见,当然不成熟性湿疣表面 也可有柱状上皮。
炎性不成熟性鳞化的上皮内有中性白细胞浸润,核大小较均匀且无深染和明显增大,虽细胞密度高些或表面细胞有些异型仍可与HSIL区别。
不典型不成熟性鳞化与CIN/SIL的区别,有时非常困难甚不可能。一般而言,不典型不成熟性鳞化的核密度稍低,核分布较均匀,核的轮廓较整齐,核分裂较少,ki67 阳性细胞少。应注意的是不典型不成熟性鳞化为一组异质性病变,除良性反应性病变外,可能包括一些微妙的高级别CIN/SIL或其前驱病变。因此建议少用该名称,用时应加以说明。
如有极度的核增大和深染存在于一其他方面为化生样的上皮中,应强烈考虑SIL。此外,如上皮从下到上均细胞密度显着增高,且表面上皮中有核增大和/或深染的细胞存在,应考虑HSIL。当区别不成熟鳞化和SIL,特别是HSIL有困难时,应用一些生物学标记物如p16和ki67等可帮助诊断。
3.4 绝经后鳞状上皮不典型(postmenopausal squamous atypia, PSA)和其他假性细胞空化(pseudokoilocytosis):PSA通常发生于50岁以上的女性,其特征为鳞状上皮细胞有显着的核周空晕,但核增大不超过2倍,无核深染和多核。PSA可伴假性细胞空化并误诊为LSIL,但PSA的HPV阴性,并可能伴萎缩或移行细胞化生。
与空化细胞性不典型性比较,PSA核的大小变化较小(小于2倍,而空化细胞不典型核大于3倍),深染没后者显着,染色质也较细且分布均匀,核间隔规则,核略拉长并位于轮廓一致的空晕的中央。有时可有核沟存在,核分裂罕见或无。
缺乏双核或多核细胞则倾向PSA而非空化细胞不典型性,如一高倍视野中有2个或更多的双核细胞则强烈提示空化细胞性不典型性。
其他形式的假性空化细胞,包括无核不典型性的作为孤立性发现的核周空晕(如正常有糖原的鳞状细胞)或有轻度反应性不典型性的核周空晕。
3.5 移行细胞化生和萎缩:这两种改变均导致上皮的正常成熟丧失,且可造成组成细胞有高的核浆比,但典型者细胞无核异型性,也无CIN/SIL中的核分裂活性,移行细胞化生的细胞常有纵行核沟,萎缩上皮薄层次少,无阳性Ki 67染色。
但移行细胞化生的上皮如有异型性,应诊断有移行细胞背景的CIN1/LSIL或CIN2.3/HSIL。
Crum等识别出一类“不典型萎缩(atypical atrophy)”病变,其与CIN/SIL的区别可很困难。
3.6 浸润性鳞状细胞癌:浸润性鳞癌的浸润细胞巢一般开关不规则,但少数情况浸润性鳞癌可有较规则的浸润细胞巢,可与高级别CIN/SIL累及腺体混淆。但癌巢虽可规则,其周围常有促纤维组增生反应。此外,浸润性癌巢中可因中央坏死而出现假腺腔,也可误为CINlxi腺,但其内无内衬柱状上皮,腔内为坏死组织碎屑。
3.7 乳头状鳞癌:在活检标本中因取材少见不到浸润的情况下,或是原位乳头状鳞癌有时可与高级别CIN混淆。由于乳头状鳞癌的乳头表被的异型鳞状上皮可与高级别CIN很相似,因此在小的活检标本中见到有明确纤维血管中轴的乳头披覆‘高级别CIN’鳞状上皮,很可能是乳头状鳞癌而不是高级别CIN,当然原位乳头状鳞癌可归入高级别SIL。
3.8 放疗后细胞异型:放疗后的鳞状细胞胞浆丰富且常空泡化,核深染且大小不一,但核浆比低,核的间隔较一致,无核分裂。
3.9 种植部位和胎盘部位结节或斑块:种植部位有时可见于宫颈,一般位于上皮下间质中,部间滋养细胞多边形,胞浆嗜酸事嗜双色,核可有明显异型性,可类似鳞癌及其前驱病变,在宫颈管刮出物标本中有时可引起混淆,但一般细胞密度无后者高,病变界限常欠清楚。困难的情况下,可用免疫组化帮助区别二者,中间滋养细胞虽CK阳性,但HPL、PLAP和抑制素等也阳性,这些与鳞状细胞不同。胎盘部位结节或斑块有时会与透明变性的子宫颈鳞状细胞癌及其前驱病变相混,但胎盘部位结节或斑块一般较小,细胞异型性小,核分裂也少,免疫组化HPL阳性和CK18阳性,Ki-670指数达远低于50%,而且细致检查找不到角化的鳞状细胞等。
3.10 乳头状不成熟鳞化:又称不成熟性湿疣,属于低级别SIL,但不等同于低级别CIN。虽细胞密度可较高,核/浆比增高,但核异型常不显着,表层有成熟趋势,最表层常有柱状上皮细胞。
3.11 人为改变:如电灼和机械性切割,特别是LEEP术标本的边缘,可因热灼而使鳞状上皮变形和深染,且极性改变和看上去层次增多。
4、CIN组织学和细胞学的一致性
4.1 正确理解与细胞学诊断一致性:目前许多宫颈活检是基于异常宫颈细胞学,虽然临床医师和病理医师都希望用活检的组织学改变来解释异常细胞学,但事实上接近70%、45%和20%的细胞学ASCUS、LSIL和HSIL,不能在活检中得到证实(Crum等,1997)。临床医师应对此注意,造成这种不一致的原因是多方面的,如临床取材不正确和细胞学解释,特别是对ASCUS的解释方面的主观性等。因此临床医师应对活检具备较现实的期望。同时,病理医师应避免对轻微改变的过分强调,以求得细胞学和组织学发现之间的一致性。
4.2 关于“意义不能确定的非典型鳞状细胞(ASCUS)”:在TBS系统的细胞学诊断中有“意义不能确定的非典型鳞状细胞(ASCUS)”这一名称,此外细胞学中还有一个核术语为“边界性核异质的细胞核改变(nuclear change bordering on dyskaryosis,NCBD)”。有人将与之对应的组织学改变称为细胞核稍增大的鳞状上皮(squamous epithelium with slightly enlarged nuclei)和意义不能确定的上皮改变(epithelial change of uncertain significance)。实际上这些情况的活检标本常仅显示核轻度增大,而大小和形状均一致,有较好的分化,核分裂即使有也不是非典型的核分裂,因而不足以诊断异型增生或不典型增生,而且常被诊断为正常或大致正常(如无病理性诊断或无诊断性异常可识别等)。Robboy等(2002)在他们的妇科病理专着中有一关于这种情况4年后回顾性复习的未发表资料,显示了细胞核稍增大的鳞状上皮届时的相关细胞学涂片结果为:9%正常,35%反应性,22%ASCUS,31%CIN1和3%CIN2。
4.3 细胞学和组织学诊断不一致:细胞学异常而活检正常,大约发生于细胞学诊断的15%的高级别SIL和40%的低级别SIL。如复查细胞学,诊断仍正确须随访病人,其中少数以后会证实有病变。HPV检测的价值有限,除非细胞学诊断有疑问。
(1)细胞学为低级别SIL,而组织学为高级别CIN/SIL。这发生于20%的细胞学低级别CIN/SIL诊断中。这可能与细胞取材只取到表面细胞或只取到病变的一部分有关。
(2)细胞学显示高级别SIL,而组织学为低级别CIN/SIL。这种情况不多见,需细致复看细胞学涂片,因其后有相当大的发生高级别CIN/SIL的危险。如细胞学确定为高级别CIN/SIL,应复查组织学切片。少数情况为既有低级别CIN/SIL又有高级别CIN/SIL。重要的是当病理医师面临细胞学高级别SIL时,应细致避免过多诊断CIN1,因这会误导临床医师设想病变为低级别CIN/SIL,而忽略了未取到的高级别CIN/SIL。

















共0条评论