[导读] 作者:王艳芬,周晓军
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是最常见的胃肠道间叶性肿瘤。近年来,随着对GIST的广泛认识,在临床工作中极易将其他一些形态学特征性不明显的胃肠道间叶性肿瘤过诊或误诊为GIST。事实上,除GIST外,平滑肌瘤和平滑肌肉瘤、神经鞘瘤、炎性纤维性息肉(inflammatoryfibroid polyp,IFP)、腹腔和肠系膜纤维瘤病、胃肠道血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)及腹腔内滤泡树突细胞肉瘤等也可发生于消化道。此外,国外文献最近相继报道了一些形态学特殊的胃肠道间叶性肿瘤的新病种,如胃肠道透明细胞肉瘤(clear cell sarcomaof gastrointestinal tract,CCS-GI)、胃肠道恶性神经外胚层肿瘤(malignant gastrointestinal neuroectodermal tumor,MGNET)、微囊/网状型神经鞘瘤、上皮样炎性肌纤维母细胞肉瘤(epithelioid inflammatory myofibroblastic sarcoma,EIMS)、胃丛状血管黏液样肌纤维母细胞肿瘤(plexiform angiomyxoidmyofibroblastic tumor,PAMT)等。由于对这些肿瘤组织学谱系和变异型尚未完全认识,在诊断中可能存在误区。该文对这些新近认识的胃肠道间叶性肿瘤作一简要阐述,着重强调各自独特的临床病理学特征、免疫表型、分子学特征、鉴别诊断以及生物学特性,以期为临床病理工作的诊断和鉴别诊断提供帮助,正确诊断这些肿瘤有助于患者的预后评估和个体化治疗。
1.CCS-GI
CCS-GI是一种特殊类型的胃肠道肿瘤,2003年Zambrano等报道一组发生于胃肠道的类似于软组织透明细胞肉瘤组织学特征且含有数量不等的破骨细胞样巨细胞肿瘤,并首次对其进行详细描述,认为该肿瘤是一种罕见的虽有透明细胞肉瘤特征但又与透明细胞肉瘤有明显差异的独立病变实体。WHO(2010)消化道肿瘤病理学与遗传学分类中新增加了这一特殊肿瘤类型。目前文献报道30余例,国内仅报道3例。CCS-GI发病年龄10~85岁(平均45岁),多发生于年轻人,无明显性别差异。CCS-GI临床表现主要为肠梗阻或大便带血,可伴不同程度腹痛、贫血等症状。CCS-GI可发生于消化道内各部位(胃、小肠、结直肠、盲肠)、肠系膜及胰腺。CCS-GI大体表现为浸润性生长的溃疡型肿块,直径2~5cm或更大,常可侵犯至浆膜甚至穿透浆膜层累及周围脏器。镜下肿瘤呈明显浸润性生长,肿瘤细胞弥漫片状、巢状分布,其间有宽窄不一的纤维组织分隔(图1),瘤细胞间有破骨细胞样多核巨细胞散在分布或灶性聚集(图2)。肿瘤细胞形态相对一致,呈圆形、卵圆形、短梭形,胞质丰富,透明或嗜酸,核卵圆形或略不规则形,核仁明显。免疫组化标记肿瘤细胞S-100呈弥漫阳性,HMB-45、Melan-A及其他间叶源性、上皮源性标志物均为阴性。超微结构观察显示瘤细胞分化差,无明确上皮性细胞间连接,胞质内含有线粒体、溶酶体、糖原等,细胞核不规则,核仁明显,未见典型黑色素小体。分子学研究证实CCS-GI存在特征性的基因易位,t(2;22)(q32;q12)/t(12;22)(q13;q12),导致EWSR1-CREB1或EWSR1-ATF1基因融合。CCS-GI具有高度侵袭性,预后差,肿瘤常转移至肠系膜淋巴结、肝脏和腹膜,多于确诊后2~3年内死亡。
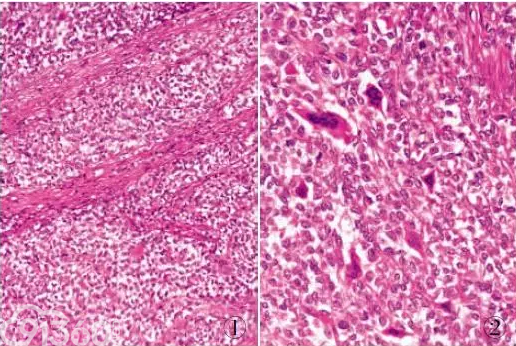
图1 CCS-GI: 肿瘤组织呈弥漫片状、巢状排列,被宽窄不一的纤维组织分隔
图2 CCS-GI: 肿瘤细胞间散在破骨细胞样多核巨细胞
鉴别诊断主要需考虑以下病变:
(1)转移性软组织透明细胞肉瘤:常有其他部位软组织的原发病灶,肿瘤组织呈明显的假器官样、簇状结构,最具特征性的是电镜观察可见典型黑色素小体及免疫组化标记HMB-45、Melan-A及S-100均阳性,而CCS-GI弥漫阳性表达S-100,不表达HMB-45和Melan-A,电镜观察也未见黑色素小体。
(2)上皮样GIST:肿瘤细胞常呈片状或簇状排列,胞质透亮/空泡状,核仁不明显。绝大多数GIST特征性表达CD117和DOG1,部分病例表达CD34,很少或仅局灶性表达S-100。免疫表型辅以c-Kit或PDGFRα基因突变检测有助于与CCS-GI的鉴别。
(3)胃肠道PEComa:肿瘤组织呈巢状、束状或弥漫排列,肿瘤细胞以上皮样细胞为主,梭形细胞相对少见,胞质丰富,透明或嗜酸,且缺乏破骨细胞样多核巨细胞。肿瘤间质较少,富含血窦及厚壁血管。肿瘤细胞常表达TFE3、HMB-45、Melan-A、desmin及SMA,不表达S-100。遗传学上,PEComa无EWSR1基因断裂易位。
(4)上皮样恶性周围神经鞘膜瘤(malignantperipheral nerve sheathtumor,MPNST):是一种MPNST的少见亚型,通常与外周神经干有关,主要由巢状、片状或结节状分布的卵圆形、多边形或短梭形上皮样细胞组成,可伴有或不伴有经典型MPNST成分。肿瘤细胞多表达MBP、S-100、NSE、vimentin,也可表达CK、EMA等上皮性标志物。免疫组化结合FISH检测EWSR1融合基因有助于鉴别。
(5)副神经节瘤:腹膜后恶性副节瘤可以累及肠道。其组织排列方式、细胞形态与CCS-GI很相似,但瘤细胞胞质丰富嗜酸,不透亮,且血窦样结构明显。免疫组化标记肿瘤细胞表达S-100和神经内分泌标志物以及电镜观察瘤细胞胞质内含神经内分泌颗粒可资鉴别。
2.胃肠道MGNET
2012年Stockman等在美国外科病理学杂志报道16例形态学独特的胃肠道肿瘤的临床病理、超微结构及分子学特征,并认为该组肿瘤是一种具有神经外胚层分化特征而缺乏黑色素表型的独立肿瘤实体,因此命名为MGNET。MGNET好发于年轻人,平均年龄42岁,性别差异不明显。临床表现无特异性,以腹痛、肠梗阻及腹部包块等症状为主。影像学检查可证实胃肠道占位性病变。MGNET多发生于小肠,其次是胃和结肠。大体上MGNET表现为外生性、息肉样或环状生长的实体性肿块,直径2.4~15cm,质硬,切面灰红色、分叶状,可伴有黏膜溃疡、灶状出血、坏死,肿瘤常可侵犯至浆膜甚至穿透浆膜层。肿瘤组织呈弥漫片状、巢状、假乳头状排列(图3、4),部分病例也可见假腺泡、束状、条索状、微囊状、假菊形团样排列结构,广泛性坏死多见。肿瘤细胞呈上皮样、卵圆形、梭形,胞质嗜酸或透明,核呈空泡状,核仁不明显或有小核仁,偶见明显核仁及核内假包涵体,核分裂象0~20个/10HPF,部分病例肿瘤细胞间可见散在破骨细胞样多核巨细胞。免疫组化标记肿瘤细胞一致性表达SOX10、S-100和vimentin,不同程度阳性表达CD56、Syn、NSE,而黑色素、GIST、上皮、间皮以及肌源性等标记均为阴性。超微病理显示肿瘤细胞具有原始神经外胚层分化特征,可见透明分泌囊泡、致密核颗粒,偶见缝隙连接,未见促黑色素生成迹象。分子遗传学上MGNET存在EWSR1基因重排。MGNET呈高度侵袭性生长,易发生局部淋巴结或肝脏转移,生存时间为1.5~106个月(中位生存期为32个月),多数患者生存时间少于24个月。
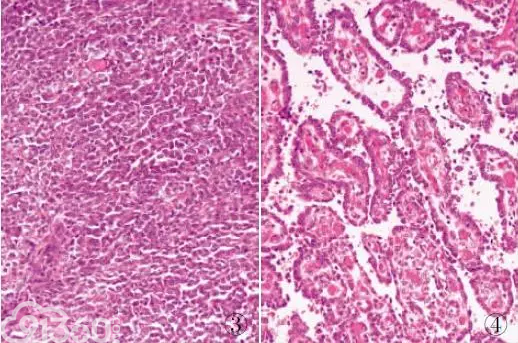
图3 MGNET:肿瘤组织呈弥漫片状排列
图4 MGNET:肿瘤组织呈假乳头状排列
MGNET需与以下几种肿瘤鉴别:
(1)骨外尤因肉瘤/原始神经外胚层肿瘤(primitive neurotodermal tumour,PNET):少数可发生于胃肠等实质脏器内,肿瘤组织呈弥漫片状、梁索状、假菊形团、器官样、血管瘤样、腺泡状等多种方式排列。肿瘤细胞以小圆细胞为主,少数为梭形。肿瘤细胞CD99、Fli1、NSE、Syn、vimentin呈强阳性,S-100表达不恒定,MGNET弥漫强阳性表达S-100,且常常不表达CD99。FISH检测二者均显示EWSR1基因重排,但融合形式不同。
(2)单相型滑膜肉瘤:通常只含有梭形细胞成分,免疫组化染色瘤细胞表达CK(AE1/AE3)、EMA、vimentin、CD99、BCL-2,部分病例可表达S-100、CD56。SOX10和CD99的免疫表型有助于二者的鉴别,SOX10在MGNET中呈阳性,滑膜肉瘤中呈阴性,而CD99在滑膜肉瘤中常呈阳性,在MGNET中呈阴性。SYT-SSX融合基因是滑膜肉瘤特征性的遗传学改变,而EWSR1基因重排则支持MGNET。
(3)胃肠道PEComa:肿瘤组织呈巢状、梁带状或片状排列,间质较少,可见丰富的毛细血管、血窦以及厚壁血管。肿瘤细胞以上皮样形态为主,梭形细胞少见,瘤细胞核显示明显多形性。肿瘤细胞可同时表达黑色素标志物(HMB-45、Melan-A、MiTF、TFE3)和肌源性标志物(SMA和desmin),MGNET中上述标志物均为阴性。免疫组化结合EWSR1断裂基因检测可区分二者。
(4)GIST:肿瘤细胞形态可表现为梭形、上皮样或二者混合型,且免疫组化标记多数病例CD117、DOG1、CD34呈阳性,较少或仅局灶性表达S-100。免疫表型以及c-Kit基因突变检测有助于鉴别。
3.微囊/网状型神经鞘瘤
微囊/网状型神经鞘瘤是一种罕见的神经鞘瘤新亚型,由Liegl等于2008年首次报道,目前文献已报道21例,国内仅报道1例。WHO(2013)软组织肿瘤新分类增加了这一亚型。微囊/网状型神经鞘瘤主要发生于内脏器官,尤其是胃肠道,也可发生于周围软组织。该肿瘤多发生于成人,发病年龄11~93岁(平均58岁),无明显性别差异。发生于胃肠道的微囊/网状型神经鞘瘤常无明显临床症状,常在体检或其他手术中偶然发现。肉眼观察肿瘤直径0.4~23cm,境界清楚,无包膜或包膜不明显,多数病例以膨胀性生长为主,个别病例可见灶性浸润性生长,切面呈多结节状。组织学上与普通神经鞘瘤明显不同,肿瘤无包膜,肿瘤周围有致密胶原纤维但并不完整包裹肿瘤。肿瘤组织呈结节状分布,其间为纤细的胶原纤维分隔。肿瘤细胞分布不均,细胞疏密区之间有移行。细胞稀疏区瘤细胞主要呈相互吻合交通的微囊状、网状排列(图5),也可见花边样、梁索状、簇状、筛状、窦隙状或迷路样排列方式(图6)。细胞密集区瘤细胞呈实性片状、簇状排列,部分区域细胞间见黏液性微囊形成。肿瘤细胞形态温和,呈梭形、上皮样细胞形态,胞质透亮或嗜酸,核仁小而不明显,核分裂象罕见,部分病例可见泡沫细胞样、印戒细胞样、脂母细胞样瘤细胞。肿瘤间质常伴有明显黏液变性或玻璃样变性,缺乏厚壁血管,无出血、囊性变或坏死。免疫组化标记肿瘤细胞表达S-100,部分病例GFAP、CD34和CD56呈不同程度表达,CKpan、EMA、Syn、CgA、SMA、desmin、CD117、HMB-45、CD68、CD10和p63等均阴性。查阅国内外文献,微囊/网状型神经鞘瘤尚未见复发或转移病例,其生物学行为与普通神经鞘瘤相似,并不具有明显侵袭性,预后良好。
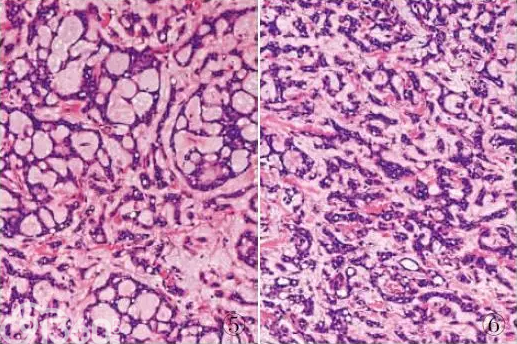
图5 微囊/网状型神经鞘瘤:肿瘤组织呈微囊状排列,间质黏液变性
图6 微囊/网状型神经鞘瘤:肿瘤组织呈梁索状、簇状排列
微囊/网状型神经鞘瘤非常罕见,病理医师缺乏认识,极易误诊为其他胃肠道肿瘤,诊断时主要与下列疾病鉴别:
(1)黏液样GIST:该肿瘤在影像学、大体表现上均与微囊/网状型神经鞘瘤具有一定的相似性,但组织学上GIST少见微囊状或网状生长方式。免疫组化标记CD117、CD34、DOG1均阳性,或可检测出c-Kit或PDGFRɑ基因突变有助于鉴别。
(2)神经内分泌肿瘤:消化道较常见的肿瘤,肿瘤呈器官样、巢团状排列,其间富含血窦。肿瘤细胞表达上皮性和神经内分泌标记,而微囊/网状型神经鞘瘤上皮源性标志物均阴性。
(3)黏液腺癌或印戒细胞癌:在微囊/网状型神经鞘瘤的显著黏液变性区,常可见囊状、花边样的上皮细胞团漂浮在黏液中,类似黏液腺癌。免疫组化标记上皮性标记阴性即可排除诊断。
(4)胃肠神经鞘瘤:常由梭形细胞构成,类似于细胞性神经鞘瘤,Antoni A和B区特征不明显,肿瘤周围常见结节状淋巴细胞套,而微囊/网状型神经鞘瘤的组织学更具有特征性。
4.胃PAMT
PAMT是一种最近报道的罕见特殊类型的胃间叶性肿瘤,2007年由Takahashi等首次报道并命名,此后,部分学者也曾命名为“丛状血管黏液样肿瘤”或“丛状纤维黏液瘤”,WHO(2010)消化系统肿瘤分类中采用了丛状纤维黏液瘤这一名称。所谓的丛状血管黏液样肿瘤、丛状纤维黏液瘤和PAMT在本质上属于同一形态学谱系,但PAMT更能明确反映肿瘤的组织学特征和分化方向。PAMT均发生于胃,以胃窦部为主,部分可累及十二指肠,发病年龄7~75岁(平均年龄42岁),无明显性别差异,临床表现以上消化道症状为主。肉眼观察肿瘤可为黏膜下、浆膜外或累及整个胃壁的结节状肿块,境界较清,直径0.8~15cm,可伴黏膜溃疡、胃壁穿孔或囊性变。组织学上,PAMT呈特征性的丛状或多结节生长方式,穿插于肌束之间,肿瘤细胞呈梭形,形态温和,被富含薄壁血管的黏液样或纤维黏液样基质分隔,部分病例伴大量胶原形成。高倍镜下见肿瘤细胞边界不清,胞质略嗜酸,核卵圆形,无明显异型性,核仁不易见,核分裂活性低(平均1个/50HPF)。阿辛蓝染色示黏液样基质阳性,PAS染色阴性。免疫表型:梭形肿瘤细胞SMA、MSA和vimentin均阳性,部分瘤细胞h-Caldesmon阳性,CD117、CD34和DOG1均阴性。电镜观察也显示该肿瘤有肌纤维母细胞分化特点。PAMT呈良性临床经过,预后好,目前尚无复发或转移的报道。
PAMT具有独特的组织学特征,诊断并不困难,但需与以下疾病鉴别:
(1)GIST:组织学上GIST几乎不呈丛状生长方式,瘤细胞表达CD117、DOG1和CD34,可检测出c-Kit或PDGFRα基因突变。
(2)胃平滑肌瘤:较常见,肿瘤组织呈束状、编织状排列,梭形瘤细胞胞质明显嗜酸,而PAMT与平滑肌瘤的细胞学和组织分布特征不同。平滑肌瘤SMA、MSA、desmin和Caldesmon均阳性,而PAMT瘤细胞desmin阴性。
(3)炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor,IMT):由梭形肌纤维母细胞和多量炎细胞以不同比例混合组成,无丛状生长方式,瘤细胞除表达SMA、desmin外,常可表达ALK1。
(4)胃肠道神经鞘瘤:肿瘤细胞呈束状排列,无丛状/多结节状生长方式,瘤周常有淋巴细胞套,肿瘤细胞表达S-100,可资鉴别。
(5)纤维瘤病:病变境界不清,梭形瘤细胞呈束状或波浪状排列,无丛状多结节生长特点,瘤细胞除表达vimentin、SMA、MSA和desmin外,β-catenin核阳性,可资鉴别。
(6)IFP:肿瘤由梭形至上皮样细胞组成,间质明显水肿伴大量炎细胞和显著的毛细血管网,但缺乏丛状结节状生长方式,以及梭形细胞表达CD34和PDGFRα有助于与PAMT鉴别。
5.EIMS
IMT是一种由分化的梭形纤维母细胞/肌纤维母细胞组成且常伴大量浆细胞和(或)淋巴细胞浸润的肿瘤,IMT有复发、转移倾向,且半数以上病例具有ALK基因易位,WHO(2013)软组织肿瘤分类将其归为中间型肿瘤。IMT好发于儿童和青少年,平均年龄10岁,男女比约为1∶1.4,最常见的发病部位是肺,肺外好发部位为胃肠道、肠系膜、泌尿道、头颈部及周围软组织等。最近研究显示腹腔内IMT更具有复发倾向,少数病例经多次复发后可转为肉瘤。2011年Marino-Enríquez等报道了11例具有上皮样形态的IMT,由于该组肿瘤呈侵袭性生物学行为,且预后较差,故将该组病变命名为EIMS。目前文献仅报道13例,国内仅1例。目前文献报道大部分EIMS发生于腹腔,以网膜和肠系膜多见,发病年龄7个月~61岁(平均39岁),男性明显多于女性。临床上主要表现为腹痛,或伴腹腔积液。大体上肿瘤直径8~26cm(平均15cm),单个或多个病灶,切面实性,灰白、灰红色相间,部分区域伴黏液变性。组织学上,EIMS主要由上皮样至圆形肿瘤细胞组成,呈弥漫片状排列,间质内伴有大量炎细胞浸润,以中性粒细胞为主,偶可见淋巴细胞、浆细胞或嗜酸粒细胞浸润或混合存在,部分病例间质呈明显黏液样变,少数病例伴胶原化。肿瘤细胞胞质丰富,嗜酸或嗜双色,泡状核,核仁明显较大,核分裂象1~18个/HPF(平均4个/HPF),并见大片状坏死,局部区域(≤5%)可见梭形细胞成分。免疫表型:肿瘤细胞表达desmin、CD30和ALK,部分病例表达SMA,ALK阳性模式主要为细胞核膜着色,有时可表现为胞质着色伴核周空晕,而在IMT主要为胞质着色。分子遗传学显示EIMS常有ALK基因重排,RANBP2-ALK是最常见的融合形式。由于EIMS与IMT有相似的免疫表型和分子学特征,故被认为是IMT的高度侵袭性亚型,EIMS易复发和转移,临床进展快,部分患者在术后2.5~36个月内死亡。
胃肠道EIMS极其罕见,主要需与以下病变鉴别:
(1)肉瘤样癌:胃肠道肉瘤样癌属高度侵袭性肿瘤,组织学上具有梭形细胞和上皮样细胞成分,免疫组化标记肿瘤细胞表达CK(AE1/AE3)、vimentin,不表达SMA、calponin及ALK1。
(2)平滑肌肉瘤:肿瘤组织呈束状、编织状排列,瘤细胞梭形,含明显嗜酸性胞质,核深染,异形明显,病理性核分裂象易见,可见凝固性坏死。免疫组化染色示肿瘤细胞SMA、calponin、h-Caldesmon及desmin均阳性,但ALK1阴性。
(3)ALK阳性的间变性大细胞淋巴瘤:该肿瘤累及胃肠道较罕见。肿瘤细胞体积大,胞质丰富,核呈明显多形性。免疫组化标记除ALK及EMA阳性外,CD30、CD3及细胞毒性相关抗原也可阳性。
(4)结外滤泡树突状细胞肉瘤:该肿瘤由增生的梭形和卵圆形细胞构成,呈漩涡状或束状排列,间质有淋巴细胞浸润,可与EIMS混淆,但肿瘤细胞CD21、CD23和CD35均阳性,SMA和ALK均阴性。
6.琥珀酸脱氢酶(SDH)缺陷型GIST
大多数GIST为散发性,但有10%的GIST与某些综合征相关,临床上常以综合征的形式表现,如Carney三联征或Carney-Stratakis综合征。因此,最近一类具有独特临床病理特征的GIST被命名为SDH缺陷型GIST,主要包括Carney三联征、Carney-Stratakis综合征以及90%儿童和10%成人野生型GIST。WHO(2013)软组织肿瘤新分类增加了这一特殊类型。SDH缺陷型GIST多见于女性儿童和青年人,几乎均发生于胃,尤其是胃窦部,也可为多灶性生长。组织学上常呈多结节状或丛状生长,瘤细胞以上皮样细胞形态为主(图7),也可与梭形细胞混合存在(图8)。与SDH表达型GIST不同,该型GIST常见淋巴管侵犯和区域淋巴结转移,即使肿瘤发生转移时也常呈惰性的临床过程,且该型肿瘤不能通过肿瘤大小和核分裂象评估肿瘤的危险程度,核分裂象少者可发生转移,核分裂象活跃者也可不发生转移。SDH缺陷型GIST肿瘤细胞不表达SHDB,但CD117、DOG1呈强阳性表达,分子学检测显示缺乏c-Kit或PDGFRα基因突变,并且对伊马替尼治疗不敏感。研究表明SDH缺陷型GIST即使发生转移不做特殊治疗也可长期生存,另外,该型GIST发生转移的间期较长,故需长期随访,因此该型GIST预后较好。
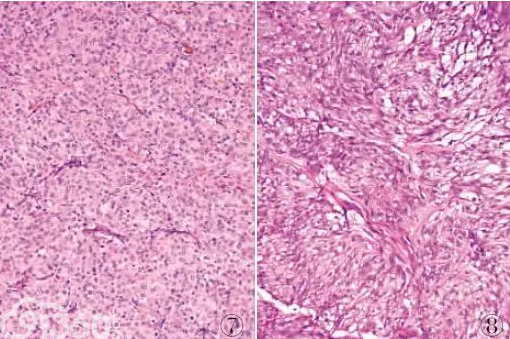
图7 SDH 缺陷型GIST:肿瘤主要由上皮样细胞组成,呈丛状或实性片状分布
图8 SDH 缺陷型GIST:肿瘤由上皮样细胞和梭形细胞混合组成
以上总结的几种胃肠间叶源性肿瘤均为近年来被发现和认识的新类型,目前国内病例报道仍较少,深入了解和认识这些肿瘤的临床特点、形态学特征、免疫表型、分子学特征以及生物学行为具有重要的临床实践价值,将有利于提高病理诊断的准确性。
参考文献(略)

















共0条评论