作者:沈丹华(北京大学人民医院病理科)
随着宫颈筛查的广泛开展,宫颈鳞状上皮性肿瘤性病变的发病率在全球呈现下降的趋势,而腺性肿瘤性病变则呈现上升趋势。文献报道宫颈腺癌在宫颈癌中所占比例由上世纪50年代的5%上升到本世纪的10%~25%,并且年轻患者的数量明显增加[1]。因此,宫颈腺性肿瘤性病变的诊断以及临床处理也越来越受到关注。宫颈腺性肿瘤性病变主要分为腺性癌前期病变、早期浸润性腺癌和腺性恶性病变(浸润性腺癌)。2014年第4版WHO分类对上述腺性肿瘤性病变的命名及分类做了一些修订,以下结合这些变化就其相关病理学特征做简要介绍。
1、宫颈腺性癌前期病变
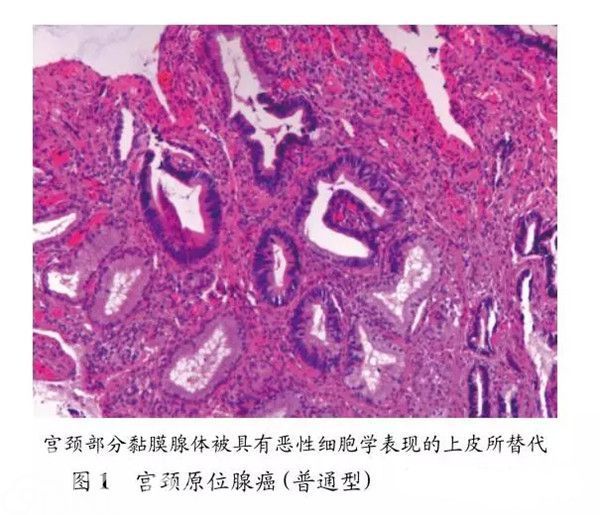
早在1953年Friedell和McKay就描述了宫颈腺性癌前期病变,并将其命名为原位腺癌(adenocarcinoma in situ,AIS);而在英国等国家将其命名为宫颈腺上皮内瘤样病变(cervical glandular intraepithelial neo-plasia,CGIN),并且分为两种级别,低级别CGIN(low-grade CGIN,LG-CGIN)和高级别CGIN(high-grade CGIN,HG-CGIN)[2]。在2003年第3版WHO分类中,则采用的是腺性异型增生(glandulardysplasia)和AIS来命名腺性癌前期病变[3]。而在2014年第4版WHO分类中仅将AIS列入腺性癌前期病变,同时将HG-CGIN列为AIS的同义词,并给出的定义是:呈现恶性表现的腺上皮内病变,这一病变如果不治疗具有明显进展为浸润性腺癌的风险。这一版分类中在腺性癌前期病变中没有保留腺体异型增生这一类型[4]。AIS好发平均年龄段为30~40岁,较浸润性腺癌年轻10~15岁。患者常无临床症状,多是在细胞学筛查中偶尔发现异常腺上皮细胞。更为常见的情况是在发现异型鳞状细胞或是因鳞状病变进行宫颈切除术时偶然发现。大部分AIS发生在宫颈的移行带1cm之内,有些病变可以向上累及到宫颈管内口的3cm以上。几乎所有的AIS都可以检测出高危型HPV,其中以18型最为常见。大体上,AIS很难通过阴道镜检查发现病变。多数AIS是局灶性的,但大约有13%~17%的病例呈现弥漫多灶性,少数病例可以呈跳跃性的多灶病变。显微镜下,几乎所有的AIS均累及宫颈表面上皮和腺体。正常腺体结构尚保存,但黏膜上皮或腺腔上皮被覆核大、深染且有核仁的恶性细胞,细胞核分裂活性增加,细胞胞浆黏液减少,上皮呈不同程度的复层,病变上皮细胞与正常腺上皮细胞之间常常突然转化。AIS根据上皮细胞不同表现可分为普通型、肠型及子宫内膜样型等亚型,其中最为常见的是普通型,也称为宫颈内膜型。这型AIS具有与正常子宫颈黏液上皮相似的结构特征,病变细胞有中等量的胞浆,核染色质粗(见图1)。
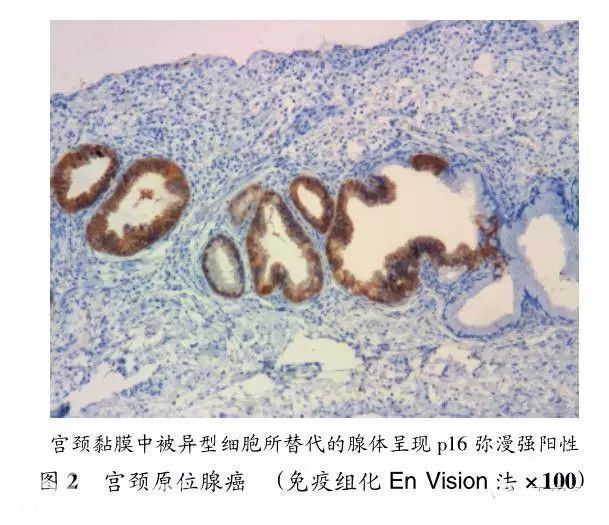
除上述亚型外,在第4版WHO分类中,还介绍了一种较为少见的类型,称为复层产生黏液的上皮内病变(stratified mucin-producing intraepitheliallesion,SMILE)。这是一种罕见的腺性癌前期病变,可能是一种储备细胞的高度异型增生的表现,常出现在高度鳞状上皮内病变(HSIL)或AIS/HG-CGIN病变中,有时也可见于浸润性鳞状细胞癌或腺癌周围,病变类似HSIL,但胞浆中含有黏液。临床处理上应该按照AIS处理[4]。免疫组化染色对于诊断AIS具有辅助诊断意义,此时p16常呈弥漫强阳性表达(见图2)。此外,Ki-67在AIS时呈高表达。而ER和PR表达常常缺失。
2、宫颈早期浸润性腺癌
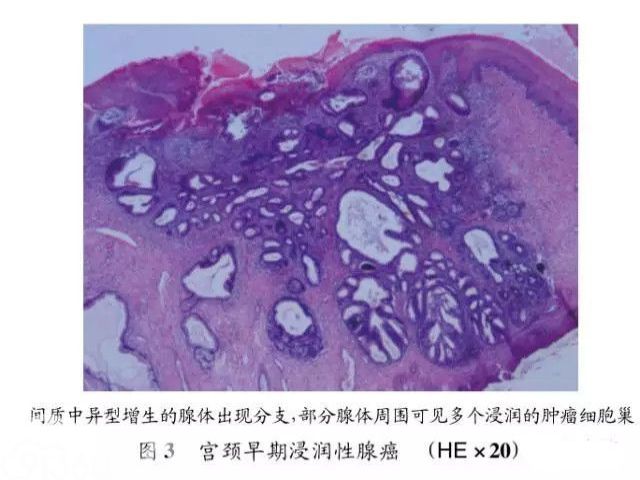
宫颈早期浸润性腺癌是指浸润性腺癌最早期的形式,淋巴结转移的危险性低。也有学者将其命名为微小浸润腺癌,但是多数学者不建议使用这个名称。因为腺癌的病变性质经常是多灶性,且部分是跳跃性生长,处理上也较鳞状病变极,而“微小”一词,有可能导致对病变的低估。第4版WHO分类中并没有将早期浸润性腺癌单独分类列出,但在腺癌的组织病理特征中提到腺癌的早期浸润特征,具体如何判断是否为早期浸润性腺癌,可依据FIGO分期来确定[4]。但在不同国家以及机构中所制定的标准也并不一致,在英国等地限定为FIGOⅠA期,包括FIGOⅠA1和FIGOⅠA2,即其浸润腺癌的深度≤5mm,宽度≤7mm;而在美国以及美国妇科肿瘤学会(SGO)等机构则限定为FIGOⅠA1期,其浸润腺癌的深度≤3mm,宽度≤7mm。虽然如此制定,但是在实际病理诊断中早期浸润性腺癌的深度测量较为困难,需要具有专门经验及训练的病理医生来确定诊断。临床上,早期浸润性腺癌发病平均年龄在39~44岁,介于AIS与浸润性腺癌之间。多数病例没有症状,有些病例可出现性交后出血。阴道镜检查,仅有少数病例可发现异常。细胞学涂片表现类似于AIS。大体上,早期浸润性腺癌难以观察到明确肿物,其表现类似于AIS。显微镜下,早期浸润性腺癌的细胞学改变与AIS相近,与之不同的是组织结构的变化:腺体更加密集、形状更不规则,乳头及筛状结构更为多见,局灶可以出现融合(见图3)。腺体常常扩散到正常腺体不应该出现的部位。腺体周围的间质出现水肿,炎症细胞浸润和促结缔组织增生性表现。部分病例可以找到血管-淋巴管间隙受累。
诊断早期浸润性腺癌时,首先要注意与AIS鉴别:主要观察病变腺体是否局限在正常腺体所在位置,腺体是否出现出芽及广泛的筛状结构、腺体融合以及宫颈表面是否出现乳头状突起。
3、宫颈浸润性腺癌
宫颈浸润性腺癌是指具有明确间质浸润,显示腺性分化的宫颈癌。发病高峰平均年龄为50岁,94%的宫颈腺癌伴有高危型HPV感染,最常见的类型是18、16和45。与鳞状细胞癌不同,腺癌中HPV18的感染率高于HPV16型[1,3,4]。患者可出现异常子宫出血,部分病例会出现阴道排液及疼痛表现。细胞学检查,一些病例可以发现异常,但其细胞筛查的阳性率明显低于鳞状细胞癌。浸润性腺癌5年整体生存率与鳞状细胞癌相近,主要取决于临床分期,ⅠA期在93%以上,而到了Ⅱ期则生存率下降到50%以下[4]。大约50%的病例可以在阴道镜下看到宫颈外生性肿物,少部分病例可以在宫颈表面形成溃疡性,极少部分病例在宫颈上看不到明确的肿物,但宫颈管壁弥漫增厚。组织病理学上,依据肿瘤中腺体结构及细胞中黏液成分的多少以及含有其他组织细胞成分的特征,进一步分成不同的组织学类型。见表1。

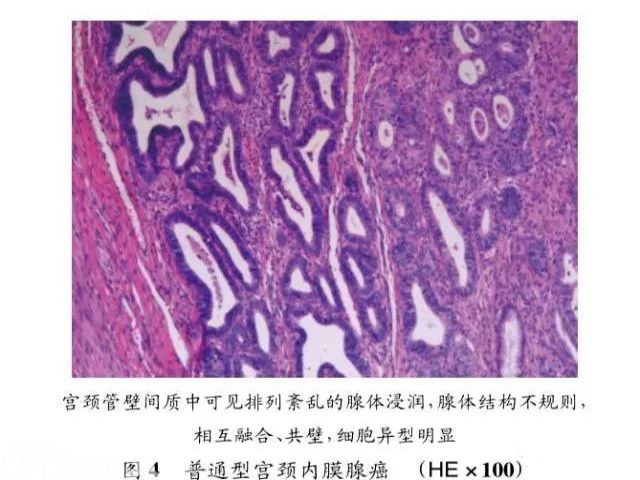
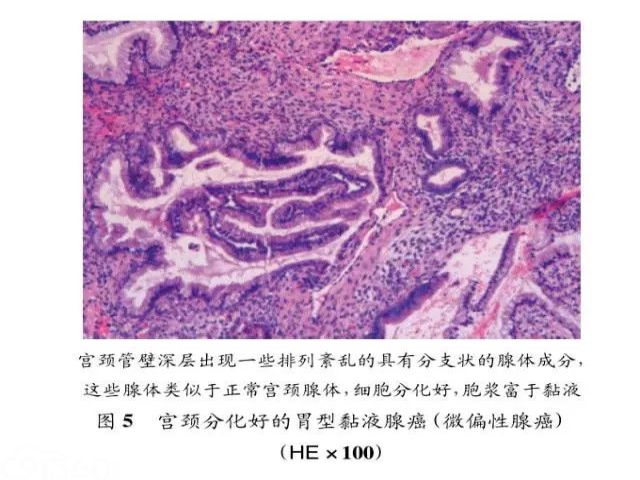
普通型宫颈内膜腺癌是最常见的类型,肿瘤呈现中~高分化,由圆形或卵圆形腺体组成,其中黏液成分较少,腺腔中可以出现筛状及乳头状结构,腺腔被覆的细胞排列成假复层,细胞核增大,深染,胞浆淡染或嗜酸性,靠近腔缘可见核仁及核分裂象(见图4)。免疫组化染色p16呈弥漫阳性,Ki-67增生指数高。第2种较为常见的腺癌是黏液性癌,在第4版WHO分类中将黏液性癌特别分出一个亚型为胃型黏液性癌(mucinous carcinoma,gastric type){4},显示胃型腺体分化;如果分化非常好时,被命名为微偏性腺癌(minimaldeviation adenocarcinoma)或恶性腺瘤(adenoma malignum)[5]。此型肿瘤常缺乏HPV感染的证据,但可能与宫颈小叶状腺体增生有关。临床上此型腺癌的发病平均年龄为42岁,有些患者伴有Peutz-Jegh-ers综合征,临床上可出现阴道流血及排液,由于肿瘤细胞常常分化较好,因而在细胞学及活检时,常难以发现异常变化。这一肿瘤如发生转移,最易转移到卵巢。
大体上,宫颈常常难以看到明确肿块,但宫颈质地变硬韧,呈桶状,黏膜表面可见出血、质脆及黏液状。切面呈黄色或灰白色。偶尔,囊腔很明显。显微镜下,在宫颈间质中见由黏液上皮组成的腺体浸润,腺体大小不等,细胞胞浆透亮或淡染,细胞核增大,深染,可见核分裂像,但较为罕见。当肿瘤分化极好时,腺体与正常宫颈腺体几乎无法区别,但病变腺体侵犯的深度超出宫颈正常腺体所在的范围(>超过8mm),有时可以在深部的血管和神经周围找到异常腺体成分(见图5)。
免疫组化染色,由于这型腺癌与HPV感染不相关,因此,p16一般呈阴性或局灶阳性表达,但是肿瘤可以呈现胃幽门腺标志物阳性,如MUC6和HIK1083阳性。文献报道,胃型腺癌的整体预后较普通型腺癌差,5年整体生存率为30%,明显低于普通型腺癌的74%。即使是分化型的腺癌,预后也不佳,这可能与肿瘤不易早期发现,诊断时多已是高临床分期有关。此外,在这一版分类中还单独分类列出了腺癌混合神经内分泌癌(adenocarcinoma admixed with neuroendocrine carcinoma)[4]。这一肿瘤是指在不同类型的宫颈腺癌中显示神经内分泌分化。肿瘤中腺癌成分可以是原位腺癌也可以是浸润性腺癌,所占比例较少。肿瘤中的神经内分泌癌成分的病理形态与宫颈单纯的神经内分泌癌相似,可以是小细胞性高级别神经内分泌癌,也可以是大细胞神经内分泌癌。肿瘤预后差,呈高度侵袭性。因此,在宫颈腺癌中,出现类似神经内分泌肿瘤成分时,应该加做免疫组化染色,检查是否有神经内分泌标记。其他类型的宫颈腺癌就更为少见了,主要依据细胞形态及组织结构进行诊断,其病理表现与发生在其他部位的同名称肿瘤相似。
这里特别要提出的是在宫颈腺癌的诊断中要注意与子宫内膜来源的腺癌进行鉴别,因为两者的治疗及手术方案完全不同,准确诊断尤为重要。除依据临床影像帮助判断原发部位外,病理诊断起决定作用,可结合免疫组化的标志物帮助诊断。最后在宫颈腺上皮肿瘤病变的病理诊断中,还需要与一些腺性良性病变及瘤样病变进行鉴别诊断。总之,宫颈腺性肿瘤性病变的病理形态较为复杂,诊断具有难度,对于有疑问的可请病理专家会诊明确诊断,以便后续的治疗与预后评估。
参考文献:
[1] 郑文新,沈丹华,郭东辉主编。妇产科病理学[M].北京:科学出版社,2013:197-228.
[2] Mc Cluggage WG. New developments in endocervical glandular lesions[J].Histopathology,2013,62(1),138-160.
[3] Tavassoli FA,Devilee P. WHO classification of tumours. Pathology andgenetics of tumours of the breast and female genital organs[M].3rd Eds.IARC Press:Lyon,2003:266-272.
[4] Kurman RJ,Carcangiu ML,Herrington CS,et al.WHO classification of tumours of female reproductive organs[M].4th Eds. IARC Press:Lyon,2014:183 -194.
[5] Clement PB,Yong RH.Atlas of gynecologic surgical pathology[M].Elsevier Inc,2008:114-138.



















共0条评论