作者:李挺(北京大学第一医院病理科)
所谓“乳腺良性增生性病变”包含乳腺一大组非常异质性的病变,对其基本认识在20 世纪末已达成基本共识。乳腺高危病变是其中一组临床、病理学和生物学上的异质性疾病,这些疾病诊断之后长期持续性乳腺浸润性癌发生的危险性增加,但危险程度和水平各异,有些预示乳腺癌的发生风险,而有些则是乳腺癌的直接前驱病变,因此,临床意义与干预策略也不同。该组病变中非典型导管增生、非典型小叶增生和小叶原位癌双侧乳腺发生浸润性癌的相对危险性增加,小叶原位癌危险性更高并为非责任性前驱病变;导管原位癌被认为是真正的前驱病变,同侧最终发展为乳腺癌的风险较大。平坦上皮不典型性危险水平尚不明确。目前尚缺乏临床病理学和分子方面个体化危险性预测指标,这是未来个体化危险性处理战略的关键所在。
女性乳腺组织学主要实质性组分为上皮组织,虽与乳腺中大量纤维脂肪等软组织相比仅占很少比例,但却是乳腺主要疾病的发源组织。乳腺上皮组织组成10~15 个节段单位,每一个节段单位由小叶-小导管-导管-集合管组成,并开口于乳头,成为“花树”状结构。乳腺小叶是乳腺实质的基本单位,由终末导管和不等量盲端终末导管(腺泡)构成,其间含疏松的纤维血管间质,称终末导管小叶单位(TDLU),是绝大多数乳腺疾病的起源。
1 、乳腺良性增生性病变
所谓“乳腺良性增生性病变”是20 世纪很长时间中,由于广泛存在于病理学界、临床和影像学领域认识上的问题,用来广义描述乳腺良性上皮增生性疾病,对这些疾病与乳腺癌发生的关系也长期存在争议。该组疾病包含大组非常异质性病变,对其基本认识在20 世纪末已达成共识。
1985 年,美国著名乳腺病理学家Dupont 和Page 等[1]复习3000 多例乳腺良性病变后,将其分为非增生性(nonproliferative)、增生不伴非典型性(proliferative without atypia hyperplasia)和增生伴有非典型性(proliferative with atypia hyperplasia)病变。研究认为,增生伴有非典型性病变具有潜在的乳腺癌发生危险性增加(5.3 倍),增生不伴非典型性病变危险性轻度增加(1.9 倍),而非增生性病变危险性不增加。该分类计划被1985 年美国病理医师学院(CAP)共识会议采纳。又经过20 多年的随访研究,1998 年美国病理医师学院癌症委员会(The Cancer Committee of The College of American Pathologists)正式公布了乳腺良性疾病癌变发生的相对危险性,是指流行病学上与正常人群相比相对危险而非绝对危险,且不包括年龄、肥胖、家族史、月经生育史等其他危险因素。并将乳腺各种组织学类型的良性疾病按照癌变发生的相对危险性分为:危险性不增加;危险性轻度增加(1.5~2.0倍);危险性中度增加(4~5 倍);危险性重度增加(8~10 倍)(表1)[2]。

此后更多研究肯定了上述发现,并拓展了关于非典型病变及其与乳腺癌危险性相关的认识。尽管目前有关这些复杂异质增生性病变的命名和分类还不完全统一[3-4],但对这些病变,尤其是高危病变相关乳腺癌发生危险性的准确评估已运用于临床,如对危险性增加疾病妇女应用先进影像学筛查技术,以及乳腺癌危险性减轻药物治疗等战略实施。
2、乳腺高危病变(high-risk lesions of breast)
乳腺高危病变是指与乳腺癌发生不同程度危险性增加相关的一组临床、病理学和生物学上的异质性疾病。目前认识主要包括两种类型不典型增生[非典型导管增生(atypical ductal hyperplasia,ADH)和非典型小叶增生(atypical lobular hyperplasia,ALH)]及两种类型原位癌[小叶原位癌(lobular carcinoma in situ,LCIS)和导管原位癌(ductal carcinoma in situ,DCIS)]。此外,新近认识到一种非典型增生类型:平坦上皮非典型性增生(flat epithelial atypia,FEA)。这些疾病之后长期持续性乳腺浸润性癌发生的危险性增加,但危险程度和水平各异,临床干预战略也不同(图1)。
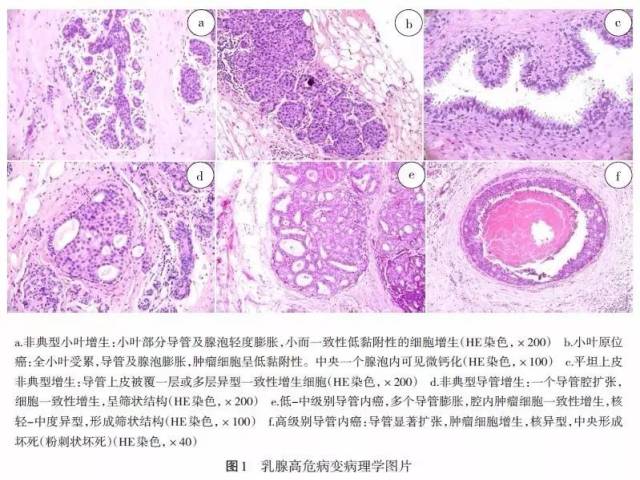
2.1 ADH 与ALH
ADH 与低级别DCIS 组织学改变相同,但异常细胞增生范围局限,显微镜下确定其受累范围<2 mm。细胞强表达雌激素受体(ER),增生活性低,分子遗传学改变与低级别DCIS 和低级别ER+浸润性癌相似,提示ADH 可能为低级别乳腺癌发展路径上的早期病变[4]。研究表明,ADH 乳腺癌发生相对危险性增加,但随访10年以上的病人中有80%并未患癌[5-6],20 年发生浸润和原位癌的累计危险性为21%。Page 等[7]研究随访17 年浸润癌发生的绝对危险性为20%。
ALH 组织学上与LCIS 相似,受累小叶腺泡腔内呈低黏附性非典型细胞增生,腺泡扭曲扩张。但小叶内受累腺泡数目≤50% ,而>50% 即为LCIS。研究表明,ALH 乳腺癌发生危险性与ADH相同,OR 值均为4,大多数ALH 病例并不发展为乳腺癌[5-8]。2014 年著名Mayo 医学中心公布可信数据:698 例不典型增生病例平均随访12.5 年,ADH和ALH 危险性差异无统计学意义,25 年乳腺癌累计发生率为29%,同侧与对侧发生为2∶1。非典型增生诊断时越年轻、多灶性病变、越多小叶受累,乳腺癌发生危险性增加[9]。因此,尽管ADH 和ALH 组织学不同,但临床生物学相同,即两者均长期持续存在双侧乳腺癌发生危险性增加。
2.2 FEA
FEA 为新近认识到的非典型增生类型,2003 年WHO 分类正式建立该类型[3]。特征为小叶导管或腺泡上皮被单层或多层与ADH 和低级别DCIS 细胞学上相似的细胞增生替代。FEA 易发生钙化,常与ADH、ALH 和低级别DCIS 病变相关联,病变细胞在组织病理学、免疫表型、分子遗传学等方面与ADH、低级别DCIS 和低级别浸润性癌,甚至ALH、LCIS 等相似,表明其为这些更进展病变的前驱病变。目前对FEA 的自然历史认识还不足,但可靠资料显示其乳腺癌发生危险低于其他非典型性病变[10]。
2.3 LCIS
1941 年由Foote 和Stewart 首先描述,认为是浸润性乳腺癌的一种前驱病变(precursor),建议其治疗施行完全乳腺切除术。之后的研究表明,其年浸润性癌发生危险性仅为1%,远低于真正的前驱病变,而且即使病变仅位于单侧,其危险性也存在于双侧乳腺,因此,认为LCIS 仅为乳腺癌发生的危险因素。有学者建议采用小叶瘤变(lobular neoplasia)或小叶上皮内瘤变(lobular intraepithelial neoplasia,LIN)来概括ALH 至LCIS 连续性谱系病变[4]。但应注意ALH 与LCIS 危险程度的不同。新近研究观察到LCIS 为克隆性病变,并与临近浸润性小叶癌基因改变相同。因此,重新认为LCIS 为前驱病变[11]。
多形性LCIS(PLCIS)为新近认识到的一种少见LCIS 变型,与经典LCIS 细胞呈低级别不同,其细胞表现为显著的核多型性,并常见坏死。该变型在遗传学上与经典LCIS 相同,包括E-cadherin表达丢失,但生物标记谱常不同。经典LCIS 常ER、孕激素受体(PR)强阳性,人表皮生长因子受体-2(HER-2)阴性,Ki-67 呈低增生率,而PLCIS常ER、PR 阴性、过表达HER-2、Ki-67 中-高度增生率[4],这些特征与高级别DCIS 相同。由于纯PLCIS 病例较少,因此目前关于其生物学行为是否与经典LCIS 不同尚缺乏认识。
LCIS 临床上常无表现,偶尔发现于其他良性病变活检中。LCIS 常为多灶性,约1/3 病人为双侧性。常见的错误概念是认为发生于LCIS 之后的癌为浸润性小叶癌,其实很多为导管癌。研究表明,4853 例LCIS 发生浸润性癌350 例,仅26%为浸润性小叶癌或小叶-导管混合癌,而其他大部分为浸润性导管癌[12]。但也可见浸润性小叶癌发生于LCIS 病史者比一般妇女多见。研究还表明,LCIS妇女乳腺癌发生危险性双侧乳腺相同,其10 年浸润性癌发生的危险性为(7.1±0.1)%。King 等[13]研究1999 年以来诊断为LCIS 的776 例女性病人,诊断后1~6 年中,年乳腺癌发生危险性为1% ~2%。总之,目前证据表明LCIS 既是乳腺癌发生危险性增加的指针,也是一非责任性前驱病变(nonobligate precusor)。
2.4 DCIS
DCIS 包含了一组组织学上、生物学标记谱、分子遗传学改变的异源性病变,目前基于核分级(低、中、高)或联合粉刺状坏死(导管中央细胞坏死)进行病理学分类。与上述小叶者一样,有学者建议采用“导管上皮内瘤变”(ductal intraepithelial neoplasia,DIN)来归纳从ADH 到高级别DCIS 谱系病变。但是由于这些疾病乳腺癌发生危险性明显不同,且采用完全不同的处理战略,因此,此术语未被广泛接受。
与ADH、ALH 和LCIS(认为在任何一侧乳腺的乳腺癌发生危险性增加)不同,DCIS 被认为是前驱病变,即在同侧最终发展为乳腺癌的风险大。仅有少数DCIS 病例触及肿块、乳头溢液和乳头Paget病等临床表现,近年来由于影像学的应用,尤其发现微钙化,DCIS 检出病例大大增加。2013 年,美国DCIS 占新诊断乳腺癌的20%~25%。由于DCIS 病变常被切除,使得对其自然进展的评估受到影响。多数研究中包含的病例常由于原始诊断为良性而免于切除,但在研究复习时诊断为DCIS 而纳入,这些病变通常更小或级别低至可能代表病变谱系中较不侵袭性的病例,而不能代表所有DCIS的生物学行为[14-15]。但即使如此,研究显示,大多数乳腺癌发生在之前诊断为DCIS 同侧的乳腺,甚至相同象限,表明其为前驱病变。还有研究筛选病灶直径0.3~2.5 cm 的低、中级别DCIS(n=565)和0.3~1.0 cm 的高级别DCIS(n=105)予以完全性切除(切缘>3 mm)的病例,平均随访6.3 年。7 年局部复发率在低~中级别和高级别病变分别为10.5%和18.0%,10 年浸润性癌发生率在低、中、高级别病变分别为3.7%、12.3%和19.2%[16]。这些结果表明,DCIS 代表乳腺癌的真正前驱病变。
基于上述对高危病变病理学和生物学方面的认识,目前临床上针对ADH、ALH、LCIS 的风险降低战略包括影像学为主的积极监督、内分泌治疗为主的化学预防,在合并其他危险因素的少数情况下甚至实施预防性乳腺切除;针对DCIS 的处理包括完全乳腺切除,保乳手术加放射治疗,或增加内分泌治疗[17]。而准确的病理学诊断评估在这些疾病的诊治战略中起到非常关键的作用,因此,在我国提高对这些病变的病理学诊断水平以及临床认识很有必要。此外,临床需要注意的是,目前大多乳腺疾病的最初诊断是基于影像学引导的粗针穿刺活检标本,由于标本本身存在一定局限,而且如上所述,ADH 与DCIS 的鉴别在病理学上为量的问题(病变≤2 mm 为ADH,>2 mm 者为DCIS),因此,粗针活检诊断ADH 时,很有必要行进一步病变切除分析。但经外科切除的标本若病变边缘存在ADH、ALH 或LCIS 时常无需扩大切除,因为切除目的是排除浸润癌存在。同时,研究也已表明,在浸润性癌切除边缘存在这些高危病变,其复发危险性并不增加。
目前,有研究者已建立针对包括乳腺非典型增生等多项危险因素的人群危险性预测模型,并已证明其有效性,如Gail 模型等[18],但基于这样的数据,临床对病人个体仍可能产生处理不足或过度处理。因此,建立个体化的危险性预测指标非常重要,遗憾的是至今为止这样的预测指标还非常有限。目前只有少数临床病理学因素获得认知,如年龄、核级别和坏死等预示短期复发可能,也有学者建立多基因分析预测DCIS 复发风险等[19]。而对高危病变分子遗传学改变的深入认识、确定可预测个体浸润性癌发生的分子标记则是未来最重要的方向之一。
参考文献:略















共0条评论