听到很多人抱怨,在免疫组化实际操作中遭遇过组织易脱片的问题,今天我将结合一些个人经验,与大家分享简单易操作的解决方法。
方法一:
使用防脱玻片,组织当然是越新越好。
方法二:
某些免疫组化染色时候,需要涉及多种抗原修复方法,如某实验需要双修复(热修复和酶修复),热修复相对来说是比较剧烈的(如放在 EDTA 中煮 1 min),沸腾的液体对组织还是有很大的冲击力的,此时组织容易脱,如果热修复放在酶修复后,则组织更容易脱,相反如果将不剧烈的酶修复放在热修复后,可以减少脱片的发生。
但很多时候知道这些似乎解决不了问题,不少研友们由于读研时间仅仅 3 年,重新收集新鲜标本显然不可能,回顾性研究中,某些病例比较罕见,活检取出组织也相对宝贵,且由于当时条件限制等多种原因造成如下问题:
空白片少,经不起反复折腾;
回顾性研究中不可能使用新鲜的切片组织;
某些单位先前并没有使用防脱载玻片保留组织标本等。
这些给实验科研造成一些困境,以下是本人改良后的方法与心得(以无防脱的非新鲜组织为例,修复方式为热修复和酶修复),脱蜡、水化及后续染色等处理均按原先各自的实验流程处理,这里仅介绍如何防脱。
如上所说,先采用酶修复,后热修复,一般热修复是直接置于相应的修复液中煮沸,期间还有可能使用高压锅。
1. 酶修复
各自抗原特性选择,有些时候酶修复的时间是极其难把握的。时间太长,消化过头容易脱片;时间太短,抗原暴露不充分,这些都影响实验结果。
建议:稀释浓度,延长时间。
缺点:不能使用说明书推荐时间,需要自己摸索几次。
2. 热修复
本人尝试如下改良(理论基础:抗原修复时仅需要组织与修复液接触,且只要薄薄的一层就能反应)。
改良一:
敞开高压锅盖,置一铁架于修复液面,其上放置玻片,玻片上滴加修复液体(铁架高度以沸腾修复液不会触及玻片为妥)。为了防止玻片上的修复液挥发,可在滴加修复液后盖上盖玻片,提供热源使修复液保持沸腾状态,使用热蒸汽加热。
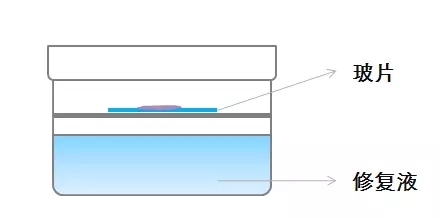
优点:避免了组织在液体中的剧烈沸腾,减少脱片。
缺点:降低了抗原修复的温度,可能导致某些抗原无法达到其修复所需温度,使用此法可能需要适当延长热修复时间。
改良二:
修复液煮沸后,滴加于载玻片上,覆盖盖玻片,用实验室常见的封口膜将玻片和盖玻片包绕(包绕的目的不是为了隔绝空气,而是防止盖玻片移动导致修复液在组织表面挥发,封口膜受热后收缩,即可固定)。将包绕好的玻片置入铁架上,按原先操作继续(可放入高压锅中)。
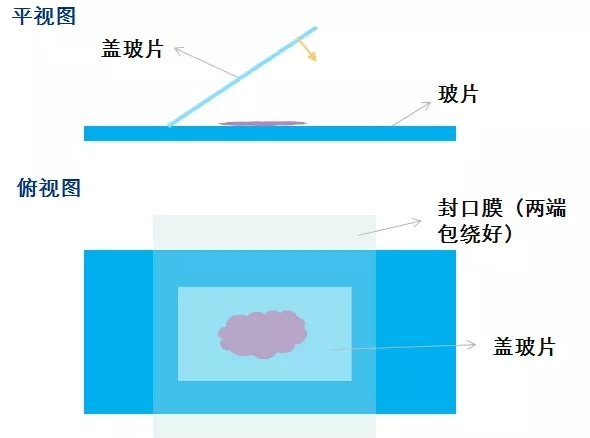
优点:避免了改良 1 中可能无法达到所需修复温度的问题,可以放入高压锅中。
缺点:所有片子变成平铺展开,一次所能做的片子数目减少。
注意事项:
使用盖玻片后,尤其是使用封口膜后,揭片的过程一定要轻柔,用镊子,避免徒手操作,如遇到揭片困难,可适当用 PBS 冲洗,不可暴力揭片,否则适得其反;
由于每个实验室条件不同,还应根据自己所在实验室条件调整;
免疫组化步骤繁琐,影响因素较多,出现问题要仔细思考。以上两个方法本人亲测可有效解决脱片问题,希望能帮助到大家。















共0条评论