临床上,经常遇到乳腺癌患者及家属询问病情的严重程度及存活多久等类似问题,实际上,这是一个非常复杂的问题,由于采用不同的标准、治疗依据及认识角度,乳腺癌有许多分类方法及预后判断标准。临床上制定治疗方案及预后判断需结合各类分类方法,做出整体评估。
经典的TNM分期
基本架构是根据肿瘤大小(简称T),淋巴结是否转移及转移数目(简称N),及是否有远处器官转移(简称M)等三者综合分析TNM以决定乳癌的分期。TNM这种肿瘤解剖病理分期对于预测肿瘤的复发转移价值不可低估,是临床上较成熟的风险评估指标。
原发肿瘤(T)分期:Tx 原发肿瘤情况不详(已被切除)。T0 原发肿瘤未扪及。Tis 原位癌(包括小叶原位癌及导管内癌),Paget病局限于乳头,乳房内未扪及块物。T1 肿瘤最大径小于2Cm。T2 肿瘤最大径2~5crn。T3 肿瘤最大径超过5cm。T4 肿瘤任何大小,直接侵犯胸壁和皮肤(包括炎性乳腺癌)。
区域淋巴结(N)分期:N0 区域淋巴结未扪及。Nx 区域淋巴结情况不详(以往已切除)。N1 同侧腋淋巴结有肿大,可以活动。N2 同侧腋淋巴结肿大,互相融合,或与其他组织粘连。N3 同侧内乳淋巴结有转移、同侧锁骨下、上淋巴结转移。
远处转移(M)分期:Mx有无远处转移不详。M0 无远处转移,M1远处转移。
第六版AJCC(the American Joint Committee on Cancer)TNM分期
T
| 原发肿瘤 |
TX | 原发肿瘤无法确定(例如已切除) |
T0 | 原发肿瘤未查出 |
Tis | 原位癌 |
Tis(DCIS) | 导管原位癌 |
Tis(LCIS) | 小叶原位癌 |
Tis(Paget) | 不伴肿瘤的乳头派杰氏病(注:伴有肿块根据肿块大小分期) |
T1 | 肿瘤最大直径≤2cm |
T1mic | 微小浸润性癌,最大直径≤0.1cm |
T1a | 肿瘤最大直径>0.1cm,≤0.5cm |
T1b | 肿瘤最大直径>0.5cm,≤1.0cm |
T1c | 肿瘤最大直径>1.0cm,≤2.0cm |
T2 | 肿瘤最大直径>2.0cm,≤5.0cm |
T3 | 肿瘤最大直径>5.0cm |
T4 | 不论肿块大小,直接侵犯胸壁或皮肤(胸壁包括肋骨、肋间肌、前锯肌,但不包括胸肌) |
T4a | 侵犯胸壁 |
T4b | 患侧乳房皮肤水肿(包括橘皮样变),溃破或卫星状结节 |
T4c | T4a和T4b并存 |
T4 | 炎性乳腺癌 |
N | 区域淋巴结 |
Nx | 区域淋巴结无法分析(例如已被切除) |
N0 | 区域淋巴结无转移 |
N1 | 同侧淋巴结转移,可活动 |
N2 | 同侧转移性淋巴结相互融合,或与其他组织固定;或临床无证据显示腋淋巴结转移的情况下,存在临床明显的内乳淋巴结转移 |
N2a | 同侧转移性淋巴结相互融合,或与其他组织固定 |
N2b | 临床无证据显示腋淋巴结转移的情况下,存在临床明显的内乳淋巴结转移 |
N3 | 同侧锁骨下淋巴结转移;或有临床证据显示腋淋巴结转移的情况下,存在临床明显的内乳淋巴结转移;或同侧锁骨上淋巴结转移,伴或不伴腋淋巴结或内乳淋巴结转移 |
N3a | 同侧锁骨下淋巴结转移及腋淋巴结转移 |
N3b | 同侧内乳淋巴结转移及腋淋巴结转移 |
N3c | 同侧锁骨上淋巴结转移(注:与五版重大变动) |
pN | 区域淋巴结 |
pNx | 区域淋巴结无法分析(手术未包括该部位或过去已切除) |
pN0 | 组织学无区域淋巴结转移,未对孤立肿瘤细胞(ITC)另行检查 |
pN0(i-) | 组织学无区域淋巴结转移,免疫组化阴性 |
pN0(i+) | 组织学无区域淋巴结转移,免疫组化阳性,肿瘤灶≤0.2mm |
pN0(mol-) | 组织学无区域淋巴结转移,分子检测(RT-PCR)阴性 |
pN0(mol+) | 组织学无区域淋巴结转移,分子检测(RT-PCR)阳性 |
PN1mi | 存在微转移灶,最大直径>0.2mm,≤2.0mm |
pN1 | 同侧1-3个腋淋巴结转移,或内乳前哨淋巴结镜下转移,而临床不明显 |
pN1a | 同侧1-3个腋淋巴结转移 |
pN1b | 内乳前哨淋巴结镜下转移,而临床不明显 |
pN1c | 同侧1-3个腋淋巴结转移,同侧内乳前哨淋巴结镜下转移,而临床不明显 |
pN2 | 4-9个腋淋巴结转移,或临床明显的内乳前哨淋巴结镜下转移而腋淋巴结无转移 |
pN2b | 临床明显的内乳前哨淋巴结转移而腋淋巴结无转移 |
pN3 | 10个或10个以上腋淋巴结转移,或锁骨下淋巴结转移,或腋淋巴结转移的情况下伴临床明显的同侧内乳淋巴结转移;或3个以上腋淋巴结转移伴有临床阴性而镜下内乳淋巴结转移;或同侧锁骨上淋巴结转移 |
pN3a | 10个或10个以上腋淋巴结转移(至少一个肿瘤灶>2.0mm),或锁骨下淋巴结转移 |
pN3b | 3个以上腋淋巴结转移伴有临床阴性而前哨淋巴结活检镜下内乳淋巴结转移 |
pN3c | 同侧锁骨上淋巴结转移 |
M | 远处转移 |
Mx | 有无远处转移无法评估 |
M0 | 无远处转移 |
M1 | 有远处转移 |
说明:
1.临床明显:指通过临床体检或影像学检查(除外淋巴核素显像)发现。
2.PN分类依据腋淋巴结清扫结果,此前可有、可无前哨淋巴结活检,如果只进行前哨淋巴结活检而其后未行腋淋巴结清扫,以(sn)表示前哨淋巴结,如pN0(i+)(sn)。
3.孤立肿瘤细胞指单个肿瘤细胞或小于0.2mm的小细胞团,通常由免疫组化或分子技术发现,并经常规组织学鉴定,孤立肿瘤细胞不一定显示转移活性,如增殖或间质反应。
4.临床不明显:指通过临床体检或影像学检查(除外淋巴核素显像)不能发现的情况。
实用的临床分期
根据不同的TNM可以组成临床不同分期,也是临床医生向患者及家属解释病情最常用的分期。

病理学分类、组织学分级
乳腺癌病理组织形态较为复杂,类型众多,而且往往在同一块癌组织中,甚至同一张切片内可有两种以上类型同时存在。每种类型乳腺癌综合治疗方法及预后不同,临床制定治疗方案亦需结合病理类型及组织学分级。目前国际、国内的乳癌病理分类,在实际应用中仍未统一。
目前国内多采用以下病理分型:
1、非浸润性癌
(1)导管内癌(癌细胞未突破导管壁基底膜);
(2)小叶原位癌(癌细胞未突破末梢乳管或腺泡基底膜);
(3)导管内乳头状癌;
(4)乳头湿疹样乳腺癌。此型属早期,预后较好;
2、早期浸润性癌
(1)早期浸润性导管癌(癌细胞突破管壁基底膜,开始向间质浸润);
(2)早期浸润性小叶癌(癌细胞突破末梢乳管或腺泡基底膜,开始向间质浸润,但仍局限于小叶内)。此型仍属早期,预后较好。(早期浸润是指癌的浸润成分小于l0%);
3、浸润性癌
(1)浸润性特殊癌:乳头状癌、髓样癌(伴大量淋巴细胞浸润)、小管癌(高分化腺癌)、腺样囊性癌、粘液腺癌、大汗腺样癌、鳞状细胞癌等。此型分化一般较高,预后尚好;
(2)浸润性非特殊癌:包括浸润性导管癌(临床上最为常见类型)、浸润性小叶癌、硬癌、髓样癌(无大量淋巴细胞浸润)、单纯癌、腺癌等。此型一般分化低,预后较上述类型差,且是乳腺癌中最常见的类型,占80%,但判断预后尚需结合疾病分期等因素;
4、其它罕见癌
组织学分级标准
肿瘤的组织学分级与患者预后的关系早已引起肿瘤学家的重视。乳腺癌的分化程度与预后有十分密切的关系,但各种分级标准的差异颇大。乳腺癌组织学分级主要从以下3个方面进行评估:
1、腺管形成的程度;
2、细胞核的多形性;
3、核分裂计数;
我国常见恶性肿瘤诊治规范的分级标准:
1、腺管形成 ①有多数明显腺管为1分; ②有中度分化腺管为2分;③细胞呈实性片块或条索状生长为3分;
2、细胞核大小、形状及染色质不规则 ①细胞核大小、形状及染色质一致为1分; ②细胞核中度不规则为2分;③细胞核明显多形性为3分;
3、染色质增多及核分裂相(×400) ①1/10HPF为1分;②2~3/10HPF为2分;③>3/10HPF为3分;
各标准的3项指标所确定的分数相加,3~5分为I级(分化好),6~7分为Ⅱ级(中等分化),8~9分为Ⅲ级(分化差)。
分子分型
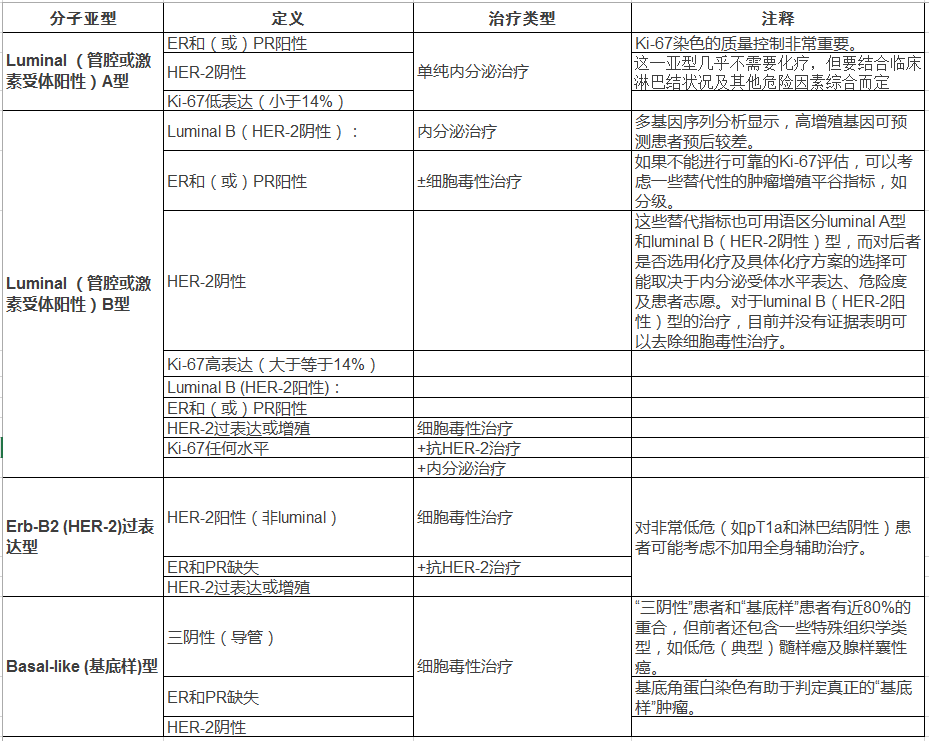
近年来,基于DNA微阵列技术和多基因RT-PCR定量检测的方法对乳腺癌进行的分子分型来预测乳腺癌的复发转移风险及其对治疗的反应,目前常将基因芯片技术的分子亚型和免疫组织化学结合起来,临床上可将乳腺癌划分为4类[55-57]:Luminal A 型 (ER+/PR+,HER-2-) 、Luminal B 型 (ER+/PR+,HER-2+)、HER-2+ 型 (ER-/PR-/HER-2+)和Basal-like型 (ER-/PR-/HER-2-)。不同分子亚型乳腺癌的临床治疗反应和生存期不同,目前越来越来引起临床重视。
传统的肿瘤解剖病理分期 (如TNM分期,包括肿瘤大小、淋巴结转移数目、远处转移情况)对于预测肿瘤的复发转移价值不可低估,是临床上较成熟的风险评估指标。但由于乳腺癌是一种异质性肿瘤,其在组织形态、免疫表型、生物学行为及治疗反应上存在着极大的差异,传统病理TNM分期相同的患者对临床治疗的反应及预后可能会有很大差别。近年来,基于DNA微阵列技术和多基因RT-PCR定量检测的方法对乳腺癌进行的分子分型来预测乳腺癌的复发转移风险及其对治疗的反应,目前常将基因芯片技术的分子亚型和免疫组织化学结合起来,临床上通常应用ER、PR、HER-2 及Ki-67可将乳腺癌划分为4类分子亚型(见附表)。 由于不同分子亚型乳腺癌的临床治疗反应和生存截然不同,研究乳腺癌分子标志及分子分型对于指导临床治疗与判断预后有重要意义。比如临床上比较棘手处理的“三阴乳腺癌”(指ER、PR及HER-2均阴性;Triple-negative breast cancer)的乳腺癌,相当于分子分型的Basal-like型分子表达(特征为基底上皮分子标志物高表达(CK5/6或17,EGFR)以及ER或ER相关基因及HER-2或HER-2相关基因低表达),约占全部乳腺癌的10%~15%,临床上往往作为一种预后差的乳腺癌类型代表。三阴乳腺癌多见于绝经前年轻患者,内脏转移、脑转移几率较高,病理组织学分级较差,多为3级,细胞增殖比例较高,且多伴p53突变,p53、EGFR表达多为阳性,基底细胞标志物CK5/6、CK17也多为阳性。
表:乳腺癌分子亚型的定义和治疗推荐(2011年St.Gallen共识)
危险度分级
根据患者年龄、肿瘤大小、激素受体状态、肿瘤细胞分级、脉管瘤栓、HER2状态、淋巴结状态,专家共识将其分为低、中、高危复发风险人群,为临床医师选择合适的治疗方案提供了依据。
危险度分级 | 主要指标 |
低危 | 淋巴结阴性且具有下列特征: pT《2cm, Ⅰ级, 没有广泛的肿瘤周围脉管浸润, ER和/或PR(+), 无HER2/neu基因扩增或蛋白过表达, 年龄》35岁 |
中危 | 淋巴结阴性且至少具有一项下列特征: pT>2cm, Ⅱ-Ⅲ级, 有广泛的肿瘤周围脉管浸润, ER和/或PR(-), HER2/neu基因扩增或蛋白过表达, 年龄<35岁 |
淋巴结阳性(1-3个)且具备以下特征: ER和/或PR(+), 无HER2/neu基因扩增或蛋白过表达 |
高危 | 淋巴结阳性(1-3个)且ER和/或PR(-), 或HER2/neu基因扩增或蛋白过表达 |
淋巴结阳性(≥4个) |















共0条评论