作者:孟宇宏,吴惠(海军总医院病理科)
目前发现的ALK阳性肿瘤已从间变性大细胞淋巴瘤扩展到弥漫性大B细胞性淋巴瘤、非小细胞肺癌、炎性肌纤维母细胞瘤、神经母细胞瘤、未分化间变性甲状腺癌及其他少见类型的癌和肉瘤。正确诊断ALK阳性肿瘤和判断ALK阳性表达的亚细胞定位对肿瘤ALK重排的类型、肿瘤的诊断与鉴别诊断、预后判断及指导ALK抑制剂的个体化靶向治疗具有重要意义。本文主要对ALK阳性肿瘤的临床病理学特点、病理发生、ALK信号转导通路及ALK靶向治疗现状进行介绍。
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)是一种受体酪氨酸激酶,Morris等首先在间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)中发现了NPM.ALK融合蛋白的异常表达之后被识别。目前发现的ALK阳性肿瘤已从ALCL扩展到炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor,IMT)、非小细胞肺癌(non—small cell lung carcinoma,NSCLC)、弥漫性大B细胞性淋巴瘤(diffuse large B cell lymphoma,DLBCL)、神经母细胞瘤、髓外浆细胞瘤及其他一些少见的癌和肉瘤。本文主要对ALK阳性肿瘤的临床病理学、病理发生及ALK靶向治疗的现状进行总结,以期提高对ALK相关肿瘤的认识。
1 ALK阳性肿瘤
1.1 ALK阳性ALCL
ALK阳性ALCL约占成人非霍奇金淋巴瘤的3%,常发生于<30岁男性;多数患者表现为淋巴结肿大伴结外累及。最常见的结外累及部位是皮肤、骨、软组织、肺和肝,骨髓累及占10%,肠道、中枢神经和纵隔累及少见。
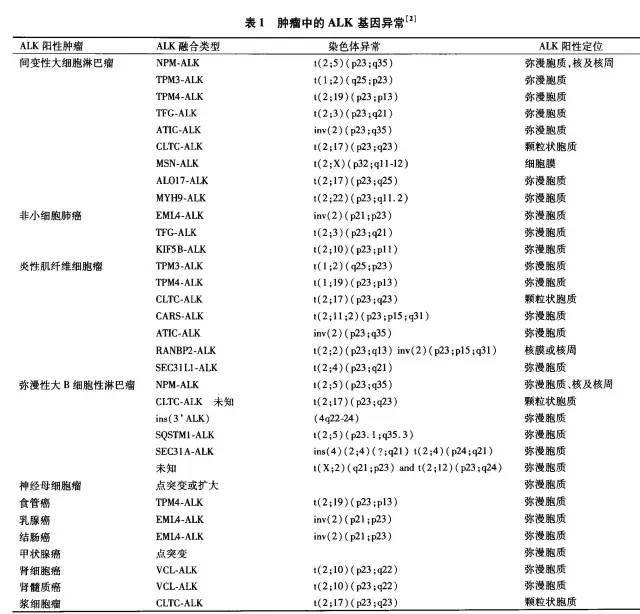
WH0(2008)淋巴瘤分类中对ALK阳性ALCL的定义是:伴有ALK基因转位和蛋白表达及CD30表达的T或NK细胞淋巴瘤,瘤细胞通常较大、胞质丰富、多形性(常为马蹄形)核。有5种形态学亚型:普通型(60%)、淋巴组织细胞型(10%)、小细胞型(5~10%)、霍奇金样型(3%)和组合型(15%)。肿瘤细胞的ALK表达形式(亚细胞定位)与ALK融合蛋白性质有关。伴t(2;5)/(NPK.ALK) 的ALK呈细胞核和胞质弥漫着色(84%);伴t(2;17)/(ALK.CTCL)的ALK呈单纯颗粒样胞质着色;伴t(2;X)/(ALK—MSN)的ALK呈细胞膜着色;其他目前已知融合方式的ALK染色呈弥漫胞质着色。目前已被识别的ALK融合伙伴基因还包括:位于5q35的NPM,位于1q25的TPM3,位于3q12的TFG,位于17q23的CLTC,位于5xqll-12的MSN,位于19p13.1的TPM4,位于22q11.2的MYH9和位于17q25的AL017(表1)。
肿瘤细胞除了表达ALK外,CD30呈特征性的细胞膜和核周(高尔基区)着色。多数肿瘤细胞EMA、CD25阳性及1至多种T细胞抗原阳性,常为CD2和CD4阳性,CD3、CD5、CD7和TCRs阴性;肿瘤细胞通常还表达细胞毒相关抗原,多数病例表达TIA- 1、穿孔素和粒酶B阳性,少数病例CD8阳性;罕见病例CDl5阳性,bcl-2阴性。一些病例丢失多个T细胞标记而表现“裸细胞”免疫表型。目前尚未发现T细胞表型和“裸细胞”表型的ALK阳性ALCL,除了免疫表型之外有其他区别。肿瘤细胞无EBV感染的证据。
ALK阳性ALCL需要与ALK阳性DLBCL鉴别。后者形态可似ALCL,也可ALK和EMA阳性;但常呈窦性生长方式,伴有免疫母/浆母细胞分化特征(CDl38、胞质Ig阳性),并且经常异常表达CD4和CD57,CD30阴性,ALK呈限制性胞质颗粒状着色。此外,肉瘤样ALK阳性ALCL还需要与IMT特别是上皮样炎性肌纤维母细胞肉瘤(epithelioid inflammatory myofibroblastic sarcoma,EMIS)鉴别。二者ALK、CD30和EMA均阳性;但ALCL缺少desmin强阳性,也无RANBP2.ALK融合型(ALK无特征性的核膜及核周着色)。
ALK阳性ALCL比ALK阴性ALCL整体预后好,二者5年生存率分别为80%和48%。小细胞形态亚型或异常表达CD56的ALK阳性ALCL预后更差。
1.2 NSCLC
因为2007年发现了NSCLC中染色体2p的一个倒位后形成的EMIA-ALK的融合基
因,从而确定了ALK在NSCLCs发病机制中的作用。特异性表达EMIA-ALK转基因小鼠模型实验更进一步证实了EML4-ALK融合基因的致癌潜能,EMIA-ALK转基因小鼠在出生几周内即发现双肺上有百个腺癌结节,这些腺癌结节对ALK抑制剂有明显的治疗反应。不同文献报告,NSCLC的EMIA-ALK融合发生率为6.7%和1.6%~13%。NSCLC中与ALK的融合伙伴除了EML4外,还有ALK-TFG和ALK-KIF5B。
EML4-ALK的融合发生率与种族无关;与年轻、无吸烟史有关;同一肿瘤ALK重排与EGFR突变并不同时存在;腺癌是存在EML4-ALK融合的主要细胞类型;实性印戒细胞型和黏液样筛状型腺癌的ALK重排率更高。此外,10%和60%的NSCLC病例可分别检测到ALK扩增和拷贝数增加;ALK扩增与EGFR扩增相关,但与预后不相关。
可用免疫组化法检测EML4-ALK重排、ALK转录上调引起的ALK蛋白高表达。有报告免疫组化和分子检测(FISH、RT—PCR)ALK重排的符合率达100%。也有报告显示,免疫组化检出的NSCLC ALK重排率相对低。D5F3是敏感性和特异性最高的抗体,能够可靠地检出所有ALK重排的病例;免疫组化可用于ALK重排的初筛,对ALK弱表达的病例还需进一步做FISH检测确定。
1.3 炎性肌纤维母细胞瘤(IMT)
IMT是一种与炎性假瘤关系密切的间叶肿瘤。炎性假瘤最初认为是炎症/反应性病变。进一步研究发现,有些病例存在克隆性细胞遗传学异常,并有复发甚至远处转移行为,提示了其肿瘤性质。目前IMT已从炎性假瘤中分离出来,成为一个具有独特临床、病理和分子学特征的肿瘤实体。WHO(2002)淋巴瘤分类中将其定义为:由分化的肌纤维母细胞性梭形细胞组成,常伴大量浆细胞和/或淋巴细胞的一种肿瘤。IMT被归为纤维母细胞/肌纤维母细胞肿瘤,中间型,少数可转移类。EMIS是近年发现的IMT上皮样亚型,是具有侵袭性生物学行为的肉瘤。文献中的IMT包括了良性、中间型和恶性,部分文献的IMT组织学可能与肌纤维母细胞肉瘤尤其是低度恶性肌纤维母细胞肉瘤相重叠。
IMTs可发生于任何年龄,儿童和青少年更常见,最常见的发生部位是肺、肠系膜、腹膜后和膀胱。大部分肿瘤包膜完整,部分呈浸润性生长。IMTs的生物学行为差别较大,大部分呈良性经过,某些具有侵袭性生物学行为,肿瘤复发率达25%。
病理形态学上,肿瘤细胞从梭形、纺锤形到上皮样圆形,背景有丰富的浆细胞、小淋巴细胞、中性粒细胞和嗜酸性粒细胞,并伴有显著的黏液样或玻璃样变性间质。
约50%的IMT病例ALK免疫染色阳性,并与ALK基因克隆性重排有关。除了NPM-ALK尚未鉴定出外,其他存在于ALCL中的融合蛋白(TPM-3、TPM4、ATIC和CLTC)在IMT中都有报告(表1)。EMIS具有特征性的RANBP2-ALK基因融合。ALK与不同的蛋白融合决定了其不同的免疫组化染色定位,如ALK与TPM3、TPM4、CARS、ATIC和SEC31L122融合,免疫组化染色显示胞质阳性;ALK与RANBP2融合则显示核膜阳性,因为RANBP2是定位于核孔的大分子蛋白。
除了ALK外,IMT的vimentin、SMA、MSA和desmin阳性:EMIS的ALK免疫组化染色呈特征性的(核膜或核周)着色,EMA、CD30、WT-1和D240也可阳性。我们遇到1例CD99和AAT也阳性。
IMT的ALK阳性与预后及复发的相关性目前尚不明确。但表达RANBP2-ALK融合蛋白(定位于核膜或核周)的阳性EMIS肿瘤细胞常呈上皮样/圆形细胞形态,并具有侵袭性生物学行为,RANBP2-ALK融合蛋白与肿瘤细胞的上皮样形态相关,并且预后差。
IMT需与以下疾病相鉴别:①ALCL:与EMIS细胞形态相似,ALK、CD30和EMA也阳性;但ALCL未见有RANBP2-ALK的融合,也无desmin强阳性。②低级别肌纤维母细胞肉瘤:与IMT相比,组织形态更趋向一致,炎细胞不明显,核分裂象更多,核不典型性更明显;肿瘤细胞SMA、desmin、calponin和fibronectin可阳性,少数病例还可CD34和CD99阳性。但重要的鉴别点是其CK和ALK阴性。③高级别平滑肌肉瘤:至少部分区域有典型的组织学特征(胞质红染的平滑肌束和“雪茄型”的核),而且ALK阴性。④腺泡状横纹肌肉瘤的实性亚型:ALK可阳性,但通常细胞形态更一致,胞质少,缺少黏液样间质及中性粒细胞浸润,肌浆蛋白(MYF4)核阳性有助于鉴别。⑤去分化脂肪肉瘤:尤其是炎性MFH样脂肪肉瘤,其中有分化好的脂肪肉瘤的形态,并且ALK阴性。⑥上皮样胃肠问质瘤CDll7、DOG1和CD34的阳性有助于鉴别,且常有c-kit基因和PDGFa的突变。⑦梭形细胞癌(肝细胞肝癌、胆管癌和胰腺癌等):通过形态学和免疫组化标记,癌细胞CKAEl/AE3、CK7、CEA、AFP、CA199等弥漫强阳性可鉴别。
手术切除是治疗IMT的主要手段,少数病例皮质甾体类和抗炎药物有效。肺外IMT复发率为25%。EMIS比传统的IMT更易复发和转移,多采取手术切除加术后放疗及化疗。Marino—Enriquez等随访8例EMIS,在切除后1~8个月局部复发,2例远处转移;5例术后3~36个月(平均12个月)死于肿瘤,2例带病生存,1例无病生存者采用了ALK抑制剂治疗。
1.4 ALK阳性弥漫性大B细胞性淋巴瘤(ALK+DLBCL)
ALK阳性DLBCL是弥漫性大B细胞性淋巴瘤的罕见亚型,特征是大间变细胞伴免疫母或浆母细胞分化,常呈窦隙状生长,临床病程凶险,起源于伴浆细胞分化的生发中心后B细胞。自1997年首次报告以来共有50多例报告。ALK阳性DLBCL可发生于任何年龄(9~70岁),中位年龄39岁;男女之比为3~5:1。临床通常表现为周围淋巴结肿大或纵隔肿块,诊断时常为进展期。
最常见的ALK重排发生于17q23上t(2:17)转位的ALK-CLTC融合,ALK免疫组化呈限制性胞质颗粒状着色,少数病例NPM—ALK融合蛋白是t(2;5)转位的结局,ALK免疫组化呈弥漫胞质、核及核周着色。SQSTMl(编码泛素结合蛋白)和SEC31A(编码ER.高尔基转运蛋白)是ALK阳性DLBCLs中新发现的ALK伙伴。
除了ALK阳性外,肿瘤细胞CDl38、EMA、轻链限制性胞质型Ig(特别是IgA)也阳性,但大多数B细胞相关标记(CDl9、CD20、CD22、CD23、CD79a)阴性。Reichard等报告32例ALK阳性DLBCL CDl38和EMA均阴性,只有3%的病例CD20阳性;常异常表达CD4(64%)和CD57(40%);还可MUM1、CD43和穿孔素阳性。ALK阳性DLBCL主要应与CD30和ALK阳性的ALCL鉴别。
ALK阳性DLBCL预后较差,进展期的中位生存期11~12个月,儿童中位生存期>156个月。因CD20阴性,对关罗华治疗不敏感。
1.5 神经母细胞瘤
Lamant等首先发现人源神经母细胞瘤细胞系的22/24表达ALK,因而提出了ALK在神经母细胞瘤发病机制中的作用。之后发现家族和散发性神经母细胞瘤存在ALK基因的多系和体细胞突变,ALK基因突变与ALK激酶活性增强及预后差相关。ALK基因扩增是神经母细胞瘤发生的另一潜在机制。Berthier等提出,ALK免疫反应增强和ALK拷贝数增加与预后差有关。
神经母细胞瘤是<1岁婴儿最常见的恶性肿瘤,肿瘤起源于交感神经一肾上腺系统的神经脊神经母细胞。多数为散发性,少数为家族性常染色体显性遗传。
神经母细胞瘤是一类异质性临床实体,有些病例可自然转归,但多数病例强力化疗后仍为进展和复发性病程。肿瘤的组织学分级与临床病程相关。在细胞遗传学上,肿瘤的MYCN扩增、1P和11q缺失、17q不平衡获得(转位)与预后差有关。
1.6 其他少见的ALK阳性肿瘤
1.6.1 食管鳞状细胞癌 在目前食管鳞状细胞癌ALK重排的报告中,TPM4-ALK是唯一被识别的融合,ALK融合率目前尚不确定。
1.6.2 乳腺癌 应用外显子阵列分析技术研究发现,2.4%的乳腺癌存在ELM4-ALK融合
。
1.6.3 结肠癌 应用外显子阵列分析技术研究发现2.5%的结肠癌存在EML4-ALK重排。
1.6.4 甲状腺癌 最近研究显示,间变性甲状腺癌的ALK基因外显子23中存在2个点突变,均位于ALK酪氨酸激酶域,并与其功能增强有关。间变性甲状腺癌的ALK突变率为11%。尚未见甲状腺癌ALK重排的报告。
1.6.5 肾细胞癌 有2例儿童肾细胞癌存在ALK重排的报告,其中1例为VCL-ALK融合蛋白。具有镰状细胞特性的肾髓质癌也存在相同的ALK重排。
1.6.6 肉瘤 除IMT之外,其他一些软组织肿瘤也存在ALK表达。包括横纹肌肉瘤、各种脂肪源性肿瘤、Ewing/PNETs和平滑肌肉瘤。这些病例中的ALK过表达与基因扩增或拷贝数增加有关,与ALK的融合状态无关。
1.6.7 髓外浆细胞瘤 有1例髓外浆细胞瘤CLTC—ALK阳性的报告,此结果与NPM.ALK转基因小鼠发展为浆细胞瘤的研究结果一致。
2 ALK简介
2.1 ALK的生理功能
ALK是胰岛素受体超家族的一种受体酪氨酸激酶,ALK基因位于人类染色体2p23,主要在中枢神经系统发育过程中发挥作用。ALK的病理生理功能具有“配体依赖性”,即无配体结合时促进细胞凋亡,有配体结合(或存在ALK融合蛋白)时则抑制细胞凋亡。
2.2 ALK作为一种癌基因
ALK是以一种与ALCL相关的基因融合产物被最早发现的,之后发现80%~85%ALK阳性的ALCL存在t(2;5)(p23;q35)转位,形成了由2p23的ALK胞质区与5q3的核磷酸蛋白(NPM)N端区组成的NPM-ALK融合蛋白。除了NPM外,还发现了大量与ALK融合的功能性伴侣蛋白(表1),包括位于17号染色体的AL017、TGF、TPM3和TPM4、MYH9、CLTC。所有这些融合蛋白都与染色体重排(易位、倒位)有关,它们有相同的ALK断点,但其下游信号的差异是由不同伴侣蛋白的亚细胞定位和结构差异所致。NPM的一个N端二聚体结构域对依次启动磷酸化(激活)、下游信号磷酸化(激活)、致癌潜能发挥重要作用。NPM的独特性是在二聚体偶联后,NPM-ALK蛋白在细胞质和细胞核中同时累积,即此类伴t(2;5)(p23;q35)肿瘤的ALK表达定位在细胞核与细胞质,而大多数其他亚型则只定位在细胞质。
除了基因重排可使ALK激活外,基因扩增/拷贝数增加及激酶域点突变也均可使ALK激酶活性异常增强。ALK基因扩增/拷贝数增加是神经母细胞瘤和NSCLC肿瘤发生的另一机制。神经母细胞瘤和间变性甲状腺癌有ALK激酶域的点突变。体内和体外实验研究均表明,ALK融合有致癌潜能,但最近有报告外观健康个体的外周血细胞存在高发生率的ALK融合蛋白(NPM—ALK和ATIC—ALK),提示ALK融合不足以引起细胞转化。异常ALK激活是p16、p53、Rb引起的细胞周期阻滞和衰老的下游事件,这些肿瘤抑制基因失活才是细胞转化的必要分子事件。
2.3 ALK介导肿瘤的信号事件
ALK可激活多个与细胞增殖和存活、细胞骨架重排和细胞迁移等功能相关的信号通路,包括Ras/ERK、JAK/STAT、P13K/Akt和PLCγ/通路。JAK/STAT通路介导NPM-ALK附致癌信号;其中STAT3是最重要的信号分子,它可由ALK直接激活,也可通过其他通路激活JAK3而激活。STAT5的信号作用与STAT3相反,它在NPM-ALK诱导的ALCL细胞中是以一个肿瘤抑制基因出现的。SHP-1是JA3/STAT3信号通路的另一负调节器。
3 ALK的靶向治疗进展
靶向治疗给肿瘤患者带来新希望。选择性激酶抑制剂是最重要的抗癌制剂之一,并已在临床中应用。ALK成为肿瘤治疗靶点首先是由于正常成人表达ALK的组织有限,其次是因为ALK驱动的癌症种类不断增多。通过RNA干扰对靶向ALK的研究(通过单克隆抗体和抑制热休克蛋白90干扰ALK蛋白的稳定性)显示,小分子抑制剂是阻止ALK激活的最好方法。克唑替尼(Crizotinib)是第一个进入临床试验的ALK抑制剂,它是小分子受体酪氨酸激酶c-MET的抑制剂,对ALK激酶域有强力抑制作用。82例EMIA-ALK阳性的NSCLC的临床试验结果显示,在平均治疗6个月时的克唑替尼反应率达57%,而传统化疗的反应率只有10%。此外,IMT对克唑替尼的治疗反应也很好。ALK抑制剂对ALK驱动的ALCL、DLBCL和神经母细胞瘤的体外实验也取得显著疗效,目前已用于临床试验。与其他酪氨酸激酶抑制剂(伊马替尼和EGFR抑制剂)一样,尽管初期治疗反应令人激动,但长期治疗会引起ALK激酶域的耐药点突变,对耐药患者可从第二代ALK酪氨酸激酶抑制剂或HSP90受体阻滞剂中选择获益药物。虽然ALK的生理作用尚不十分明确,但患者已从靶向ALK的治疗中获得疗效,期待更多的ALK靶向制剂在不远的将来应用于临床。
参考文献:略














共0条评论