[导读] 2017年,Li X等在《Arch Pathol Lab Med》发表综述性文章:New Developments in Breast Cancer and Their Impact on Daily Practice in Pathology,该文章对乳腺癌的最新研究进展及其对日常病理工作的影响进行了归纳总结,现将该文章编译如下,不当之处恳请批评指正希望对大家有所帮助,同时对原文作者致以诚挚谢意
▌编译:山东省诸城市妇幼保健院病理科 王巍伟
乳腺癌是女性最常见的恶性肿瘤之一。据估计,约15%的女性在其一生中将会发生乳腺癌。过去数年中,人们对乳腺癌的认识以及乳腺癌的分类发生了重要变化,其中的一些已经被美国临床肿瘤学会(ASCO)采用并加入到最新指南中。这些新的进展在乳腺癌的诊断及治疗方面具有深刻意义,并且将很快就会应用到我们的日常工作中。
2017年,Li X等在《Arch Pathol Lab Med》发表综述性文章:New Developments in Breast Cancer and Their Impact on Daily Practice in Pathology,该文章对乳腺癌的最新研究进展及其对日常病理工作的影响进行了归纳总结,现将该文章编译如下,不当之处恳请批评指正,希望对大家有所帮助,同时对原文作者致以诚挚谢意:
四、HER2/neu评估方法更新
HER2/neu以及ER、PR表达状况的评估对于乳腺癌的预后以及治疗分层至关重要。ASCO/美国病理医师协会(CAP)指南指出,应该常规检测每一例新发、复发、浸润及转移性乳腺癌中HER2/neu、ER和PR的表达状况。由于发现HER2/neu检测的错误率高达20%以上,故2013年最新修订的指南改进了其检测的敏感性和准确性。HER2/neu表达的错误判读能够导致高昂的医疗费用,另一方面也会对患者造成相关风险下不必要的治疗,或使患者错过潜在治愈的时机。新指南更加注重敏感性(而非特异性),特别是帕妥珠单抗治疗后;FDA批准了帕妥珠单抗可以用于HER2/neu阳性乳腺癌患者的新辅助治疗,并且是HER2/neu阳性转移性乳腺癌患者的最佳治疗方案。
2013版HER2/neu免疫组化(IHC)评分标准总结如下:
0:浸润性肿瘤细胞不着色,或细胞膜不完全着色(微弱/勉强可见)的浸润性肿瘤细胞≤10%;评分0表示HER2/neu呈阴性。
1+:细胞膜不完全着色(微弱/勉强可见)的浸润性肿瘤细胞>10%,评分1+表示HER2/neu呈阴性。
2+:外周细胞膜不完全着色且呈弱/中等阳性的浸润性肿瘤细胞>10%;或外周细胞膜完全着色且呈强阳性的浸润性肿瘤细胞≤10%;评分2+提示为可疑阳性,需要进行反馈性HER2/neu基因扩增原位杂交检测。
3+:外周细胞膜完全着色且呈强阳性的浸润性肿瘤细胞>10%,评分3+表示HER2/neu呈阳性。
这一评分标准中有非常重要的三点需要强调:
(1)评分判读为3+,要求外周细胞膜完全着色且非常深(图1,A)。在日常会诊工作中,我们见过一些病例呈强阳性但是为颗粒状细胞质着色,其最初被过判读为3+,结果通过荧光原位杂交(FISH)分析却证实为阴性。同样的原因,一些自动分析系统也往往将一些评分为2+病例过判读为3+(图1,B),这就会陷入不必要的治疗困境。
(2)据了解,同时使用“外周”和“不完全”这两个术语来界定2+评分会令人产生迷惑,这就导致大量病例会进行反馈性FISH检测。FISH检测将会增加检测费用并且引发许多实验室的财力问题。因此,2013年指南对其进行了更新。HER2/neu免疫组化评分判读为2+的定义为“细胞膜完全着色且呈弱-中等阳性的浸润性肿瘤细胞>10%”。
(3)2013年的指南指出,如果原发性乳腺癌粗针穿刺活检组织最初HER2检测结果为阴性,那么就必须在切除样本中再次进行HER2检测。然而,由于粗针穿刺活检样本与切除样本之间具有较高的一致性(98%-99%)以及“三阴”乳腺癌的发病率较低,指南将其修改如下:如果原发性乳腺癌粗针穿刺活检组织最初的HER2检测呈阴性,那么就可能要求在切除样本中再次进行HER2检测。这些修改预计不久将出版。
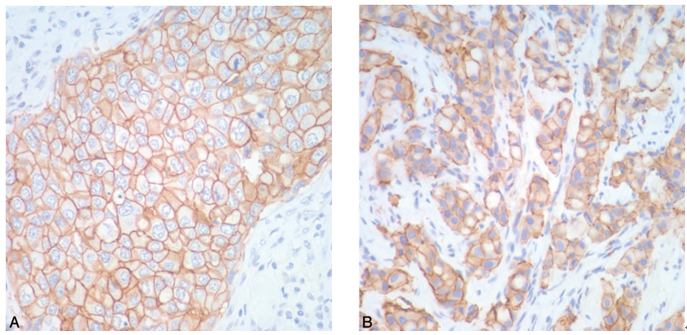
图1 HER2/neu免疫组织化学染色。(A)HER2/neu评分为3+,细胞膜呈清晰、强阳性、完全性着色;(B)图像分析系统将HER2/neu着色过判读为3+,但HER2/neu基因扩增FISH分析结果为阴性。
由于HER2/neu基因FISH检测采用双色系统,那么HER2/neu基因扩增呈阳性的标准如下:HER2/neu/CEP17比值≥2.0,或平均每个细胞至少含有6个HER2/neu基因拷贝;HER2/neu基因扩增呈阴性的标准如下:HER2/neu/CEP17比值<2.0,或平均每个细胞含有HER2/neu基因拷贝数<4.0。所有其他结果均认为HER2/neu基因扩增可疑。
按照2013年的指南,一些检测中心报告的HER2/neu整体阳性率(~0-2%)以及HER2/neu基因扩增可疑病例(~4%-5%)均有所增加。HER2/neu基因扩增可疑病例的增加延迟了HER2/neu状态的明确诊断。绝大多数这样的病例会出现CEP17拷贝数的增加(3-4/细胞核)。先前的研究显示,HER2/neu基因拷贝数增加的肿瘤对于抗HER2/neu治疗有反应,而不在于HER2/neu/CEP17比值的大小,甚或HER2/neu拷贝数在可疑范围之内。按照2013年标准而确定的可疑组患者可能更加多,但她们可以受益于抗HER2/neu治疗。这是根据2013年标准排除了HER2/neu可疑阳性转变为阳性这种情况。然而,HER2/neu可疑阳性的临床意义尚不确定。Long等报道,对于乳腺癌免疫组化HER2/neu评分为2+以及FISH检测结果可疑的病例使用17号染色体探针、甚至聚合酶链式反应(PCR)再次检测的需求在不断增加。再次检测将增加医疗费用,而临床受益与否并不确定。病理医师在报告乳腺癌HER2/neu状态时应该使用这一更新指南,直到进一步的研究阐明了HER2/neu可疑病例对治疗反应到底如何。
五、组织病理学诊断治疗新标志:肿瘤-浸润性淋巴细胞
越来越多的证据显示,肿瘤浸润性淋巴细胞(TIL)在乳腺癌中是非常重要的免疫标记,就如诸多其他癌症一样。免疫系统一直在行使着免疫监视功能。免疫反应可以控制新生肿瘤并且影响患者预后。所涉及的具体机制仍在讨论之中。化疗和放疗可以触发免疫记忆,并且有助于控制残存肿瘤。TIL所起的作用以及重要性在不同的乳腺癌亚型之间明显不同。例如,TIL在TNBC中是一种呈阳性表达的预后生物学标记,而在管腔型乳腺癌中并不表达。高水平的TIL与HER2/neu呈阳性且经化疗及HER2/neu靶向治疗的乳腺癌患者较好的预后相关。Mao等研究发现,治疗前活检样本中含有较多数量TIL的HER2/neu阳性乳腺癌和TNBC具有较好的病理性完全缓解,而ER阳性乳腺癌并非如此。虽然任一病例中所存在的TIL的特定含义仍在研究之中,但较为明确的是对TIL的数量及组成成分的分析有可能成为病理学评估中不可或缺的一部分。为了达到这一目标,实际上已有一个国际工作小组提出了日常临床和科研工作中对乳腺癌TIL的标准化评估指南。
关于TIL评估所达成的共识指南中的一些重点简述如下:
间质TIL是指间质组织中的免疫细胞,不包括肿瘤细胞。肿瘤内TIL是指位于肿瘤内的免疫细胞,其与恶性肿瘤细胞直接接触。三级淋巴结构位于肿瘤周围区域,是指B细胞淋巴滤泡(通常含有生发中心)并且旁边含有T细胞区域。这些很难与淋巴细胞聚集进行区分,并且不推荐用于临床评估。
与肿瘤内TIL评估相比,间质TIL评估似乎更简单、更有优势、且可重复性更好。研究发现,间质TIL可以预测患者对辅助性以及新辅助性治疗反应的增加。TIL评分中,计数所有单核细胞(包括淋巴细胞和浆细胞),但不包括多形核白细胞。我们应该评估肿瘤区域TIL的平均值,而非局限于某些热点区域。淋巴细胞为主型乳腺癌是指至少50%-60%的乳腺癌间质内可见TIL。
结肠癌中对TIL的评估已经列入到CAP癌症协议清单的可选项目中。在TIL评估被列入乳腺癌协议清单之前,这也仅仅只是时间问题。
六、病理医师在新辅助治疗评估中的作用
新辅助系统性治疗(即:手术前予以化疗)是目前绝大部分乳腺癌患者(包括局部晚期乳腺癌和炎症性乳腺癌)广泛采用的治疗方法,并且在早期乳腺癌患者中的运用也在不断增加。病理性完全性缓解(Pathologic complete response,pCR)是指乳腺以及同时手术切除的淋巴结中无残存的浸润性癌成分,这是一个非常好的预后指标。因此,FDA批准pCR可以作为临床试验和药物试用的一个替代指标。在HER2/neu阳性乳腺癌及TNBC中发现,pCR与临床结果之间具有最强的相关性。Houssami等报道,pCR发生于约9% HR+/HER2/neu-、19% HR+/HER2/neu+、39%HR-/HER2/neu+乳腺癌以及31%TNBC中。如果不能进行pCR评估,那么乳腺以及淋巴结中残存的癌性成分与局部复发率的增加和生存率的下降密切相关。因此,对pCR或残存癌性成分的准确评估非常关键。
为了确定肿瘤对新辅助治疗反应的标准评估方法,由乳腺癌国际研究小组-北美乳腺癌小组领导成立的多学科国际工作小组对残存癌性成分的病理学评估提出了一些建议。虽然这些建议是用于临床试验而非日常工作,但其逐渐成为三级医疗机构日常工作中的一部分。我们建议读者参阅期刊原作中的详细建议内容。
我们科室所遵从、且对病理医师来讲非常重要的一些要素总结如下:
(1)根据治疗前临床和影像学发现对样本进行评估。
(2)进行系统性取材,需要包括纤维性肿瘤床的最大横切面;最大横切面最多取5个蜡块,整个肿瘤床最多取25个蜡块;强烈推荐对样本以及所取区域进行绘图标示。
(3)残余肿瘤组织可以表现为“散在”模式,即:在一个大的肿瘤床内存在多个肿瘤病灶,推荐记录残存浸润性癌所累及的肿瘤床最大横切面的二维尺寸以及残存肿瘤细胞平均密度(图2,A方法)。第七版美国癌症联合委员会(AJCC)分期系统认为这种多灶性病变应该测量其最大肿瘤病灶(图2,B方法),与其相比,我们所推荐使用的方法可能是更好的治疗反应指标。
(4)记录淋巴结最大转移灶大小;伴有治疗反应的淋巴结中,仅无残存癌性成分的淋巴结才视为阴性。
(5)记录残存肿瘤的淋巴管血管浸润,并且不能归为pCR。
(6)不需要对ER、PR以及HER2/neu 进行重复检测,但重复检测可能会有所帮助。
乳腺癌残存癌性成分评估的具体方法详见MD安德森癌症中心网站。

图2 患者新辅助治疗后残存的多发性散在浸润性肿瘤灶大小的测量方法图(基于乳腺癌国际研究小组-北美乳腺癌小组领导成立的多学科国际工作小组的建议)。(A)推荐测量所有散在残存的浸润性肿瘤病灶所累及肿瘤床最大横切面的二维尺寸;(B)残余浸润性癌中单一、最大、且相连的肿瘤病灶大小,这种测量方法低估了残余肿瘤,但为当前第七版美国癌症联合委员会(AJCC)分期系统所推荐;(C)纤维化区域最大长度,不要将其与A中残余肿瘤床的长度相混淆。
七、技术进步对病理学的影响:放射性粒子定位(RSL)
随着乳腺钼靶摄影筛查的开展以及影像技术的改进,乳腺中不可触及病变的早期发现也就成为可能,当前约1/3影像学可疑乳腺病变无任何临床表现。如果对不可触及乳腺病变患者施行保乳手术,那么必须进行影像学引导定位。
不可触及乳腺肿物手术切除术最常使用的方法为导线引导定位(WGL)。这种方法存在很多内在问题。不均一样本中导线进入部位可能会导致出现非对称性手术切缘,这将可能导致切缘假阳性而需要进行不必要的再次切除。其他一些缺点还包括导线离断或移位、金属碎片残留、以及由乳腺组织减压后出现“手风琴”效应所致的定位失败,这些情况均可能导致乳腺组织的扩大切除,甚至是目标病变切除失败。此外,影像医师、手术室工作人员以及当天参加手术的外科医师之间需要密切配合,因为WGL是一种后勤保障性挑战。
为了克服上述一些困难,无线电引导定位技术得以发展。目前,有两种主要技术,即无线电引导隐匿性病变定位和放射性粒子定位(RSL)。无线电引导隐匿性病变定位使用标记有放射性锝(99mTc)的胶状人血清白蛋白粒子,在乳腺钼靶摄影或超声检查过程中将其直接注入病变部位。最近引进了放射性粒子定位(RSL)技术,试点研究发现,这是一种安全的定位方法,病理学证实100%可以将病变切除。现在,许多机构正在使用RSL。
患者舒适度的增加是RSL诸多优点中的一个方面。在引起同等焦虑的情况下,与WGL相比,患者认为RSL疼痛减轻。RSL使患者免除了在不同科室之间的搬运,由于导线伸出于皮肤之外,在移动过程中会发生移出、断裂或产生疼痛。RSL能够提前完成、极大的简化手术室计划表、改善周转时间、并且尽量减少患者的不便。RSL也可以为外科医师提供连续、实时的声学定位,这样可以形成围绕放射性粒子、更加均匀的样本。放射性粒子(碘125)半衰期较长,在新辅助化疗之前可以进行RSL操作。据报道,这种操作的花费与WGL相当,特别是当大量患者采用这种方法时。
RSL操作中,放射性粒子是在标准化乳腺超声或钼靶摄影检查过程中通过18号针注入。在使用不同放射性物质进行RSL操作过程中,可以了解前哨淋巴结信息并将其剥离。伽玛射线探测器能够证实样本中粒子的存在,样本钼靶摄影也可以进一步证实。伽玛射线探测器同样也可以帮助病理医师在手术检查过程中回收放射性粒子。在我们科室,样本送至病理冰冻切片室,在那里进行大体检查以及手术切缘的墨水标记工作。探测器有助于确定最大活性区域。回收放射性粒子并将其至于专用容器,然后将其返还给放射科工作人员。所有这些步骤都需要在电子图表中进行仔细记录。处理样本时应格外小心,因为切到放射性粒子后可以造成放射性碘空气播散的理论风险。然而,这种可能性非常小,因为碘125是以共价键形式结合于卤化银导线或位于包被有钛壳的离子交换树脂中。
进行这些操作需要执业许可,这是非常严格的。RSL授权程序要求对涉及放射性粒子操作的所有人员进行常规以及突发事件处理培训。放射医师负责放射性粒子的接收、储存以及注射工作,外科医师负责手术切除,病理医师负责放射性粒子回收,然后将其返还放射科;根据每一机构所达成的协议,且应仔细记录衰减的放射性粒子。如果没有按此规定进行,可能会导致RSL操作的暂时停业,直到相关协议纠正到位。
乳腺癌最新研究进展及其对日常病理工作的影响(一)
参考文献:
Li X, Oprea-Ilies GM, Krishnamurti U. New Developments in Breast Cancer and Their Impact on Daily Practice in Pathology [J]. Arch Pathol Lab Med, 2017,141(4): 490-498.
点击下载英文版文献















共0条评论