摘要:
脑胶质瘤是颅内最常见的原发性恶性肿瘤,具有多克隆起源、高度异质性及放化疗耐药等特性,导致患者预后极差。经典组织病理学分型往往忽视恶性肿瘤的高度异质性,难以满足肿瘤精准医疗的要求。因此,建立以经典组织病理学为基础、肿瘤标志物检测为核心的分子病理体系迫在眉睫。本文介绍了高通量技术的发展及分子生物学技术的进步,以及多维组学的脑胶质瘤分子分型及标志物的研究进展,和分子病理指导下的胶质瘤个体化治疗。
脑胶质瘤是组织学和基因上高度异质性的肿瘤。世界卫生组织(WHO)根据肿瘤细胞的密度、瘤细胞的多形性或非典型性(包括低分化和未分化成分)、瘤细胞核的高度异形性或非典型性(出现多核和巨核)、核分裂活性、血管内皮细胞增生(肾小球样血管增生)、坏死、增殖指数7项指标,将胶质瘤分为4级,也是目前临床病理诊断的标准。
根据中国胶质瘤协作组(Chinese Glioma Cooperation Group,CGCG)的统计资料,WHOII级胶质瘤中位生存期约为78.1月,WHOIII级胶质瘤(间变胶质瘤)中位生存期约为37.6月,而WHO IV级胶质瘤(胶质母细胞瘤)中位生存期仅为14.4月[1]。
但是,经典的组织病理学主观性较强,不能客观、系统、准确反映肿瘤组织的基因学背景和生物学特征。同时,经典组织病理学难以有效地指导胶质瘤患者的治疗及临床预后,部分低级别肿瘤表现出高级别肿瘤的恶性临床转归,部分高级别肿瘤却能够获得长期生存。随着人类基因组计划的完成及高通量技术的发展,肿瘤形态学结合基因特征的分子病理、分子分型基础上的胶质瘤个体化治疗等概念,已逐渐被神经外科学者们认同并应用。
1、基于高通量筛选的胶质瘤分子分型体系
2006年,美国癌症基因组图谱计划(The Cancer Genome Atlas,TCGA)以胶质瘤中恶性程度最高、预后最差的胶质母细胞瘤作为研究突破口,进行多平台高通量基因组学分析,取得了一系列重要突破。2008年,TCGA研究团队通过对206例胶质母细胞瘤进行DNA拷贝数、基因表达和DNA甲基化分析证实,胶质母细胞瘤基因组DNA最常见的改变集中于3条信号通路:视网膜母细胞瘤蛋白肿瘤抑制因子通路、TP53肿瘤抑制因子通路及受体酪氨酸激酶和磷脂酰肌醇3-激酶信号通路[2]。这一发现首次揭示了胶质母细胞瘤背后的基因学特征,为脑胶质瘤的发病机制和靶向治疗提供了坚实的基础。
2010年,TCGA研究团队进一步根据转录组表达数据将胶质母细胞瘤分为经典型(classical)、神经元型(neural)、间质型(mesenchymal)和前神经元型(proneural)4个亚型[3]。同时,结合表达谱数据、基因组突变和拷贝数变异数据证明,表皮生长因子受体(epidermal growth factor receptor,EGFR)、神经纤维瘤病I型蛋白(neurofibromin 1,NF1)、血小板源性生长因子受体A(platelet-derived growth factor receptor alpha, PDGFRA)/异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)能够分别作为经典型、间质型和前神经元型的标志物。前神经元型胶质母细胞瘤患者较为年轻,主要表现为PDGFRA的扩增和IDH1的突变。
此亚型胶质瘤患者的预后较其余3型好,这与此型肿瘤中较高的IDH1突变率有关。间质型胶质母细胞瘤过度表达间质型标志物,与染色体抑癌基因NF1的缺失和沉默及同源性磷酸酶-张力蛋白(phospha- tase and tensin homolog,PTEN)基因点突变有关。
此亚型中Akt信号通路异常激活,MET(肝细胞生长因子受体hepato- cyte growth factor receptor)、肿瘤坏死因子超家族和NF-κB信号通路高表达,与此型胶质瘤临床出现较高的坏死率和肿瘤侵袭性有关。
同年,TCGA研究团队通过对272例胶质母细胞瘤DNA启动子区甲基化状态进行分析,在表观遗传水平将胶质瘤分为两大类,胶质瘤CpG岛甲基化表型(Glioma-CpG island methylator phenotype,G- CIMP)和非G-CIMP型[4]。
G-CIMP型多见于复发性胶质瘤和低级别胶质瘤,此型患者更为年轻,临床预后相对较好,肿瘤中拷贝数变异(如EGFR扩增)较少,甲基鸟嘌呤甲基转移酶(O6-methylguanine-DNA methyl- transferase,MGMT)基因的DNA甲基化是此亚型治疗反应的生物标记物。多数G-CIMP型胶质瘤患者存在IDH突变。IDH野生型或非G-CIMP的胶质母细胞瘤,恶性程度较高,预后较差。
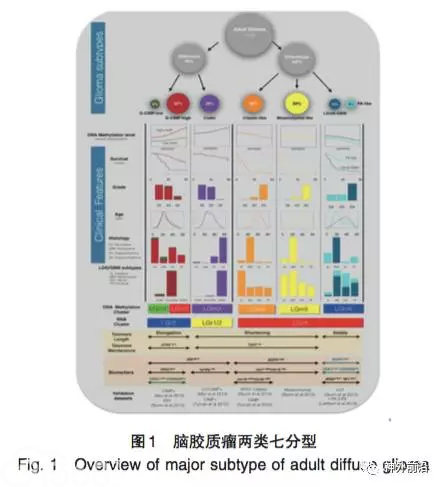
2016年,TCGA研究团队再次发表文章,对所收集的1122例WHOII级到WHO IV级胶质瘤多维组学数据进行分析,将胶质瘤分成IDH突变和IDH野生两种类型[5]。其中,IDH突变型可进一步分成G-CIMP低(G-CIMP-low)、G-CIMP高(G-CIMP-high)和联合缺失型(codel),IDH野生型可细分为类经典型(classic-like)、类间质型(mesenchymal-like)、LGm6型(LGm6-GBM)和类毛细胞性星形细胞瘤(PA-like)。这两类七分型胶质瘤在生存、级别、年龄、组织学类型等临床特征上具有显著差异,在DNA甲基化、RNA亚型、端粒长度及维持机制、生物学标志物等方面亦存在明显不同(图1[5)]。
基于中国人群全基因组表达谱水平的脑胶质瘤分子分型结果发表于2012年。通过对中国人脑胶质瘤基因组学数据库(Chinese Glioma Genome Atlas,CGGA)中225例样本的全基因组表达谱芯片数据分析发现,中国人群中脑胶质瘤可以分为3个分子亚型:G1型、G2型和G3型[6]。
在G1亚型中,患者年轻、预后好,并且IDH1突变的频率极高。相对于G1亚型,G3亚型患者年龄大、预后差、IDH1突变率低。G2亚型中患者年龄分布、预后以及IDH1突变率介于G1和G3亚型之间。与G1和G3亚型相比,G2亚型1p/19q杂合性缺失频率很高。此分型能够更清楚准确地反映中国人群胶质瘤临床和遗传变异特征,更加客观合理地指导患者的个体化诊疗。
2014年,CGCG研究团队首次提出了基于分子共表达网络的神经胶质瘤分型系统[7]。研究团队发现,利用在神经发生过程和胶质瘤中发挥重要作用的2个酪氨酸激酶受体分子EGFR与PDGFRA,构建的胶质瘤中EGFR和PDGFRA共表达分子网络(EM和PM),可将胶质瘤样本分为3大类群(EM、PM、EMlowPMlow)。PM型和PMlow EMlow型预后较好,而EM型胶质瘤患者预后较差。该分型模型可在CGGA数据库、Rem- brandt数据库、GSE16011数据库中得到重复。该系统的建立对于目前普遍采用的基于形态学的胶质瘤临床诊断提供了重要的补充和修正,并将为后续特异性治疗靶点的筛选奠定基础。
2、分子病理指导下的胶质瘤个体化治疗
近年来,胶质瘤分子病理取得了重大进展。2016年WHO已将分子病理纳入胶质瘤病理诊断体系。基于肿瘤遗传学水平的分子病理能够更准确地判断胶质瘤患者临床预后,并且对组织学难以明确诊断和分级的肿瘤提供鉴别依据。此外,这些新近发现的分子变异有可能成为未来治疗的新靶点(表1)。
2.1 IDH突变
异柠檬酸脱氢酶家族包括IDH1、IDH2和IDH3这3种异构酶。超过90%的IDH基因突变为IDH1(R132)突变,其余的为IDH2突变(R172)。研究表明,IDH突变是胶质瘤的早期遗传学改变,随后根据星形细胞或少突胶质细胞的谱系分化不同可以分别伴随其他基因变异。IDH突变在原发性胶质母细胞瘤中发生率很低(5%),但是在继发性胶质母细胞瘤和WHOII-III级胶质瘤中发生率很高[1]。伴有IDH突变的胶质瘤患者预后较好。针对IDH突变的免疫组化(R132H,克隆号:H09)已经成为胶质瘤分子诊断的常规检测[8]。
2.2 X连锁地中海贫血/智力低下综合征基因
X连锁地中海贫血/智力低下综合征基因(alpha thalasse-mia/mental retardation syndrome X-linked,ATRX)突变或缺失是星形细胞胶质瘤的诊断性分子标记物。该基因的突变或缺失会导致基因组不稳定。研究表明,ATRX突变的星形细胞胶质瘤患者预后较好[1]。ATRX突变联合IDH突变及1p/19q状态,有助于高级别胶质瘤的预后评估[9]。目前,ATRX(推荐LotNo:E97092,多克隆)是常用的临床免疫组化检测抗体,对星形细胞瘤的诊断具有重要意义。
2.3 1号染色体短臂和19号染色体长臂(1p/19q)缺失
染色体1p/19q联合性缺失是少突胶质细胞瘤的诊断性分子标记物[8]。在少突胶质细胞瘤中的发生率为80%~90%,在间变性少突胶质细胞瘤中发生率为50%~80%,在弥漫性星形细胞瘤中发生率为15%,而在胶质母细胞瘤中发生率仅为5%[10]。1p/19q联合缺失的胶质瘤患者总生存期和无进展生存期较长。
2.4 MGMT启动子甲基化
MGMT启动子甲基化可以导致基因沉默,并抑制MGMT蛋白合成。MGMT可作为高级别胶质瘤治疗反应性的指标。具有MGMT启动子甲基化的胶质瘤患者对化疗、放疗敏感,生存期较长[10]。目前,临床推荐使用MGMT免疫组化结合MGMT启动子区甲基化检的检测方法,结果更为可靠[9]。
2.5 其他分子指标
端粒酶逆转录酶启动子区(telomerase reverse transcrip-tase,TERT)突变,常见位点为C228T和C250T,主要集中于原发性胶质母细胞瘤和少突胶质细胞瘤,联合IDH、1p/19q等其他分子病理标志物可用于胶质瘤分子分型及预后的判断[9]。EGFR扩增和突变,其中胶质母细胞瘤中EGFR的扩增约为50~60%,EGFR点突变约占25%。最常见的EGFR突变为外显子2-7框内缺失,称为EGFRvIII,见于25%的原发性胶质母细胞瘤。携带EGFRvIII突变的患者预后较差。EGFRvIII特异表达于肿瘤组织,可作为临床治疗的靶点[9]。Ki-67在多种恶性胶质瘤中异常表达,与肿瘤的过度增殖和恶性程度密切相关。研究表明,Ki-67免疫组化表达水平是判断胶质瘤预后的重要参考指标之一[1,9]。
随着对非编码RNA的研究深入,越来越多microRNA的功能逐渐明确。多种microRNA可以作为抑癌基因或原癌基因参与肿瘤的恶性进展和预后转归。例如,miR-181d能通过抑制MGMT蛋白表达增加胶质瘤对替莫唑胺的敏感性,并且能预测胶质瘤患者的临床预后[11]。而miR-21促进胶质瘤的恶性生物学行为,与患者的不良预后相关,并能通过脑脊液等方法检测。同时,抑制miR-21的表达能够逆转胶质瘤细胞的恶性表型,有望成为胶质瘤诊疗过程中的有益补充[12]。
3、展望
脑胶质瘤是中枢神经系统最常见的原发性颅内恶性肿瘤。手术治疗辅以放疗和化疗的标准化方案是当前脑胶质瘤的主要治疗手段,但目前胶质瘤的预后仍然较差。
近年来,随着胶质瘤细胞增殖、凋亡等恶性细胞生物学行为研究的不断深入及基因分子分型体系构建和多种分子标记物的确定,针对已经明确位点设计的特异性靶向药物成为脑胶质瘤临床治疗的新选择。以受体酪氨酸激酶信号通路为靶点的多种药物,如针对VEGF信号通路的贝伐单抗、针对EGFR信号通路的尼妥珠单抗及其他靶向性替尼类药物,已进入临床应用或临床试验。但治疗过程中却也经常出现不良结局。比如,两项采用贝伐单抗联合标准放化疗治疗新诊断胶质瘤患者的III期研究发现,贝伐单抗对总生存期并无明显的改善作用。
这些试验没有达到预期效果可能是由于多数的临床试验未根据基因突变或过表达的情况筛选患者,而这些突变恰恰是药物成功治疗的靶点所在;而且血脑屏障会阻碍一部分药物渗透入颅内,达不到有效的药物作用浓度;存在的其他信号通路或反馈环路的代偿,往往会引起内在抗药;作用靶点获得性突变也是导致抗药性的原因之一。因此,在研究胶质瘤患者靶向治疗方案时,应该考虑适合接受治疗的患者群体,有效的药物投递方式,更具特异性的作用靶点和多靶点联合等综合治疗方案。
随着肿瘤基因组和蛋白质组学技术的不断发展而产生出的大量信息和数据,已经逐步发展成为用于识别、鉴定脑胶质瘤不同病理类型和进展阶段的生物标志。脑胶质瘤分型弥补临床、影像和病理学检查结果的不足,充分反映肿瘤确切的生物学行为和临床分期,并能准确判断患者的转归和预后。研究者依托已构建的胶质瘤数据库,深度解析中国人群脑胶质瘤的发生发展机制,同时加强临床研究环节和基础向临床的转化,建立分子病理指导下的脑胶质瘤预防诊治和药物研发体系,有望为最终实现脑胶质瘤精准化诊疗策略提供理论和实践支持。














共0条评论