[导读] 2008年,P H Tan等在《J Clin Pathol》发表文章“Mucinous breast lesions: diagnostic challenges”,提出乳腺黏液性病变的诊断极富挑战性,并讨论了其组织学差异以及解决这些问题的一些实用性办法,另外还讨论了表现为特征性间质内黏液或同时表现为上皮细胞外及间质内黏液的病变,现将该文献编译如下,希望对大家有所帮助,同时对原文作者致以诚挚谢意。
▌编译:山东省诸城市妇幼保健院病理科 王巍伟
黏液是一种复杂的碳水化合物,主要由特殊类型上皮细胞分泌,有时可以由间质细胞分泌。黏液对上皮组织起保护作用,并且参与上皮细胞的分化、细胞黏附调节以及信号传导。根据细胞黏液表达情况可以将其分为膜附着型黏液(调节信号传导)和分泌性黏液(直接排入细胞外腔隙)。
| 乳腺黏液性病变谱系 |
| ● 细胞外黏液 |
| 伴管腔内黏液形成的纤维囊性变 |
| 黏液囊肿样病变(MLL),良性 |
| MLL伴非典型导管增生(ADH) |
| MLL伴导管原位癌(DCIS) |
| MLL伴浸润性黏液癌 |
| 黏液性囊腺癌 |
| 浸润性黏液癌 |
| 混合性黏液-导管癌 |
| ● 细胞内黏液 |
| 黏液性化生 |
| 小叶性肿瘤 |
| 导管原位癌(DCIS) |
| 浸润性小叶癌 |
| 浸润性导管癌 |
| ● 间质内黏液 |
| 纤维腺瘤 |
| 叶状肿瘤 |
| 多形性腺瘤 |
| 腺样囊性癌(同时也有细胞外黏液) |
| 黏液基质产生的化生性癌 |
| 鳞状细胞癌伴显著黏液样间质 |
| ● 罕见病变 |
| 结节性黏蛋白病 |
| 黏液表皮样癌 |
| 转移性癌 |
| ● 黏液样病变 |
| 注射外源性物质 |
乳腺黏液性病变包括伴有管腔内黏液形成的良性纤维囊性变、黏液囊肿样病变(MLL)(从良性病变至非典型导管增生和导管原位癌)、黏液性乳头状病变、黏液癌以及其他一些伴有间质黏液和黏液样物质形成的病变。除了形成细胞外黏液的一些乳腺病变外,小叶性肿瘤、DCIS和浸润性癌(特别是浸润性小叶癌)可以表现为胞质内黏液(图1)。罕见情况下,组织学检查可以发现乳腺上皮细胞的黏液性化生(图2)。此外,间质黏液样改变可以发生于乳腺各种病变,良性病变包括纤维腺瘤、叶状肿瘤、多形性腺瘤以及结节性黏蛋白病等,恶性病变包括黏液癌和伴黏液样间质的鳞状细胞癌。
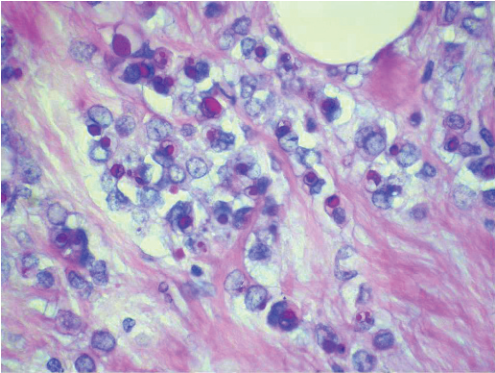
图1 浸润性小叶癌,胞质内可见黏液小球(阿尔辛蓝-PAS染色)。
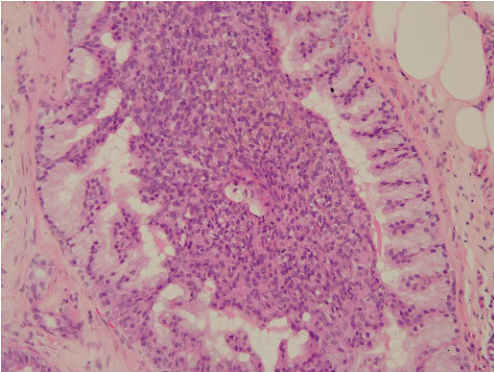
图2 终末导管普通型导管上皮细胞增生伴黏液性化生,周围上皮细胞呈柱状,细胞核位于基底侧,胞质内含黏液。
一、黏液囊肿样病变(MLL)
MLL病理学特征为存在含有黏液性物质的囊腔,并且囊壁破裂、黏液和上皮渗入周围组织。然而,这些病变可以伴有乳头型DCIS,细胞外黏液内可见显著钙化灶。伴有癌的MLL更可能发生钙化,其可以通过影像学检查发现。一些潜在性情况需要澄清,即良性纤维囊性变是否伴有普通型导管上皮增生(UDH)、ADH/DCIS或相关性浸润癌。
1、MLL伴ADH与MLL伴DCIS的鉴别
ADH和低级别DCIS是紧密相关的两种病变,组织学上根据其细胞结构特征和病变范围进行区分。MLL背景中,ADH和DCIS的诊断也依赖传统意义上单型性上皮增生的细胞结构标准,累及范围较小时称为ADH、范围较大时称为DCIS。细胞学和组织学结构特征均为低级别非粉刺型DCIS,但如果最大径小于2mm或仅累及单独一个管腔时则归为ADH。如果MLL中存在许多明显扩张导管腔隙以及评估实际累及范围存在困难,那么只有当两个或更多导管腔隙/小叶充满DCIS类型细胞时才提示为DCIS(图3)。
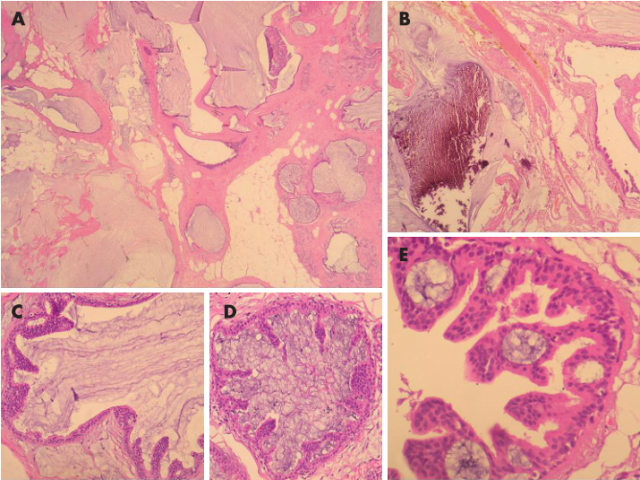
图3 黏液囊肿样病变(MLL)伴导管原位癌(DCIS)。(A)低倍镜示被挤出的黏液以及中断、膨胀、充满黏液的导管;(B)黏液内粗糙的钙化灶存在裂隙;(C-E)一些导管腔隙内(≥2个导管)被覆细胞结构异常的单型性上皮细胞,呈微乳头状和僵直拱桥结构。
2、MLL与囊性高分泌性乳腺病变的鉴别
乳腺囊性高分泌性病变包括囊性高分泌性增生和囊性高分泌性癌,含有呈囊性扩张的导管腔隙。虽然单从表面来看其与MLL相似,但是它们的腺腔内所含物质不同(胶样嗜酸性物质,与甲状腺中的胶质相似)。
3、MLL与黏液性囊腺癌的鉴别
乳腺黏液性囊腺癌非常罕见,文献中仅有少量病例报道。组织学上,可以使人联想起发生于胰腺和卵巢的同名肿瘤。多房囊性外观与MLL相似。然而,其被覆的上皮细胞为高柱状,胞质内含有黏液,细胞核位于基底部,与MLL不同。黏液性囊腺癌中肌上皮细胞的缺失表明其为浸润性病变。黏液性囊腺癌也存在黏液外渗,如果含有漂浮的肿瘤细胞,则可以导致怀疑为黏液癌。与黏液癌相比,黏液性囊腺癌细胞免疫组化ER、PR均为阴性。
4、MLL伴上皮破裂与黏液癌的鉴别
MLL充满黏液的导管破裂后,常见小的上皮碎片移位到细胞外黏液湖中,其与浸润性黏液癌中漂浮的肿瘤上皮巣相似。特别是当MLL中存在DCIS时就会造成一定困难,所关注的问题就是局灶浸润是否为真正浸润。
一种切实可行的方法就是首先评估MLL的上皮成分。如果取样很好的MLL缺乏任何异型性或原位恶性上皮细胞改变,那么漂浮于黏液中小的上皮碎片并不意味着任何不祥征兆。同样,如果MLL中仅存在局灶性ADH改变,局灶游离的细胞巢也不可能就意味着显著的浸润。然而,MLL同时伴有明确DCIS的病例中,当游离漂浮的上皮细胞巣非常少并且仅发生于局灶(图4)、上皮伴有能够识别的肌上皮细胞或者能够看到上皮与导管壁相连(似乎刚刚从腺腔边缘脱落)(图5)时,则可能为上皮移位。另外,如果附近区域存在先前穿刺所致的一些改变(例如:肉芽组织、脂肪坏死、出血),上皮移位很可能是由于穿刺操作所致,需要予以排除(图6)。
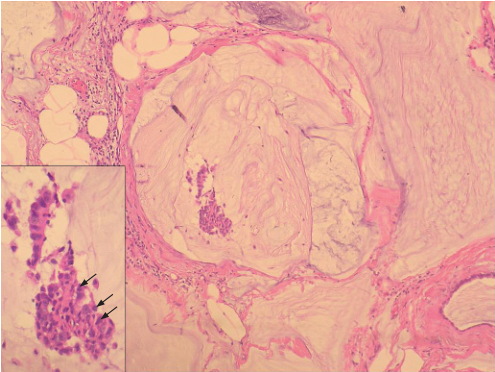
图4 黏液囊肿样病变(MLL)中的局灶不连续性上皮细胞簇,伴低级别导管原位癌(DCIS)。高倍镜示上皮细胞簇由不同种类细胞组成,第二种细胞为肌上皮细胞(插图,箭头所示)。
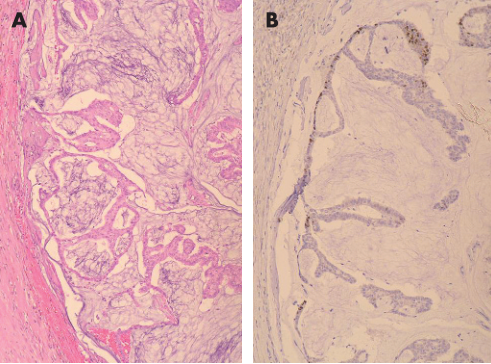
图5 黏液囊肿样病变(MLL)伴导管原位癌(DCIS),上皮似乎刚刚从下方的间质脱落(A),P63免疫组化染色证实存在肌上皮细胞(细胞核阳性)(B)。
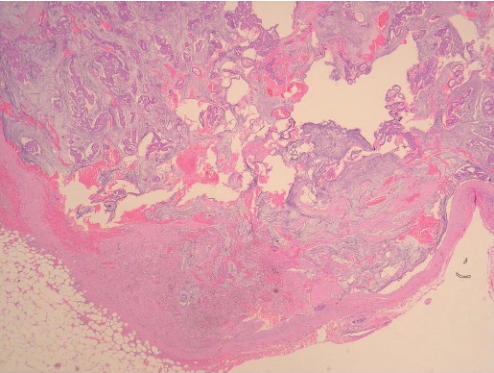
图6 浸润性黏液癌,手术切除前曾进行穿刺检查,低倍镜示出血和肉芽组织形成。黏液湖中存在许多游离漂浮的肿瘤上皮巣,为人工假象。
二、黏液癌
乳腺黏液癌预后极好,10年生存率超过80%。黏液癌又称胶样癌,特征性组织学表现为成群、规则、一致的上皮细胞悬浮于细胞外黏液湖中,且这种成分需占肿瘤90%。细胞核通常为1级核,有时为2级核,而3级核罕见,一些病理医师认为,典型黏液癌的诊断需为1级核。组织学2级黏液癌10年生存率为60%-80%。虽然可以发生DCIS,但较罕见。
1980年Capella等发现,乳腺黏液癌并非一种同质性病变,将其分为两种主要类型(A型和B型),而AB型病变则具有这两种亚型的过渡形态特征。A型黏液癌为“经典型”,含有大量细胞外黏液。B型黏液癌是一种不同亚型,其伴有内分泌分化,有时具有印戒细胞特征。
1、混合性黏液-导管癌
当典型浸润性黏液癌成分占50%-90%而剩余成分为导管癌(非其他特殊类型)时则诊断为混合性黏液-导管癌(图7),这些患者预后相对较差,其与导管癌成分多少相关。

图7 混合性黏液-导管癌,肿瘤中超过50%成分表现为典型黏液癌特征,但同时含有超过10%的非特殊类型浸润性导管癌成分。
2、黏液癌与浸润性微乳头状癌的鉴别
浸润性微乳头状癌中,恶性上皮细胞聚集成小的细胞簇,与黏液癌上皮巣相似,但是前者上皮岛位于空腔内,而后者为上皮岛悬浮于细胞外黏液湖(图8)。
MUC基因家族中,乳腺黏液癌主要表达MUC2和MUC6。MUC2也称之为凝胶形成黏蛋白,表达于黏液癌中发生极性反转的细胞,其允许细胞外黏液在恶性上皮细胞周围蓄积进而阻止肿瘤细胞扩散,这是黏液性癌呈惰性表现的一个原因。单纯性黏液癌具有极好预后的其他一些因素包括肿瘤细胞负荷降低(尤其是细胞成分较少的亚型)、血管生成减少、细胞外黏液诱导的细胞毒性T淋巴细胞活性增加。
与黏液癌一样,浸润性微乳头状癌恶性上皮细胞也表现为特征性极性反转,但是其表达MUC1。MUC1是一种糖蛋白,通常位于腺上皮细胞顶端表面,面向并且维护管腔。浸润性微乳头状癌中,MUC1表达于上皮细胞簇间质一侧或基底侧表面。
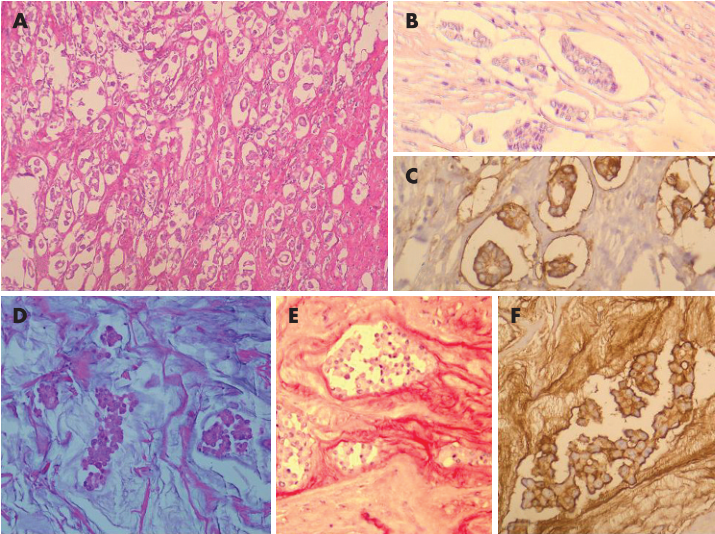
图8 浸润性微乳头状癌(A-C)和黏液癌(D-F)。(A)浸润性微乳头状癌,肿瘤细胞巢位于空洞样腔隙内;(B)黏液胭脂红染色显示黏液缺乏;(C)EMA免疫组化染色显示浸润性微乳头状癌细胞外层膜表面深染;(D)黏液癌,黏液湖内悬浮着肿瘤细胞巣;(E)黏液胭脂红染色显示细胞外黏液呈紫红-粉红色;(F)EMA免疫组化染色,同样为肿瘤细胞外层膜表面深染;此外,黏液性物质也着色。
3、黏液癌与分泌性癌的鉴别
分泌性癌是一种罕见、独特的乳腺癌亚型,其管腔及细胞内含有分泌物。黏液癌中肿瘤上皮巣悬浮于黏液湖,与其不同,分泌性癌中细胞外分泌性物质位于管腔内并且具有不同的着色强度,呈嗜双色和灰白-嗜酸性(图9)。
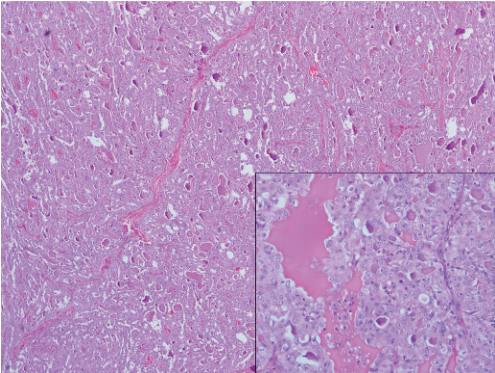
图9 分泌性癌,由肿瘤细胞岛组成,其管腔内含有嗜酸性胶样分泌物;插图为该肿瘤高倍镜图像。
三、黏液性乳头状肿瘤
乳腺乳头状肿瘤有时伴有细胞外黏液,这些病变多为实性乳头状结构,大部分显示神经内分泌分化,有时呈梭形细胞形态,为一种罕见的DCIS亚型(实性乳头状神经内分泌型DCIS)。细胞外黏液充满囊性扩张的导管腔,乳头状肿瘤突入其中,也称之为囊性黏液性乳头状癌(原位)或包裹性黏液性乳头状癌(图10)。实际上,乳头状病变中细胞内和细胞外分泌性黏液的发现是其潜在原位性肿瘤和可能的神经内分泌特征的一种线索,因为黏液在良性乳头状瘤中罕见(图11)。在不确定的情况下,使用CK5/6、CK14以及肌上皮免疫组化染色有助于鉴别良性乳头状瘤和乳头状原位癌。关于乳腺实性乳头状癌的一项研究显示,29.5%病例伴有神经内分泌样浸润性癌,23.5%病例为胶样癌。当充满细胞外黏液的扩张导管发生破裂引起外渗时就会引起一些诊断性问题,细胞外黏液偶尔会携带一些不连续上皮,导致可疑浸润。与评估MLL伴黏液外渗中的可疑浸润灶相似,不连续上皮的定量评估以及免疫组化方法检测是否存在肌上皮成分可以用于明确诊断(图12)。发现移位上皮一侧附着纤维性间质可能会有所帮助,而真正的黏液癌浸润灶通常为完全包埋于黏液的单纯性肿瘤上皮,其并不存在间质成分。肌上皮细胞明确存在则证实其为非浸润性,而乳头状原位癌中仅含有少量肌上皮细胞,这就导致很难证实肌上皮的存在(即使是免疫组化)。有学者提出,一些实性乳头状癌病例可能为具有推挤性边缘的低级别浸润性癌的一种罕见亚型,免疫组化缺乏典型肌上皮细胞,细胞外黏液将间质与实性肿瘤细胞岛分隔。
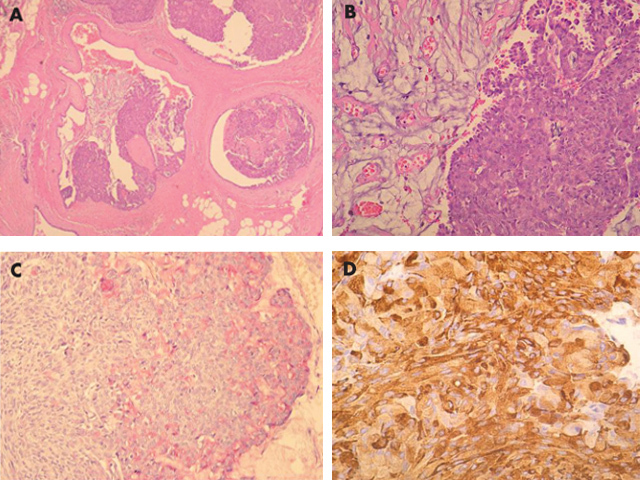
图10 (A)黏液性乳头状原位癌,实性乳头状结节突出于囊性扩张导管腔内;(B)扩张导管囊腔内充满黏液;(C)黏液胭脂红染色显示肿瘤细胞间存在黏液物质;(D)Syn免疫组化染色,肿瘤细胞呈弥漫胞质阳性(证实其神经内分泌特征)。
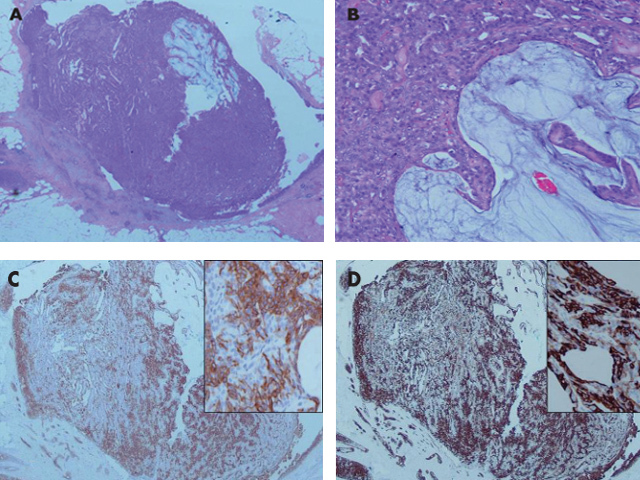
图11 (A)导管内乳头状瘤伴黏液分泌;(B)高倍镜示黏液推挤实性乳头状肿物;C、D分别为CK5/6和CK14免疫组化染色,显示肌上皮基底样型细胞,乳头状上皮增生中呈异质性分布提示为良性病变。
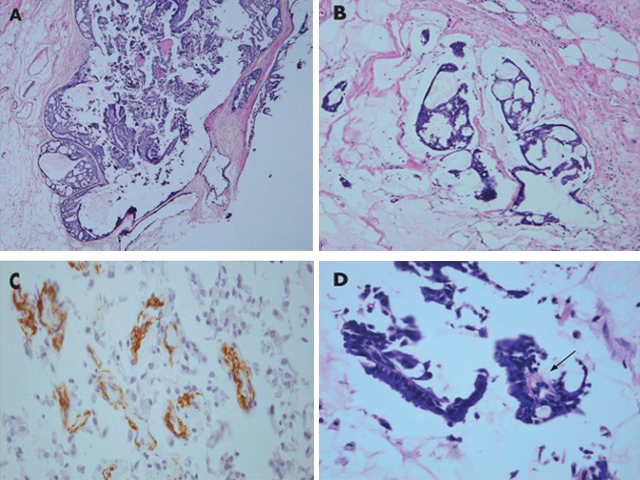
图12 先前进行过细针穿刺的黏液性乳头状原位癌。(A)乳头状原位癌低倍镜特征为叶状结构被覆深染细胞,囊腔内含有一些黏液物质;(B)局部区域黏液内可见不连续的上皮细胞巣;(C)一些不连续的上皮细胞巣所伴有的肌上皮细胞免疫组化染色SMA呈胞质阳性,与腔上皮细胞紧密相连;(D)穿刺样本中上皮伴随的少量间质(箭头所示)。
四、穿刺活检中的黏液性病变
由于穿刺活检样本量有限,所以对黏液性病变的准确诊断更加富有挑战性。Jacobs等建议,穿刺活检疑为MLL或发现间质黏液湖,应该提示进行病变切除检查,以排除黏液性DCIS或浸润性黏液癌。Renshaw等研究发现,通过穿刺活检可以对乳腺黏液性病变做出明确诊断,即使该项研究的样本量较少。如果穿刺活检中发现MLL或细胞外黏液湖,进行谨慎性肿物切除是明智之举。一种情况可能需要除外,即采用麦默通技术将影像学显示异常的病变全部切除后提供更多组织用于病理检查(组织学仅提示为良性病变),并且病理学和影像学结果一致。如果穿刺活检中发现MLL且不伴非典型性可以不进行外科手术切除。
五、乳腺病变伴间质黏液样变
结缔组织细胞也可以产生黏液,乳腺间质黏液性病变包含纤维腺瘤伴黏液性间质,如果病变使用细针抽吸发现黏液性物质,那么诊断就会产生一定困难,甚至可能做出黏液癌这种假阳性细胞学诊断。
叶状肿瘤、多形性腺瘤、腺样囊性癌以及化生性癌中也可以存在黏液性间质。此外,腺样囊性癌可以出现假腺腔内的间质酸性黏多糖和筛状上皮巢中导管腔内的中性黏多糖(图13)。
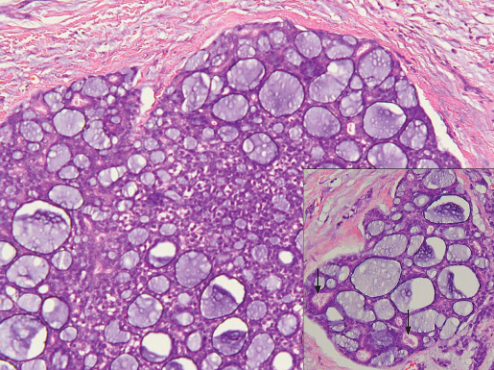
图13 腺样囊性癌,筛状上皮巢中假腺样腔隙内的黏液性物质淡染,同时偶尔可见导管腔内少量明确的絮状嗜酸性分泌物(插图,箭头所示)。
乳腺化生性癌也可以出现黏液性间质。特别是,其有一种截然不同的组织病理学亚型,为癌细胞向产生黏液基质细胞的直接转变,无梭形细胞化生过渡区域。肿瘤体积较大、细胞呈弥漫性分布以及存在非典型软骨性化生是预测该肿瘤复发或转移的因素。
鳞状细胞癌伴显著黏液性间质是另外一种罕见的乳腺恶性肿瘤,其间质富于硫酸化黏多糖。
六、罕见黏液相关性乳腺病变
乳腺结节性黏蛋白病相当罕见,通常发生于年轻女性乳晕下方区域,病理学特点为黏液性肿物,内见松散排列的梭形细胞。
黏液表皮样癌的特征是同时具有黏液细胞和细胞外黏液,与发生于涎腺的同类肿瘤相似。
乳腺转移性肿瘤罕见肿瘤黏液性成分,文献所报道的一例相当罕见的乳腺转移性脊索瘤与乳腺原发性黏液癌相似。
七、黏液样病变
注射外源性物质后,组织学可以表现为细胞外黏液样物质。正确诊断线索为黏液样物质着色强度不一并且偶尔伴有折射,同时伴有异物巨细胞反应(图14)。
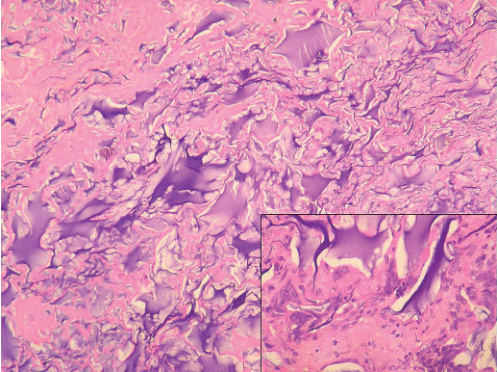
图14 乳腺隆胸术注入外源性物质,其与细胞外黏液相似,可以引起异物巨细胞反应(插图)。
参考文献:P H Tan, G M K Tse, B H Bay. Mucinous breast lesions: diagnostic challenges [J]. J Clin Pathol, 2008, 61:11-19.
附件:乳腺黏液性病变的诊断挑战性



























共0条评论