▌作者:山东省立医院病理科 姚志刚
这是一个冬日的下午,一切都稀松平常。
上班伊始,诊断秘书将切片发放到每一位诊断医生桌上。我穿好白大衣,坐在办公桌旁开始下午的工作。切片按顺序一张张拿起,放在显微镜下,又一张张取下放在切片盘里,诊断办公室里回荡着同事们玻璃切片碰撞显微镜载物台的声音。
我这天的切片多是胃癌、肠癌,对于这些肿瘤,我虽然算不上“老司机”,但处理起来满满都是“套路”。倍感挑战的是下面遇到的这一例子宫+双附件标本。女,45岁,宫颈接触性出血,HPV阳性,宫颈活检示鳞状上皮CIN Ⅲ级。临床将子宫及双侧附件切除送检。我们取材同事大体描述示宫颈内膜粗糙,可疑累及1/3全层,于是取了3块。做出的切片显示大部分为正常的鳞状上皮,部分区域则为高级别上皮内病变(CIN Ⅲ级)(图1A)。
毫无疑问,这应该与HPV感染有关。上皮下黏液腺体散在排列,腺上皮细胞呈柱状,细胞核位于基底……
等等!靠近表层有4、5个腺体上皮细胞呈立方状,细胞复层,排列拥挤,核浆比例增大,染色质粗糙,虽然未见明显核仁,但可见核分裂和凋亡(图1B)……这是传说中的宫颈原位腺癌吗?

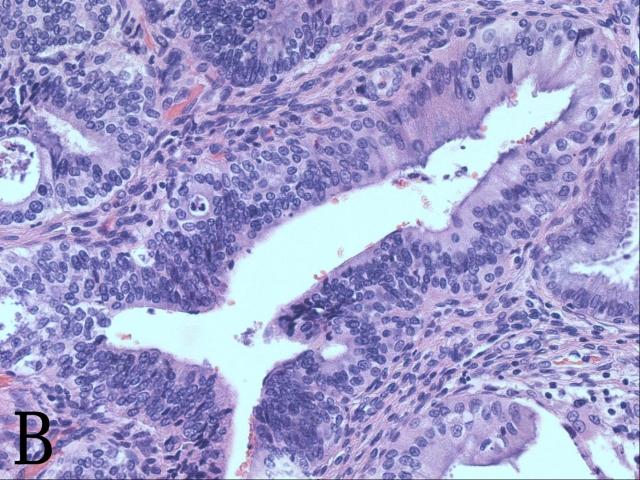
▲图1 A. 宫颈高级别鳞状上皮内病变;B. 腺体原位腺癌(可见凋亡和核分裂象)
冷静,莫非是输卵管子宫内膜化生?这种化生现象常见于宫颈内口,多是宫颈锥切后的一种修复性病变,可见纤毛上皮和插入细胞,但无核异型性、分裂象和凋亡现象,这一例似乎不太符合这种化生。
宫颈原位腺癌常伴有鳞状上皮CIN Ⅱ~Ⅲ级病变,且和HPV感染相关,而原位腺癌往往是浸润性腺癌的前期病变,反过来说,这个病例先前活检诊断的CIN病变是否仅仅是腺癌的冰山一角呢?细思极恐,有料儿……
看看病历,做做免疫组化,补补材块儿。病历中B超检查提示宫颈有一4.8×3.2×2.8 cm的低回声包块,考虑占位。找出标本来看,残余宫颈内膜比较光滑,管壁质韧,子宫内口因为第一次取材时的多切面检查而腔面破坏严重,于是将剩余宫颈下段全部、全层取材(图2A),宫颈上段和内口处各取两块。等待。
第二天下午,补取的切片出来了,我迫不及待地先看这一病例。宫颈下段显示出更多的高级别上皮内病变并累及腺体,在一处受累的腺体旁边可见一簇孤立的异常成熟的鳞状细胞,胞浆嗜伊红,核仁清晰(图2B)……这是微小浸润的节奏啊!
那么问题来了,浸润深度和宽度的测量。那一小簇细胞考虑来源于附近受累的腺体,因此深度的测量是从受累腺体的基底开始至细胞簇的对侧边缘,而宽度则是细胞簇的宽度。没毛病。
继续看宫颈上段的补材切片。只见镜下密集排列的腺体扑面而来:腺体大小不等,腺腔不规则,有分支和乳头状结构,部分腺体还有筛状结构,腺体细胞依然排列拥挤,极向紊乱,异型性明显(图2E)。宫颈微浸润性腺癌的浸润深度小于或等于5mm,而这例的异型腺体早已远远超出周围正常腺体的水平位置了。这是浸润性腺癌啊!宫颈内口的切片也可看到这些异型腺体。
等等,有一张切片近管腔面可见成簇或散在的小细胞,染色质粗糙,胞质不易见,虽然有大量淋巴细胞浸润,但可以肯定这些小细胞绝对不是淋巴细胞而更像是低分化癌(图2F)。要知道宫颈神经内分泌肿瘤常常与腺癌和鳞癌(包括原位和浸润性)同时存在。莫非这例也伴发小细胞癌?
淡定!我先喝口水压压惊。低分化腺癌和低分化鳞癌也要考虑哟!再做做组化吧,再补补材块吧。这一例昨天的免疫组化也出来了,先看免疫组化。免疫组化显示异常腺体ER-、PR-、p16弥漫强+(图2C)、Vimentin-、CEA-、Ki-67+(90%)(图2D),再结合今天补取材块中密集的腺体可以排除子宫内膜样腺癌而诊断为宫颈腺癌,而Bcl-2-可排除输卵管子宫内膜化生。欧耶!
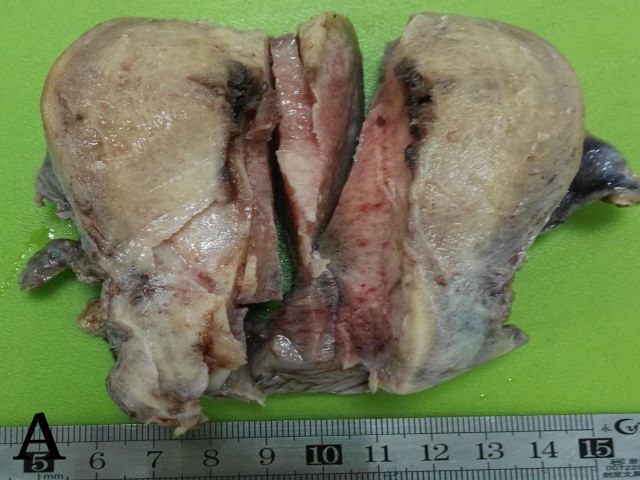
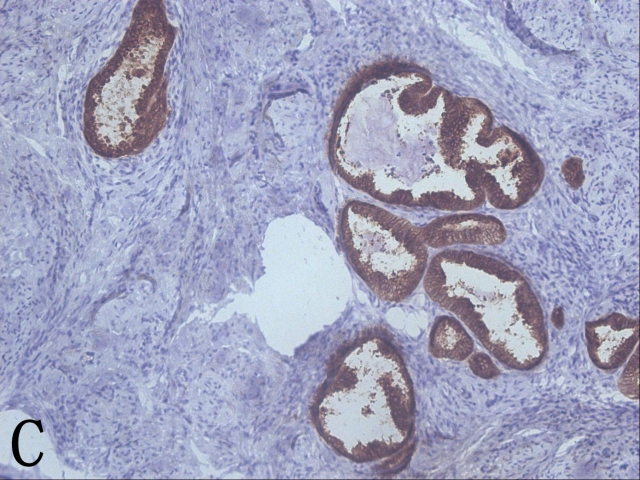
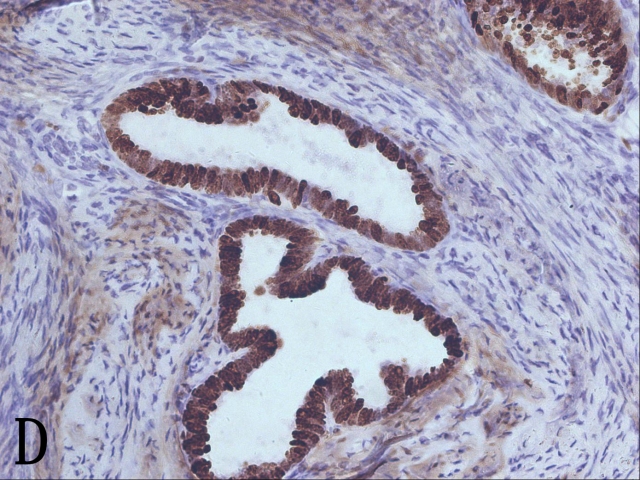
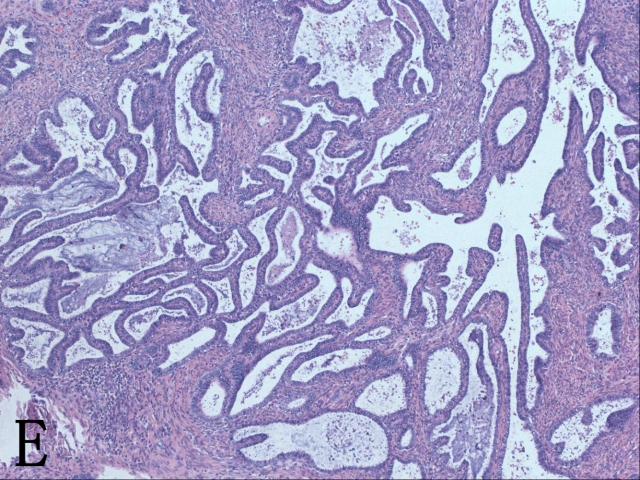
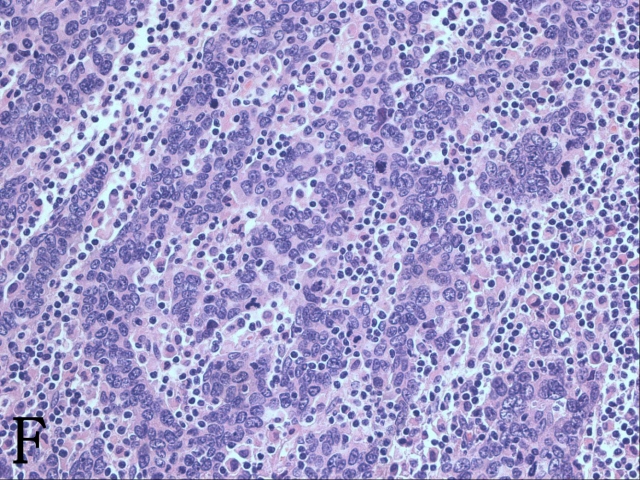
▲图2 A. 子宫第一次补取材块后的大体观;B. 高级别鳞状上皮内病变受累腺体下的微小浸润灶;C. 原位腺癌P16弥漫阳性表达;D. ki-67高表达;E. 第一次补取的材块示浸润性腺癌;F. 腺癌低分化区域
再次打开储存标本的冰箱,甲醛味儿扑面而来,口罩也无能为力。再次扒拉着找到这个标本,仔细端详宫颈内口,内口表面虽然取材破坏严重,但还原一下还是能看到一直径约0.3cm的微小糜烂面,这次从宫颈内口向宫腔子宫内膜方向又补取了7、8块。然后等待。
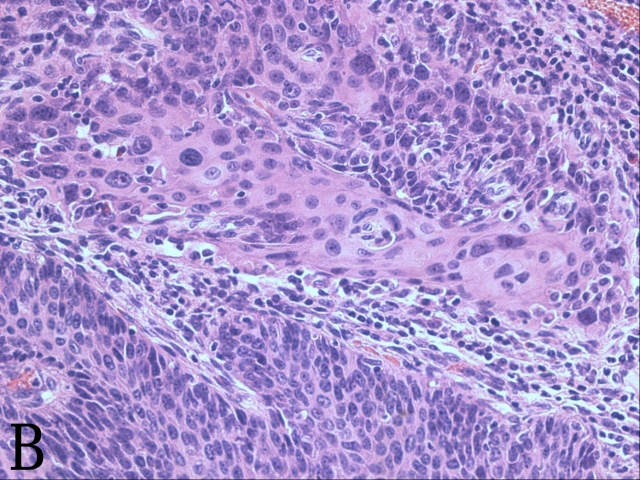
第三天下午,再次补取的切片出来了,我迫不及待地又先看了这一病例。糜烂处镜下有大量淋巴细胞浸润,掺杂大量低分化细胞呈梁状或实性片状生长,有些呈巢状分布,周边整齐似基底细胞癌巢(图3A),但细胞较小,胞浆不明显,染色质粗糙,可见较多核分裂象(图3B),未见坏死,浸润至1/3全层。这些形态提示可能是小细胞癌或者低分化鳞状细胞癌。宫颈鳞状细胞癌好发生于鳞、柱交界处,补取材块的部位位于宫颈内口,早已远远高于鳞、柱交界部位。等免疫组化切片出来了或许会立见分晓。
随后的免疫组化切片显示该低分化区域CK8/18+(图3C)、CAM5.2+、P16弥漫强+、CD56-、Syn-、CgA-、Ki-67+(90%),而p63-(图3D)、P40-、CK5/6-。据此,可以诊断为低分化腺癌。

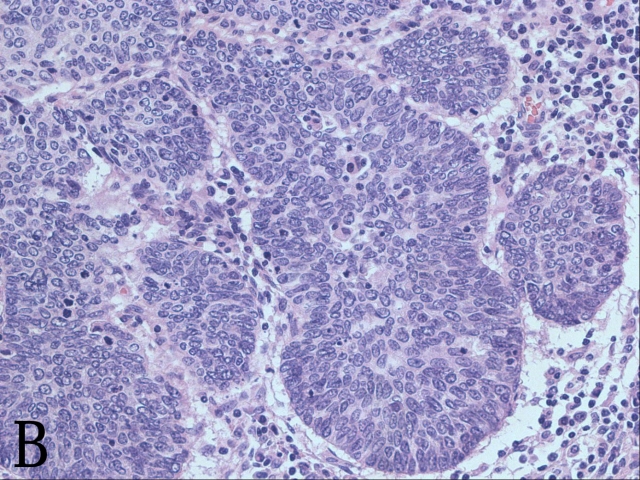
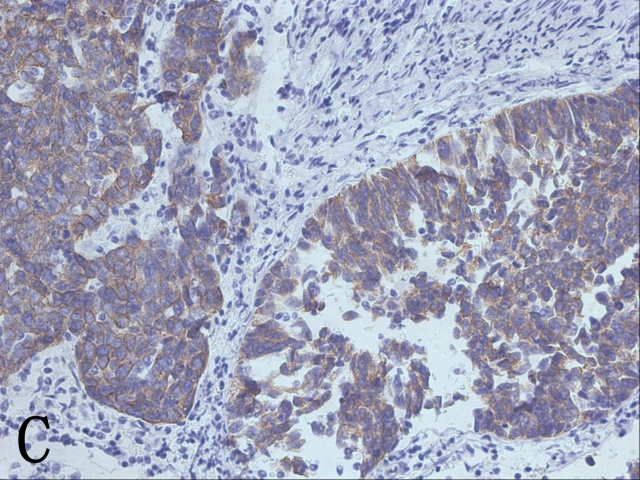
图3 A. 腺癌呈基底细胞巢状结构;B. 放大图像示周边细胞栅栏状排列,可见大量核分裂象;C. CK8/18阳性表达;D. p63阴性表达,鳞化上皮的基底可见阳性对照
但事情还没完,那些像基底细胞癌巢状结构怎么解释呢?发之于内,必形之于外。有一定的分子生物学机制,必有相应的细胞表型和行为。这些细胞巢周边细胞呈栅栏样排列,恰似宫颈的腺样基底细胞癌,这种癌与HPV(多为HPV16)感染也有关,也可同时伴有高级别CIN病变,甚至可以见到早期浸润性鳞状细胞癌病变,但这种肿瘤p63染色强阳性表达,Ki-67表达较低。本例p63染色阴性,Ki-67高表达,可见大量核分裂象,因此腺样基底细胞癌的诊断不成立。腺样基底细胞癌起源于宫颈黏膜下的多潜能储备细胞,猜测本例基底细胞癌巢状结构可能是腺体储备细胞向腺癌方向分化过程保持着腺体细胞的排列方式导致。最终该病例宫颈病变的诊断结果为:宫颈鳞状上皮内病变,高级别,局灶伴微小浸润,镜测浸润深度约0.03cm;宫颈浸润性腺癌,中至低分化。
最后总结该病例诊断过程的几点感想:
(1)宫颈鳞状上皮内病变在取材时应将宫颈管黏膜全部取材,取材范围还应注意宫颈上段和宫颈内口;
(2)镜下观察鳞状上皮的同时还应留意腺体有无细胞和结构的异型性;
(3)宫颈鳞状上皮内瘤变、腺体上皮内瘤变、神经内分泌肿瘤可相互伴发,并与HPV感染有关,诊断宫颈鳞状上皮内瘤变的同时应注意伴发其他肿瘤的可能性;
(4)诊断过程如发现异常区域信息不足应积极补材,必要时行免疫组化验证自己的诊断并进行鉴别诊断。
感谢科室同事曹智新医生、程红霞主任、孙锡超主任在本病例诊断过程给予的帮助。
参考文献:
郑文新, 沈丹华, 郭东辉. 妇产科病理学. 北京. 2013, 科学出版社.

























共0条评论