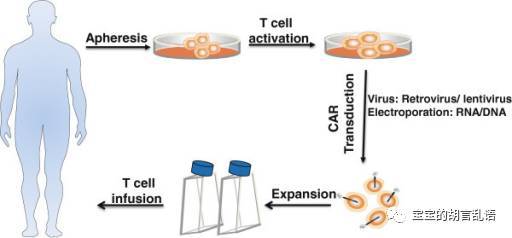
所谓的肿瘤免疫治疗,这是一个古老的概念,它的逻辑基础是,肿瘤的突变发生在免疫系统的监视之下。诚然,绝大部分早期的肿瘤突变确实都被免疫监视(immuno-surveillance,亦称之为免疫编辑,immunoediting)所清除了。这是因为,突变肿瘤中的一小部分细胞产生了一种被T细胞认为是“不是自己人”的蛋白,这类蛋白被称为“新抗原”(neoantigen),免疫编辑的主要敌人就是这些新抗原。不过,肿瘤细胞亦非等闲之辈,它们自身表达一些抑制免疫反应的分子来对抗机体对其的免疫监视,比如PD-L1、IDO、IL-10和TGFβ等。通常,这种自身免疫系统和肿瘤的激烈鏖战在体内持续好多年,时间长了,我们自身的免疫系统就会产生一种现象,叫做T细胞耗竭(T cell exthaustion),也就是说T细胞表面就会表达一些抑制性的分子,比如PD1,TIM3,LAG3等等,更有甚者,耗竭状态下的T细胞甚至会释放IFNγ,诱导肿瘤微环境里的PDL1和IDO上调,让自身的免疫系统不得发挥作用、缴械投降。这种抑制性的肿瘤微环境,就是很多直接刺激肿瘤免疫反应药物无法产生作用的原因。
通常我们称这些“T细胞上肿瘤抑制性通路”为免疫卡控点(immunecheck-point)。2011年,世界上第一个被批准的免疫卡控点药物是Bristol-Myers Squibb公司的CTLA4抑制单抗Ipilimumab(Yervoy)。当医生和医学科学家们有了新的抗癌武器,那么很自然的,就会想到将新武器和古老的抗癌方法相联合,这也有成功的先例,比如说治疗B细胞淋巴瘤的CHOP化疗方案和CD20靶向单抗rituximab相联合的使得这类淋巴瘤治疗的成功概率大大增加。然而,这些免疫卡控点抑制剂和原来的靶向治疗有本质的不同,一些药物在肿瘤病人中显示了非常长的有效期,这在以前的靶向治疗时代很少见。
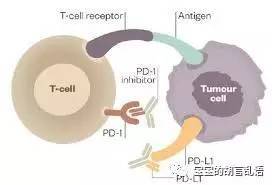
随着第二代免疫卡控点抑制剂——靶向PD-1/PD-L1--的产生,FDA加速批准了一大批免疫卡控点药物,比如pembrolizumab用于治疗恶性黑色素瘤,nivolumab用于治疗黑色素瘤和肺癌,等等。将PD1和CTLA4药物联合使用,极大的提高了恶性黑色素瘤患者的客观反应率。由于肿瘤微环境有明显的抑制性,所以先用免疫卡控点解除免疫抑制环境是明智的选择。那么接下来的问题来了,在PD-1解除免疫环抑制的基础之上,我们目前还有很多与其联合用药的选择。
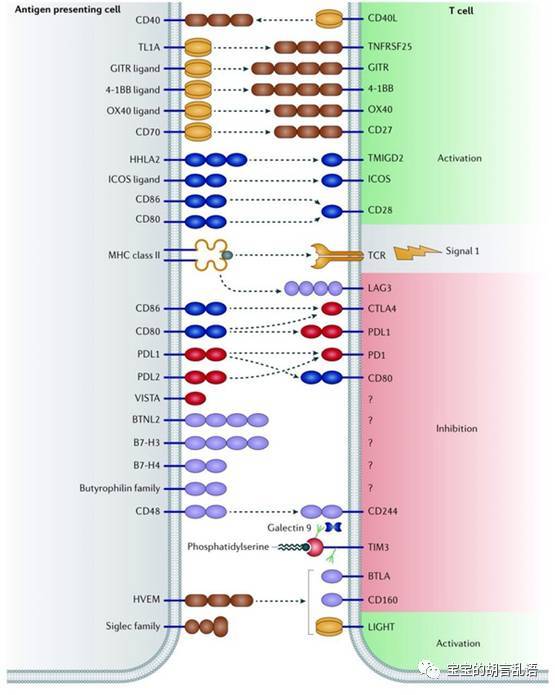
1. 以免疫卡控点作为骨干基础选择
同时使用CTLA4和PD1抑制剂或许是有道理的,因为虽然CTLA4和PD1都表达在T细胞上,他们的抑制机制却不同。CTLA4与CD28竞争性CD80/86信号途径,从而激活T细胞,而PD1则是表达在激活的淋巴细胞上,在耗竭的淋巴细胞上过度表达。在一些I、II期临床研究中,联合上述二者能够显著提高肿瘤的反应率。
2. 与化疗联合
越来越多的证据表明,免疫治疗在很多的肿瘤中都有效,和化疗联合则可以充分利用化疗的如下优点:首先是降低瘤负荷,进而保留通过肿瘤坏死暴露新抗原,进而直接影响肿瘤基质细胞。确实也有很多数据支持细胞毒性化疗药物能够改变肿瘤微环境的免疫抑制情况。比如,历史上曾经发现环磷酰胺能够耗竭抑制性的Treg细胞,使用该药能够提高免疫反应。此外,其他一些化疗药物,比如5-Fu、吉西他滨、紫杉类药物能够降低抑制性大魔头细胞MDSC的数量。甚至有些化疗药物有“肿瘤疫苗”的活性,增加肿瘤抗原被递呈给T细胞的数量。在设计临床实验时,需注意标准化疗的疗效是否被抵消。索性,目前的将nivolumab和铂类为基础的肺癌化疗研究显示,总的反应率与历史报道并无差别。
3. 与BRAF抑制剂联合
随着免疫治疗研究的升温,既往的一些分子靶向药物耐药现象被重新研究,被认为可能与免疫相关。在恶性黑色素瘤中,BRAF抑制剂vemurafenib或许通过交叉提呈(cross-presentation)提高抗肿瘤效果,而很多对BRAF抑制剂的耐药的肿瘤则表现出PDL1表达上升。在临床前的小鼠研究中发现,将PD1/PDL1抑制剂与BRAF抑制剂联合使用能够提高肿瘤浸润淋巴细胞的活性,延长生存。所以,目前一些将PD1抑制剂和BRAF抑制剂(如Vemurafenib、dabrafenib)或者MEK抑制剂(trametinib)联合使用的临床实验正在进行。但是,值得注意的是,CTLA4抑制剂Ipilimumab和Vemurafinib联合使用的I期临床实验因为肝毒性大被提前终止了。
4. 与VEGF靶向药物联合
著名的VEGFR-TKI(血管生长因子受体-酪氨酸激酶抑制剂)sunitinib能够抑制肿瘤和血管细胞的生长因子信号,降低免疫抑制坏细胞MDSC在肿瘤内的聚集。目前临床I期研究发现,将nivolumab和sunitinib联合使用于肾癌患者,肿瘤的反应率高于二者单独使用。很多肿瘤会将VEGF释放入血浆中,重塑和修复肿瘤和血管,VEGF是一个肿瘤预后差的指标。目前有I期临床实验将VEGF特异性mABbevacizumab和PDL1特异性单抗atezolizumab联合使用,毒副反应轻微。
5. 新靶向——TNFR家族
肿瘤坏死因子家族蛋白一直是肿瘤治疗研究热点。早期的药物是直接靶向并杀伤肿瘤细胞,但是通常因为毒性较大(尤其是肝毒性)限制其使用。但是二代的药物,比如4-1BB(也被称作CD137/TNFRSF9)则有较好的前景。与免疫卡控点不同的是,这类抗体的作用是激活受体,进一步激活T细胞免疫。这与卡控点接触免疫抑制的功能相得益彰,使二者联合使用显得非常有前景。
6. 免疫微环境靶向
我们目前的关注点仍在细胞-细胞相互作用上,具体一点是抗原提成细胞APC和淋巴-肿瘤细胞之间的相互作用上。但是,肿瘤的世界里有着不计其数的可溶性、分泌性分子在调节着肿瘤的生长分化。
总结:免疫联合治疗的目的其实是使得更多的病人能够产生一个长时间的、稳定的疗效。对免疫治疗疗效的评估、预测因子的进一步研究,都让我们挑战了对传统的TNM分期、RECIST反应评估标准,将肿瘤生物学的理解和肿瘤治疗推到新的台阶。卡控点治疗只是一个开始,就好像20年前赫赛汀靶向治疗开启了划时代的肿瘤靶向治疗一样,需要我们在层出不穷的免疫治疗进展中找到打开治疗的金钥匙,是新一代肿瘤科医生、医学科学家的职责所在。
参考文献:
Kathleen M.M., Gordon J.F. Combination cancer immunotherapy andnew immunomodulatory targets. Nature Reviews. Aug 2015.
















共0条评论