[导读] 编译整理:强子
(二) 细胞学标本的处理
本文提出的假体周围积液处理方案如图2。具体建议抽取20-50mL,分为三等份而分别进行细胞病理检查、流式细胞学免疫分型、分子遗传学检测。
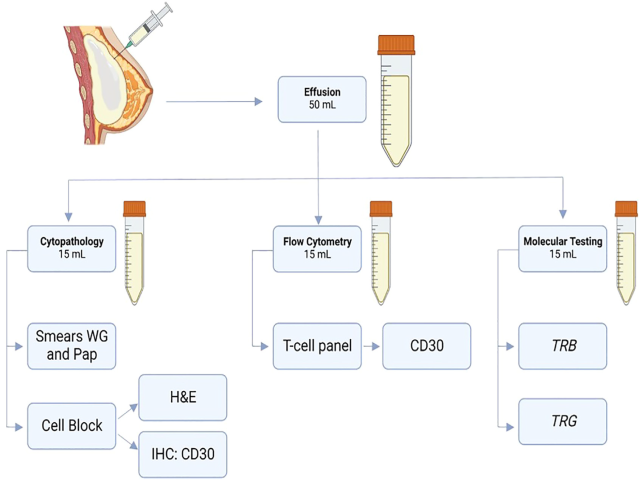
图2.假体周围积液处理方案。建议抽取20-50mL,分为三等份,每份5-15mL。一份送细胞病理检测,做Wright-Giemsa染色和巴氏染色,同时做细胞块进行CD30免疫组化;一份送流式细胞学,做T细胞标记物的免疫分型,包括CD30和TRBC1限制性分析;一份做TRG和TRB基因分子遗传学检测,确定克隆性。
细胞学标本:涂片及细胞块
乳腺假体植入后常见积液,且一般是血肿,是和手术操作本身相关、或可能存在感染所致。与此不同,BIA-ALCL中的积液一般发生于隆乳数年后,即所谓的“迟发”黏液肿;具体是指初次手术后≥1年出现的积液。
积液患者最显著的特征是假体和纤维包膜之间的间隙内存在浑浊的液体蓄积。细针抽吸并细胞学评估是BIA-ALCL患者积液评估中快速、安全且有效的方法。积液可自少量、至500mL以上不等。对积液进行形态学评估,也可在细胞离心浓缩后进行。淋巴细胞分离液(Ficoll-Hypaque)密度梯度离心法可以去除退变的细胞和碎屑而显著改善细胞制片的质量。
BIA-ALCL中的淋巴瘤细胞在细胞学标本中,类似淋巴结或淋巴结外间变性大细胞淋巴瘤的细胞表现。Wright-Giemsa染色或May-Grünwald-Giemsa染色制片中,细胞丰富、均质,为无黏附的大细胞构成,细胞核呈不规则分叶状,有显著核仁,胞质丰富。瘤细胞一般是成熟小淋巴细胞的4-5倍;胞质透明至淡蓝色,一般有散在的小空泡,且可见胞质碎片。少见情况下,胞质内大量空泡且相互融合、因此导致肿瘤细胞呈印戒样表现。背景为颗粒状或纤维性,有时伴细胞核破裂形成的碎屑。背景中的炎症细胞数量不一,可从极少至大量,具体为小淋巴细胞、中性粒细胞、组织细胞、嗜酸性粒细胞。巴氏染色中可见细胞核深染、伴分叶状表现,有显著核仁。淋巴瘤细胞的胞质呈不透明、嗜碱性。
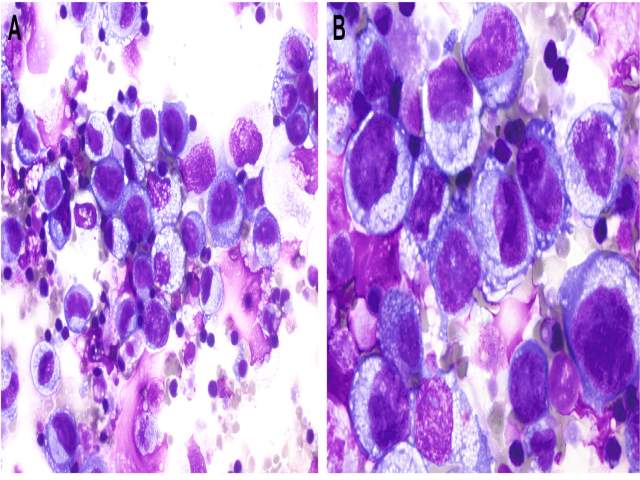
图3.BIA-ALCL细胞学特征。本例为离心制片细胞学标本Wright-Giemsa染色,淋巴瘤细胞大而间变性,细胞核不规则,核仁明显,胞质丰富,偶见空泡状胞质。
制备细胞块对于形态学评估和免疫组化检测都有极大帮助。免疫组化CD30检测对于BIA-ALCL的诊断非常可靠,也是最切实可行的方法,且很多坏死细胞的残影也会有显色。因此CD30免疫组化中所见淋巴瘤细胞要比常规HE染色切片中所见更多。
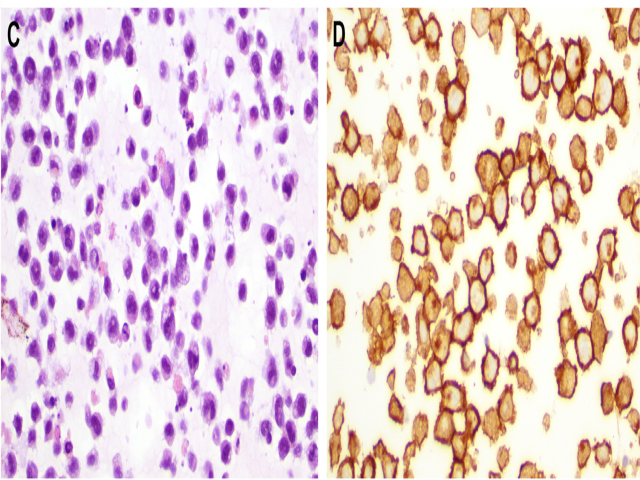
图4.BIA-ALCL细胞学特征。本例为积液细胞蜡块,可见散在的较大淋巴瘤细胞,免疫组化CD30显示大部分细胞为阳性。
BIA-ALCL中常表达的其他标记还有CD43(约80%)、CD4(约80%)、TIA-1(约70%)、颗粒酶B(约70%)、EMA(约60%)、CD3(约33%)、CD8(约10%)。尽管大部分病例都不会表达TCR,但据报道TCR αβ和TCR γδ分别可见见于11%、10%的病例。根据本文原作者所述,他们对200多例BIA-ALCL的经验表明,所有病例均不表达ALK;但也有文献报道ALK1的阳性率约8%。BIA-ALCL也不表达CD1a、TdT、cyclin D1。EB病毒编码的小RNA原位杂交100%为阴性。重要的是,最近已发现有乳腺假体相关的EB病毒阳性大B细胞淋巴瘤。
如果患者最近(数日至数周内)做了肿瘤积液的引流或抽吸,则BIA-ALCL的诊断可能难度较大:新出现的积液中肿瘤细胞数量可能较少,而主要是中性粒细胞或组织细胞。此外,还有些患者最近切除了假体而未切除包膜、或做了引流而防止积液;这种情况下、即使加做CD30免疫组化,细胞学标本可能也会得出未见肿瘤细胞的假阴性结果。
流式细胞学免疫表型分析
可疑BIA-ALCL患者的积液应做流式细胞免疫表型分析,评估T细胞是表达CD30、还是异常免疫表型。目前还可通过流式细胞学评估TRBC1的表达来进行克隆性分析。
PCR基础上的克隆性分析
积液标本和固定后石蜡包埋细胞块标本都可以进行PCR相关检测来评估T细胞受体基因重排。BIA-ALCL具有TRG或TRB的单克隆性重排。文献中数据表明,41.7%的病例(5/12)具有TRB的单克隆性重排,76.5%的病例(26/34)具有TRG的单克隆性重排。本文原作者提出,BIA-ALCL病例中的单克隆比例可能更高一些。单克隆检测的成功率可能受限于肿瘤细胞少、或受限于常伴大量坏死。
——未完待续——
往期回顾:
隆乳有风险,大家都要谨慎(一)
















共0条评论