[导读] 译者:慧海拾穗
【简介】
间变性大细胞淋巴瘤(ALCL)是一种T细胞淋巴瘤,由具有不规则肾形细胞核(“标志性细胞”)的多形性大细胞组成,并且CD30阳性,在大多数病例中,间变性淋巴瘤激酶(ALK)蛋白阳性。
在当前世界卫生组织分类中,ALCL分为ALK+和ALK-类型。ALCL累及淋巴结和结外部位,包括皮肤、软组织、肝脏、肺和骨骼,较少涉及中枢神经系统(CNS)和胃肠道。
ALCL发生在任何年龄,包括儿童。ALK+ALCL最常见于生命的前三十年,男性更常见,表现为具有全身症状的侵袭性III期和IV期疾病,常累及结外,对化疗反应良好。ALK-ALCL发生在老年患者(第6个十年发病率最高),男性较少见,晚期较少,但皮肤、胃肠道和肝脏频繁受累,骨髓(BM)受累频率较低。一种成人ALK-ALCL独立亚型发生在乳房植入的患者中。
预后
ALK+ALL的预后良好,但血液受累的病例除外,后者具有侵袭性。
ALK-ALCL发生在老年患者中,在男性和女性患者中的分布相似,并且与不良预后和较低的III期和IV期疾病发生率相关。
微阵列基因表达谱监督分析显示ALK+ALCL和ALK-ALCL具有不同的基因表达谱,进一步证实它们是不同的实体。
ALK+和ALK-标本之间差异表达最显著的基因,Lamant等人发现BCL6、PTPN12、CEBPB和SERPINA1基因在ALK+ALCL中过度表达。
因此,有人提议伴间变性特征的ALK-淋巴瘤可能代表CD30+PTCL的变体。
ALK+间变性大细胞淋巴瘤
简介
ALK+ALCL是一种T细胞淋巴瘤,由具有丰富细胞质和多形性,通常为马蹄形细胞核的大细胞组成,涉及ALK基因易位和ALK蛋白的表达。
ALK+ACL好发于儿童和年轻成年人(中位年龄34岁),男女比例为3:2。
ALK+ALCL经常累及淋巴结和结外部位,包括皮肤、骨骼、软组织、肺和肝脏。
10-30%病例累及骨髓。
小细胞型ALK+ALCL可能具有白血病表现,伴有血液受累。
无论ALK阳性,血液或骨髓中明显肿瘤的发现与预后非常差有关。
大多数患者为进展期III期和IV期,伴有外周和腹部淋巴结肿大、B症状(尤其是发热),通常与结外浸润和骨髓受累有关。
形态学
①淋巴结
ALK+ACL表现出广泛的形态谱,包括普通型、淋巴组织细胞型、小细胞型、巨细胞型、单形性和霍奇金样型。已描述了AKL+ACL的五种形态亚型:经典型(普通型),淋巴组织细胞型,单形性,小细胞型,霍奇金样,复合型。
大多数ALCL是经典型(普通型)(60%)(图24.1)。
典型病例显示具有特征性马蹄形或肾形细胞核(“标志性细胞”)的大肿瘤细胞,核仁明显,细胞核周嗜酸性区域,以及丰富的细胞质。
淋巴组织细胞型(图24.2)的特征是肿瘤细胞与大量组织细胞混合,瘤细胞通常比普通型小。
单形性(图24.3)含有大量单一形态细胞弥漫性浸润,细胞核主要为圆形,核仁明显,类似免疫母细胞性淋巴瘤。
小细胞型(图24.4)以小到中等大小淋巴细胞为主,具有散在的大标志性细胞。ALK的表达将该亚型归入ALCL范畴,尽管细胞大小较小且缺乏明显的间变性特征。
霍奇金样型很少出现(<5%),其特征是形态学特征类似于经典型霍奇金淋巴瘤(cHL)的结节硬化亚型。
部分(15%)ALK+ALCL显示由一种以上的组织形态学亚型组成。
淋巴结受累的模式可能是弥漫性、滤泡周围/T区(图24.5),或是局灶肿瘤细胞特征性窦内分布,类似于转移性肿瘤。
一些肿瘤细胞具有明显的核膜内陷,形成“甜甜圈”样细胞,而其他细胞类似Reed-Sternberg细胞(图24.6)。
巨细胞型ALCL具有不规则、通常奇异的细胞核的大细胞(图24.7)。
罕见的ALCL可能在黏液样间质中显示出明显的梭形细胞。

图24.1 ALCL普通型。(a-c)病例1:(a)多形性淋巴样大细胞浸润。许多细胞核不规则,呈马蹄形(所谓的标志细胞)。(b)低倍镜下显示局灶肿瘤细胞窦内分布。(c)窦内成簇肿瘤细胞显示ALK强核和胞质表达。(d-g)病例2:(d、e)弥漫性大细胞浸润,具有显著的异型性和大量的核分裂。肿瘤细胞显示CD30(f)和ALK(g)强表达。 |
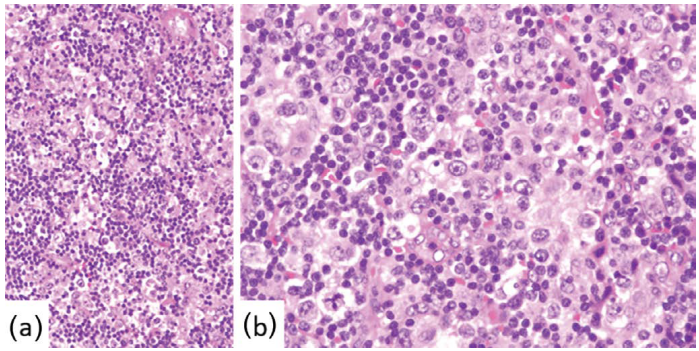 图24.2 ALCL-淋巴组织细胞型。多形性肿瘤细胞与组织细胞和小淋巴细胞混合(a,低倍,b,高倍)。 图24.2 ALCL-淋巴组织细胞型。多形性肿瘤细胞与组织细胞和小淋巴细胞混合(a,低倍,b,高倍)。
|
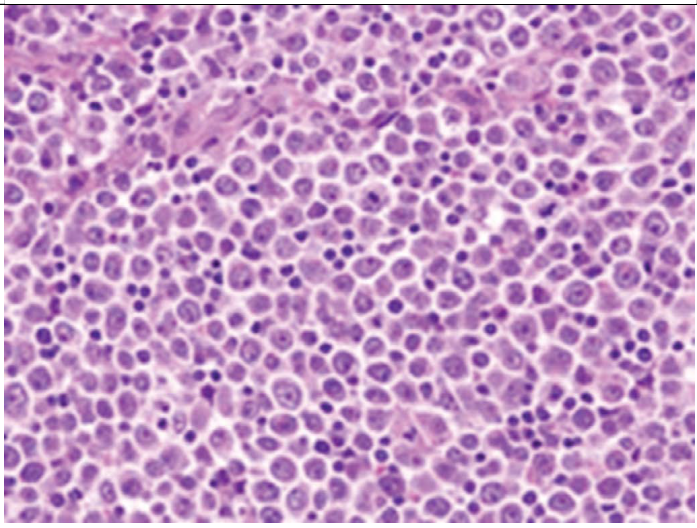 图24.3 ALCL–单形性。非典型的大淋巴细胞在大小和形状上几乎没有差异。 图24.3 ALCL–单形性。非典型的大淋巴细胞在大小和形状上几乎没有差异。
|
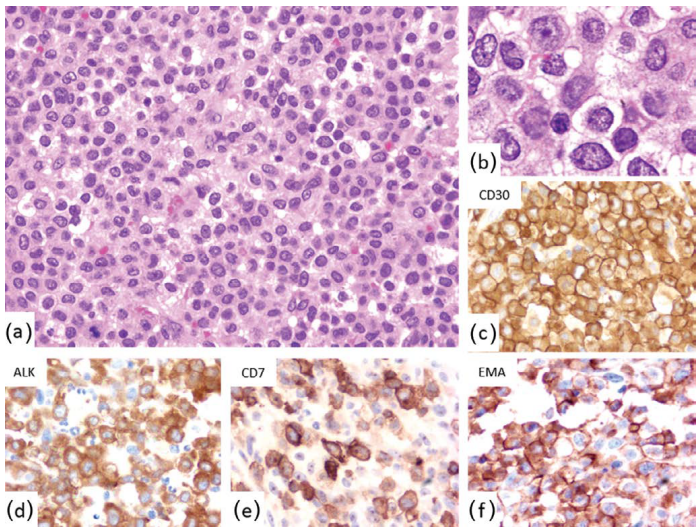 图24.4 ALCL-小细胞型。(a)弥漫性淋巴样细胞浸润,主要是具有不规则细胞核的小细胞(b,高倍镜)。肿瘤细胞CD30(c)、ALK(d)、CD7(e)和EMA(f)阳性。 图24.4 ALCL-小细胞型。(a)弥漫性淋巴样细胞浸润,主要是具有不规则细胞核的小细胞(b,高倍镜)。肿瘤细胞CD30(c)、ALK(d)、CD7(e)和EMA(f)阳性。
|
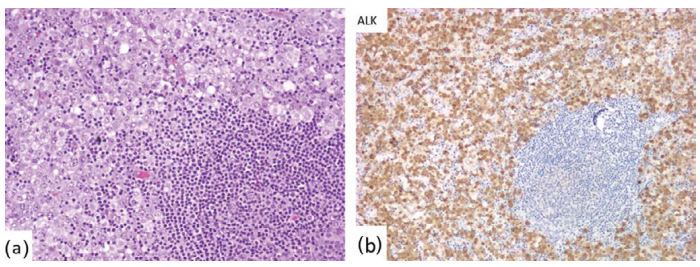 图24.5肿瘤细胞“T区”分布的ALCL(a,组织学;b,ALK免疫染色)。 图24.5肿瘤细胞“T区”分布的ALCL(a,组织学;b,ALK免疫染色)。
|
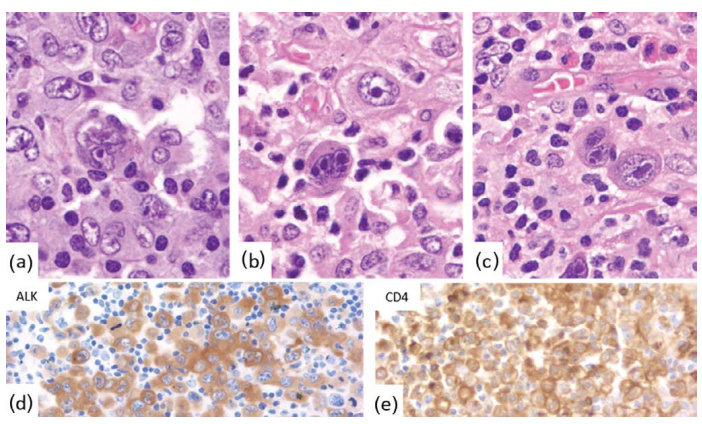 图24.6具有Reed-Sternberg样细胞的ALCL(a–c,组织学;d,ALK;e,CD4)。 图24.6具有Reed-Sternberg样细胞的ALCL(a–c,组织学;d,ALK;e,CD4)。
|
②结外部位
ALCL通常累及结外部位(图24.8),包括脑脊液(CSF)、肝脏、皮肤、脾、肺、睾丸和骨/骨髓、体腔和软组织。ALCL很少与白血病血液受累相关,这些病例可能表现为广泛的结外疾病。大多数累及血液的病例属于ALCL的小细胞类型。
③Bone marrow骨髓
骨髓ALCL表现为弥漫性、结节性、间质型或少见的窦内模式。ALK+肿瘤多见于间质型,ALK-肿瘤多见于结节型。肿瘤细胞CD30、CD43和一些全T细胞标记物呈强阳性。CD30和/或ALK的免疫组织化学染色尤其有助于识别骨髓受累的ALCL小细胞型。
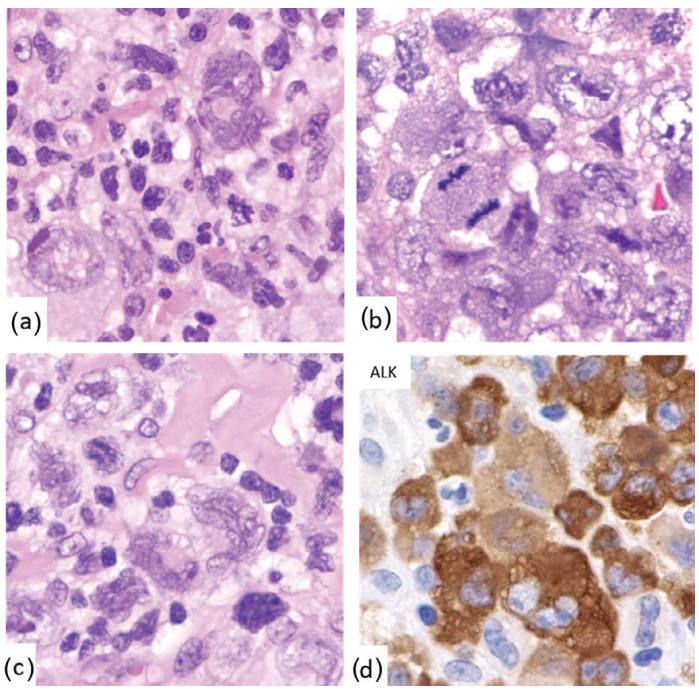 图24.7 ALCL-巨细胞型。(a-c)显示大而奇异的肿瘤细胞和核分裂。(d)ALK免疫染色。 图24.7 ALCL-巨细胞型。(a-c)显示大而奇异的肿瘤细胞和核分裂。(d)ALK免疫染色。
|
免疫表型
①免疫组织化学
ALCL中ALK的表达可能是细胞核、核仁和细胞质(图24.9)。
t(2;5)与细胞核/核仁和细胞质染色有关,除t(2;5)之外显示细胞质染色。
肿瘤细胞CD30细胞膜强阳性,核周高尔基区更强(图24.10)。
在小细胞型ALCL中,CD30的表达可能不太突出。
大多数病例CD45、CD43和上皮膜抗原(EMA)阳性。
全T抗原经常异常表达(只有约10%的ALCL对所有四种全T抗原都呈阳性)。
CD7最常缺失,CD2最不常缺失(图24.11和24.12)。
部分ALCL可能对所有四种全T抗原(“裸细胞型”)均为阴性。
大多数病例为CD4+(-70%),但CD8+、CD4+/8+或CD4-/8-病例也可见。
ALCL主要是TCRαβ+(-70%),其余病例不表达T细胞受体(TCR)。
部分ALCL表达CD56。
浆细胞标志物MUM1可阳性。
在ALK+和ALK-ALCL中,CD56+患者的预后比CD56-患者差[35]。
部分病例显示CD45表达异常缺失(图24.13)。
ALCL中PAX5为阴性。
罕见的ALCL病例可能显示CD15的异常表达(图24.14)。
大多数ALK+ALCL表达细胞毒标志物(TIA1、粒酶B、穿孔素)以及EMA和clusterin。
EBER和BCL2均为阴性。
 图24.8结外ALK+ALCL:(a)皮肤,(b)软组织,(c)骨,(d)肺。(e)胸腔积液伴淋巴结受累。(f)睾丸。 图24.8结外ALK+ALCL:(a)皮肤,(b)软组织,(c)骨,(d)肺。(e)胸腔积液伴淋巴结受累。(f)睾丸。
|
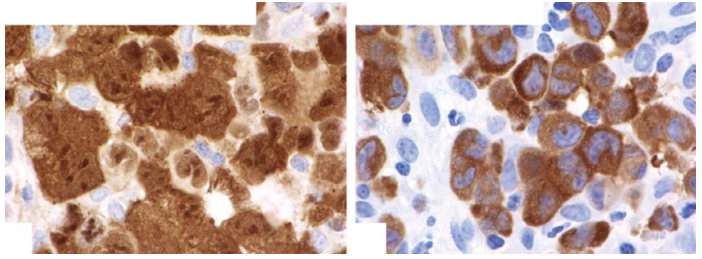 图24.9 ALCL中ALK表达的两种模式:(a)细胞核、核仁和细胞质染色;(b)细胞质染色。 图24.9 ALCL中ALK表达的两种模式:(a)细胞核、核仁和细胞质染色;(b)细胞质染色。
|
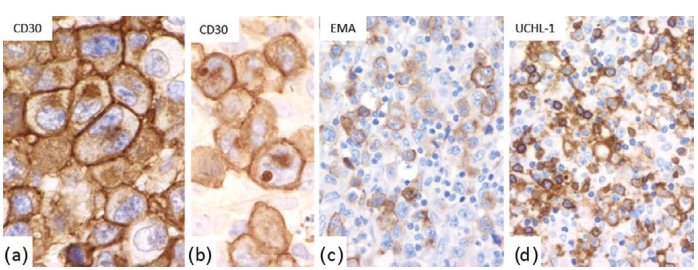 图24.10 ALCL免疫组织化学。肿瘤细胞CD30(a和b,强膜和高尔基区染色)、EMA(c)和UCHL-1(d)阳性。 图24.10 ALCL免疫组织化学。肿瘤细胞CD30(a和b,强膜和高尔基区染色)、EMA(c)和UCHL-1(d)阳性。
|
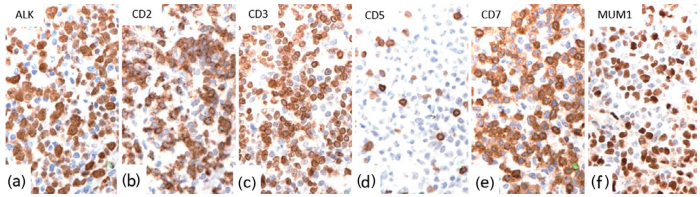 图24.11表达ALK(a)、CD2(b)和CD3(c)的ALCL。CD5阴性(d),CD7(e)和MUM1(f)阳性。 图24.11表达ALK(a)、CD2(b)和CD3(c)的ALCL。CD5阴性(d),CD7(e)和MUM1(f)阳性。
|
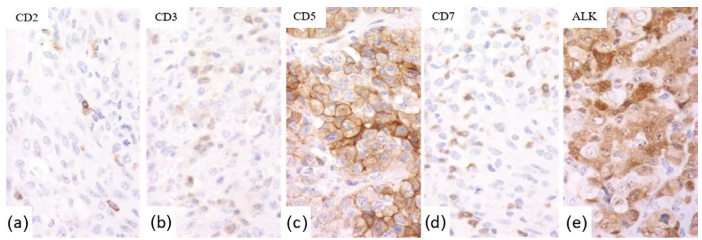 图24.12伴有CD2(a)和CD3(b)异常缺失、CD5(c)阳性、CD7(d)缺失和ALK(e)阳性的ALCL。 图24.12伴有CD2(a)和CD3(b)异常缺失、CD5(c)阳性、CD7(d)缺失和ALK(e)阳性的ALCL。
|
 图24.13 ALCL伴CD45-(a)和ALK+(b)。 图24.13 ALCL伴CD45-(a)和ALK+(b)。
|
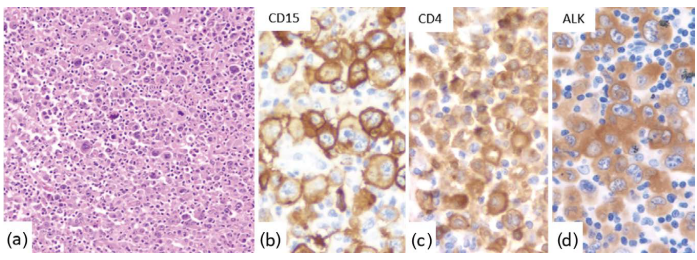 图24.14 CD15异常表达的ALCL。(a)组织学显示多形性淋巴样细胞浸润。肿瘤细胞CD15(b)、CD4(c)和ALK(d,细胞质染色)阳性。 图24.14 CD15异常表达的ALCL。(a)组织学显示多形性淋巴样细胞浸润。肿瘤细胞CD15(b)、CD4(c)和ALK(d,细胞质染色)阳性。
|
②流式细胞术
流式细胞术(FC)可能显示出具有高前向散射和增加侧向散射的细胞簇,这将肿瘤细胞置于CD45上的“单核细胞”或“粒细胞”区域,而不是侧向散射显示(与其他高级别淋巴瘤一样,FC由于肿瘤细胞的选择性丢失,往往低估了肿瘤细胞的数量)。
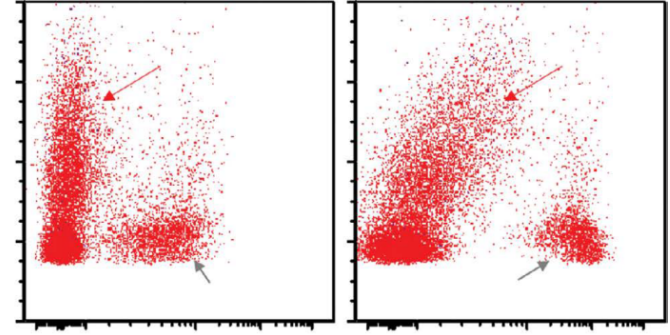
肿瘤细胞通常表现出异常表型,易于通过FC数据识别(图24.15和24.16;表24.1)。
大多数病例显示T细胞标记物异常表达,表面CD3、CD5或TCR缺失。
Juco等人报道的19例FC系列病例中,肿瘤细胞表达CD45、HLA-DR和CD30,表达CD2(71%),CD3(32%),CD4(63%),CD5(26%),CD7(32%),CD8(21%),CD25(88%)。
在Kesler等人报道的一系列病例中(29例),CD4表达最常见(80%),其次是CD2(72%)、CD3(40%)、CD5和CD7(各32%);25例中有23例表达CD45,9例中有7例表达CD13。
FC有助于识别白血病血液受累、体腔(积液)或脑脊液的病例。
在血液或骨髓分析中,FC的敏感性接近NPM-ALK(PCR)的分子检测。
图24.17显示了ALCL白血病血液受累。
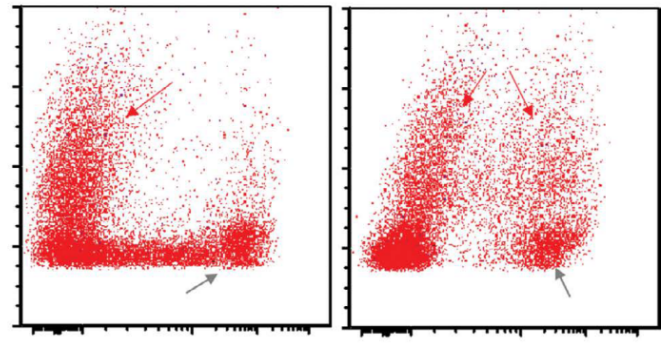
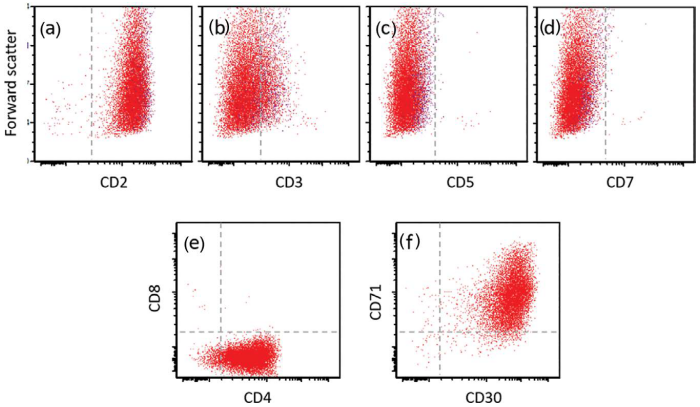 图24.15 ALCL–流式细胞术。淋巴瘤细胞CD2(a)阳性,表面CD3(b)、CD5(c)和CD7(d)阴性,CD4(e)、CD30(f)和CD71(f)阳性。 图24.15 ALCL–流式细胞术。淋巴瘤细胞CD2(a)阳性,表面CD3(b)、CD5(c)和CD7(d)阴性,CD4(e)、CD30(f)和CD71(f)阳性。
|
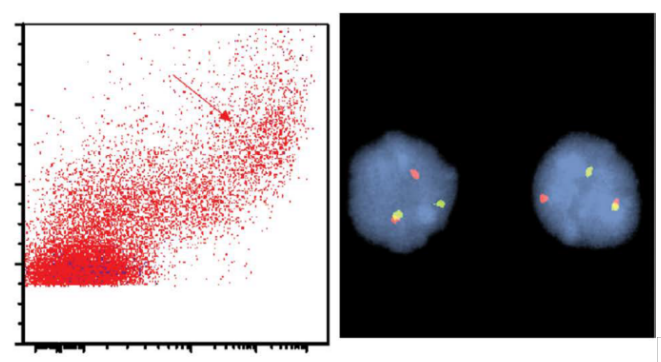
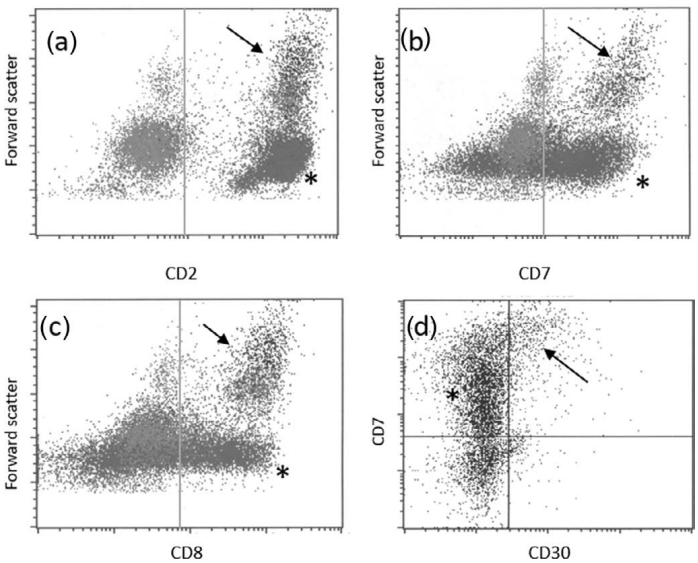 图24.17 ALCL-白血病期(血液受累)。血液流式细胞术显示表达CD2(a)、CD7(b)、CD8(c)和CD30(d)的大细胞群(增加的前向散射;箭头),良性小T细胞(*)CD2、CD7、CD8阳性,CD30阴性。 图24.17 ALCL-白血病期(血液受累)。血液流式细胞术显示表达CD2(a)、CD7(b)、CD8(c)和CD30(d)的大细胞群(增加的前向散射;箭头),良性小T细胞(*)CD2、CD7、CD8阳性,CD30阴性。
|
遗传学特征
ALK+和ALK− ALCL在基因组图谱方面有所不同。最常见的缺失影响TP53基因所在的17p13.3-p12(25%)、含有PRDM1和ATG5的6q21(17%)区域、13q32.3-q33.3和16q23.2(16%)。
超过20%的ALCL显示来自1号染色体长臂不同区域的获得,16%的病例显示8q24.22的获得。
ALK−ALCL中,52%显示PRDM1失活和/或17p缺失(52%),其余48%对这些变化为阴性,在ALK+ACL中,45%显示遗传学异常(除ALK外),其余55%没有额外的遗传变化。
①核仁磷酸蛋白间变性淋巴瘤激酶(NPM-ALK)
t(2;5)在5q35处破坏了核仁磷酸蛋白(NPM)基因,在2p23处破坏了ALK基因,产生了一个新的NPM-ALK融合基因。
ALK(CD246)属于胰岛素受体超家族,在神经发育和肿瘤发生中发挥作用。
NPM-ALK融合导致嵌合mRNA分子和称为p80的独特的80kDa NPM-ALK融合蛋白。
②其他NPM伙伴
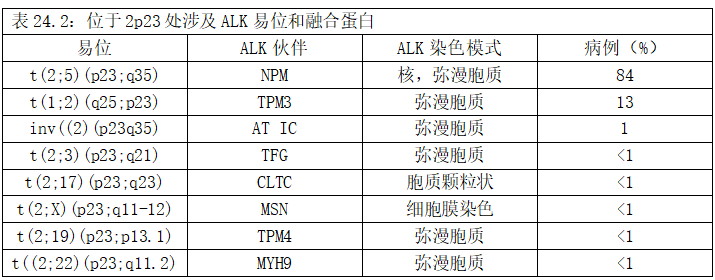
一些细胞遗传学和分子研究表明,t(2;5)(p23;q35)以外的染色体异常可能导致ALCL中的ALK融合(表24.2)。
NPM替代伙伴包括与TPM3(非肌肉原肌球蛋白)、TFG(TRK融合基因)、与CLTC(网格蛋白重链基因)和MSN(膜突蛋白)。
③MYC
MYC过度表达已被证明是ALK+ ALCL中的一个一致发现,MYC基因被认为是ALK信号转导的下游靶点。
④PRDM1
6q21的缺失是ALCL中最常见重现性的病变之一。
它包括PRDM1和ATG3基因。6q21缺失在ALK+ALCL中很少见(3%),在ALK-肿瘤中很常见(35%)。
PRDM1在39%的ALK−ALCL中通过缺失或体细胞突变失活和3%的ALK+ALCL。
6q21的缺失通常与17p(包含TP53基因)缺失同时发生。
⑤其他遗传学改变
儿童ALCL病例通常具有复杂的核型,通常涉及ALK-NPM易位。
ALK+ALCL可携带染色体失衡,包括4q13-q28、6q13q22、11q14-q23和13q缺失以及17p11和17号染色体获得,而ALK−ALCL表现出更复杂的染色体变化,包括1q41、5q、6p、7p、8q和17p获得以及6q21-q22和13q缺失。
ALCL分子分析还显示在9p24.1区域(JAK2、CD274、PDCD1LG2、UHRF和KMD4C)、20q11.2(ASIP、AHYC、ITCH和MIR644)、11p13(APIP、PDXH、CD44)和13q31.3(MIR17HG)获得。
间变性大细胞淋巴瘤的鉴别诊断
ALCL的鉴别诊断(图24.19)取决于肿瘤的位置,包括大细胞造血淋巴和非造血肿瘤,特别是弥漫性大B细胞淋巴瘤(DLBCL)、经典型HL、非特征型外周T细胞淋巴瘤(PTCL)、“灰区”淋巴瘤(大B细胞性淋巴瘤,其特征介于cHL和DLBCL之间),以及一些非造血肿瘤(癌、黑色素瘤或肉瘤)。
ALK阳性表达排除了大多数肿瘤,但ALK+DLBCL除外。表达ALK的非血液淋巴肿瘤包括部分乳腺癌、肺癌、横纹肌肉瘤(腺泡型)、神经母细胞瘤和炎性肌纤维母细胞性肿瘤。


图24.19 ALCL-鉴别诊断。(a)朗格汉斯细胞组织细胞增生症。肿瘤细胞具有丰富的细胞质、特征性核(核沟),CD1a和S100阳性。(b)DLBCL,免疫母细胞型。它可能类似于单形性ALCL,但表达B细胞标记物,包括CD20和PAX5。(c)具有细胞质ALK表达的大B细胞淋巴瘤。这种不寻常的DLBCL亚型CD20呈阴性,并表达CD138、IgA和ALK(细胞质)。(d)恶性黑色素瘤。(e)间变性大细胞癌。(f)血管肉瘤。肿瘤细胞表达血管标志物,ALK呈阴性。(g)组织细胞肉瘤。肿瘤细胞不表达全T抗原、B细胞标记物,并显示CD68(和其他组织细胞标记物)和CD15阳性不一。通过免疫组化和FISH/分子检测,大多数肿瘤现在被诊断为ALCL。(h)滤泡树突状细胞肉瘤。肿瘤细胞CD21阳性。(i)外周T细胞淋巴瘤非特指型(PTCL)。CD30表达不一,但ALK-1是阴性的。(j–l)经典型HL/“灰区”淋巴瘤。(m)间变型浆细胞骨髓瘤。(n)间变型DLBCL。(o)原发性皮肤ALCL。 |
基于形态学的ALCL(ALK+和ALK-)鉴别诊断:
CHL、DLBCL(尤其是有间变特征)、血管内大B细胞淋巴瘤(IVLBL)、原发渗出性淋巴瘤(尤其是实性器官亚型)、原发纵隔B细胞淋巴瘤(PMBL)、外周T细胞淋巴瘤(PTCL)非特指型、介于DLBCL和HL之间的灰区淋巴瘤、肠病相关T细胞淋巴瘤(EATL)、原发性皮肤CD30+T细胞淋巴瘤、非造血肿瘤(癌、肉瘤和黑色素瘤)、组织细胞肉瘤、非典型反应性增生(如EB病毒淋巴结炎)
基于CD30表达的ALCL(ALK+和ALK-)的鉴别诊断:
CHL、DLBCL(尤其是有间变特征)、PMBL、PTCL非特指型、介于DLBCL和HL之间的灰区淋巴瘤、原发性皮肤CD30+T细胞淋巴瘤、EATL、成人T细胞淋巴瘤/白血病
基于ALK表达的ALCL(ALK+和ALK-)的鉴别诊断:
ALK+ DLBCL、罕见的非造血肿瘤(包括炎性肌纤维母细胞瘤、非小细胞肺癌、神经母细胞瘤和横纹肌肉瘤,以及偶见的Spitz肿瘤和Merkel细胞癌)
①反应性疾病
偶尔的反应性淋巴结增生病例(尤其是伴随病毒感染的非典型过程)可能在副皮质区含有大量(活化的)B细胞,即CD30+;用B细胞和T细胞标记物、EBV/EBER进行免疫染色,并仔细分析细胞形态学和组织学(结构)特征,有助于排除ALCL和经典型HL。
②经典型霍奇金淋巴瘤
组织学:在ALCL中,肿瘤细胞通常以黏附片状或窦内模式生长,而在cHL中,肿瘤细胞通常是散在的,很少显示窦内生长模式。
一些形式的cHL,包括结节性硬化cHL的合胞体变体,可能包含肿瘤细胞呈片状或窦内分布。
淋巴细胞消减型cHL显示出霍奇金和R-S样细胞占绝大多数,只有少数淋巴细胞和其他炎症细胞,并且通常存在使肿瘤呈现肉瘤样外观的纤维化。
免疫表型:cHL与ALCL不同之处在于CD45阴性,PAX5+,以及无全T细胞标记物(CD2、CD3、CD5和CD7)和细胞毒性蛋白的表达。
只有少数部分cHL表达T细胞,最常见的是CD2和CD4。
ALK−ALCL不表达包括PAX5在内的B细胞标记物,因此CD20、PAX5和/或CD79a的表达提示cHL。
EBV(EBER)表达最常见于混合细胞和淋巴细胞消减型cHL,排除ALCL。
BCL6阳性染色不能区分cHL和ALCL,因为BCL6可能在两种实体中均表达模糊。
CD15的表达,虽然是cHL的典型表达,但在ALCL中偶尔可见。
先前报道的霍奇金样ALCL最常代表与纵隔“灰区”淋巴瘤密切相关的侵袭性经典型HL。
Vassallo等人报告了10例ALK+ALCL,其结节硬化模式类似结节硬化型cHL。肿瘤细胞CD30(10/10)、ALK(10/10)、EMA(9/9)、CD43(6/9)和穿孔素(8/8)呈阳性,CD15(10/10)、CD20(10/10)、PAX5(6/6)和EBV(8/8)呈阴性。此外,在7例病例中,肿瘤细胞为T型,而其余3例为裸细胞型。
临床表现:临床上,大多数ALCL患者为晚期,伴有外周或腹部淋巴结肿大,通常与结外组织的受累有关,而大多数cHL患者表现为淋巴结肿大,最常见的是颈部、纵隔、锁骨上,和腋窝(cHL的淋巴细胞消减型通常与侵袭性临床过程和包括BM在内的广泛参与有关)。
③非特指型外周T细胞淋巴瘤
主要是ALK- ALCL和表达CD30的外周T细胞淋巴瘤(PTCL)的鉴别诊断(表24.3)。
没有定义很好的标准。
ALK-ALCL中始终可以识别标志性细胞,通常呈片状,但在某些病例,可能散在或稀疏。
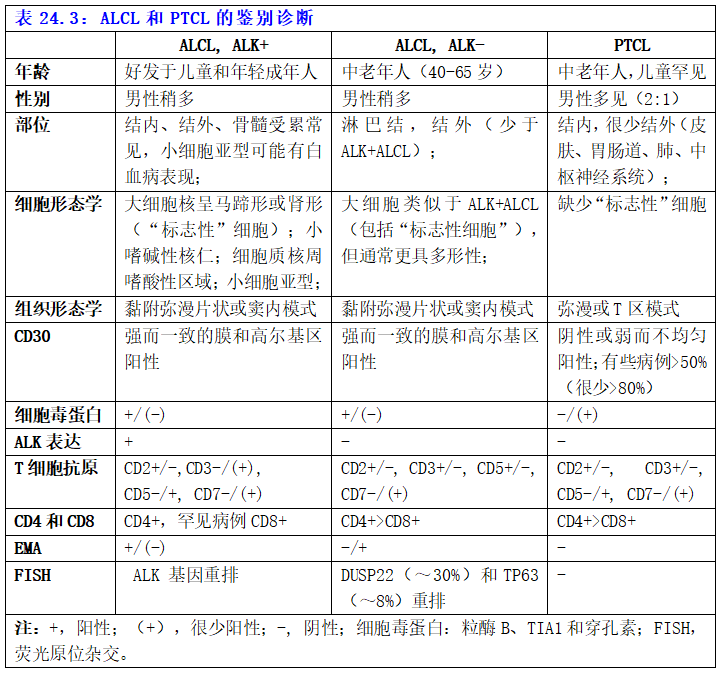
ALK-ALCL和PTCL之间的鉴别更困难。在ALCL中,CD30染色更强、更均匀,具有典型的膜和高尔基区模式,而在PTCL中CD30+较弱且不均匀。
只有小部分PTCL显示CD30强表达(>80%阳性细胞)和均匀表达。
存在具有偏心、马蹄形或肾形细胞核的大细胞,细胞核附近有嗜酸性区域(标志性细胞)支持ALCL。
总的来说,世界卫生组织分类提倡保守的方法,只有当形态和表型都非常接近ALK+病例的形态和表型时,建议诊断ALK-ALCL, 唯一的区别是否存在ALK表达。
④原发性皮肤CD30+T细胞淋巴瘤
原发性皮肤CD30+淋巴瘤,包括原发性皮肤ALCL和淋巴瘤样丘疹病(LyP),表现出膜和高尔基区CD30的强表达。
免疫组化显示大多数皮肤ALCL是ALK阴性。
非常罕见病例可能表现出与ALK重排相关的细胞质ALK表达[除了t(2;5)],但也有偶尔出现胞质和胞核ALK+病例(儿童更常见)。
无论是经典型还是变异型ALK易位,ALK基因FISH“断裂”探针可以识别ALK重排病例。
通常,与临床表现联系对于区分累及皮肤的全身性ALCL、LyP和皮肤ALCL至关重要。
与临床数据(病史、皮肤状况)相关是区分淋巴引流与皮肤ALCL或LyP和系统性ALCL的必要条件。继发性淋巴结累及皮肤CD30+肿瘤和系统性ALCL可能表现为包膜下和窦内浸润。
大约5~10%的LyP病例可能累及淋巴结。
大多数转化蕈样霉菌病(MF)病例中也可见CD30表达。
这些病例通常有MF病史。组织学上,转化的MF表现为大量表达T细胞标记物和CD30的非典型淋巴细胞,一些病例表现为亲表皮性(与MF相比,转化的病例很少表现为Pautrier微脓肿)。
⑤弥漫大B细胞淋巴瘤
部分DLBCL可显示间变性细胞形态和/或表达CD30。B细胞标记物(CD19、CD20和PAX5)的阳性表达和全T细胞抗原表达的缺乏有助于排除ALCL。ALK+DLBCL的特征在于免疫母细胞和/或浆母细胞形态,缺乏常见B细胞标记物(CD20、CD79a、PAX5)的表达,BOB1和OCT2通常阳性,常表达CD45、CD56、CD138、CD43、CD10、IgA和λ。大多数ALK颗粒胞质表达病例有涉及CLTC的t(2;17)(p23;q23)。
⑥肠病相关T细胞淋巴瘤
肠病相关T细胞淋巴瘤(EATL)是ALK- 但部分肿瘤细胞显示CD30表达。EATL阳性表达CD2、CD3和CD7,CD5阴性表达。
⑦非造血肿瘤
具有梭形细胞形态的ALCL需要与肉瘤或低分化梭形细胞癌相鉴别。
(文献来源:Atlas of Differential Diagnosis in Neoplastic Hematopathology,第24章)
——未完待续——

































共0条评论