[导读] 编译整理:强子
CD30阳性的其他类型T细胞淋巴瘤
1. 外周T细胞淋巴瘤-非特殊类型
外周T细胞淋巴瘤是一个排除性诊断,需要排除所有特殊类型的外周T细胞淋巴瘤及伴T滤泡辅助免疫表型的外周T细胞淋巴瘤(如血管免疫母细胞T细胞淋巴瘤)。如果考虑到排除相关病种后,非特殊类型外周T细胞淋巴瘤约占T细胞淋巴瘤的30%。患者一般为成人,男性多见。外周T细胞淋巴瘤总体为侵袭性疾病,预后相对差。相比B细胞淋巴瘤来说,治疗方案也没那么统一。
外周T细胞淋巴瘤的形态学谱系非常宽泛,自显著小细胞、至中等细胞、大细胞等均可。肿瘤细胞越大,表达CD30的几率越大,有时与ALK阴性间变性大细胞淋巴瘤的分界就没那么清晰。其实这也是ALK阴性间变性大细胞淋巴瘤迟迟未能成为单独亚型的原因之一。不过,临床、免疫表型、分子检测都支持非特殊类型外周T细胞淋巴瘤和ALK阴性间变性大细胞淋巴瘤是不同病种。
非特殊类型外周T细胞淋巴瘤患者大部分表现为淋巴结肿大,不过结外受累也很常见。如经典型霍奇金淋巴瘤中一样,常见混合性炎症背景、尤其嗜酸性粒细胞增多。大部分情况下,非特殊类型外周T细胞淋巴瘤对应的正常细胞是活化的CD4阳性外周T细胞。
非特殊类型外周T细胞淋巴瘤中,50%以上的病例中、25%以上的肿瘤细胞表达CD30。由于该病种具有侵袭性,且治疗方案有限,CD30阳性就引发了CD30靶向治疗的研究,主要是结合化疗、骨髓移植或其他类型靶向治疗。2018年,美国FDA批准维布妥昔单抗联合化疗用于此前未经治疗过的系统性间变性大细胞淋巴瘤、外周T细胞淋巴瘤、血管免疫母细胞型T细胞淋巴瘤。
2. 血管免疫母细胞性T细胞淋巴瘤
血管免疫母细胞型T细胞淋巴瘤是最常见的T细胞淋巴瘤,来源于T滤泡辅助细胞。临床一般见于中年及老年人,男性发病率较高。该淋巴瘤主要为淋巴结的病变。患者特征性表现为全身淋巴结肿大,但后续可累及骨髓、皮肤、肝脏及脾脏。
患者临床表现一般较重,伴多种副肿瘤症状。除全身淋巴结肿大外,肝脾肿大、高丙种球蛋白血症、伴瘙痒的皮疹、胸腔积液、关节炎、腹水等都常见。免疫现象则有循环免疫复合物、冷凝集素伴溶血性贫血。可能是由于广泛的副肿瘤临床症状,所以血管免疫母细胞型T细胞淋巴瘤早期的时候很难被认为是恶性淋巴瘤。最初对激素治疗效果好、肿大的淋巴结可有所缓解,更是强化了这一印象。
不过,绝大部分病例中有T细胞受体基因的克隆性重排,约三分之一的病例中有免疫球蛋白重链基因的克隆性重排,支持血管免疫母细胞型T细胞淋巴瘤实际是一种叠加于EBV阳性克隆或非克隆性B细胞增殖之上的侵袭性克隆性T细胞淋巴增殖性疾病。
尽管血管免疫母细胞型T细胞淋巴瘤的形态学具有异质性,但也有少数特征性表现,如显著的分支状增生的高内皮静脉。如其他T细胞淋巴瘤一样,常见组织细胞、浆细胞、嗜酸性粒细胞构成的炎症背景。病变中有散在或小簇状的大细胞,对应EBER阳性的B免疫母细胞。另一个特征是滤泡树状突细胞的广泛增生、超出淋巴滤泡的正常范围。
常规T细胞标记(如CD3、CD2、CD5、CD4)正常表达,混有EBER阳性的B免疫母细胞。也存在更特异性的滤泡T辅助细胞标记,如CD20、BCL-6、PD-1(也称为CD279)、CXCL13、ICOS。
血管免疫母细胞性T细胞淋巴瘤中,可溶性CD30、CD30-mRNA水平升高,且CD30阳性肿瘤细胞数量升高。B细胞标记和T细胞标记双染,证实CD30表达于异常的淋巴瘤型T细胞群、B免疫母细胞,或二者均可表达。14%的病例中会出现50%以上的瘤细胞CD30阳性。
血管免疫母细胞型T细胞淋巴瘤的免疫表型为活化的外周T淋巴细胞,程度不等的表达CD2、CD3、CD5,主要表达CD4而不表达CD8。大部分病例都不表达CD7,这是外周T细胞淋巴瘤中最常见缺失的标记。几乎所有病例都表达CD25(白介素2受体α链)。表达CD30的病例比例不一,这也再次证实血管免疫母细胞型T细胞淋巴瘤是一种外周T细胞淋巴瘤。与间变性大细胞淋巴瘤不同,血管免疫母细胞型T细胞淋巴瘤不表达细胞毒性颗粒蛋白和ALK。
尽管血管免疫母细胞型T细胞淋巴瘤非常少见,但其侵袭性仍使得我们将其视为CD30靶向治疗的病种之一。
血管免疫母细胞性T细胞淋巴瘤的总体预后不佳,但最近FDA批准的维布妥昔单抗治疗可能会改善生存,已有研究显示出这一点。
3. 成人T细胞白血病/淋巴瘤
成人T细胞白血病/淋巴瘤的特点是存在人T细胞白血病病毒(human T-cell leukemia virus,HTLV);当然,并非所有的HTLV携带者都会发生该肿瘤。该肿瘤此前又称为日本T细胞白血病,不过也流行于其他地区,如加勒比海、中非。
该病种临床表现变化显著,但总体仍是一个侵袭性疾病,伴显著白细胞增多,且一般有淋巴结肿大(急性型)。形态学特征为高度非典型的瘤细胞、伴细胞核多形性,同时有特征性的三叶草状细胞核。不过,也有惰性型或冒烟型(smoldering type)的报道。
尽管该病种的临床表现宽泛,但有两项表现很突出:高钙血症、皮肤受累。高钙血症伴有显著的破骨活性,但这是副肿瘤症状,而不是肿瘤细胞本身具有溶骨活性。50%以上的病例具有皮肤受累,具体如表皮、真皮、皮下组织。
4. CD30阳性肠道T细胞淋巴瘤
2017年版世界卫生组织分类著作中,将肠道原发的T细胞淋巴瘤分为肠病相关T细胞淋巴瘤、单型性亲上皮性肠道T细胞淋巴瘤、非特殊类型的肠道T细胞淋巴瘤、胃肠道惰性T细胞淋巴增生性疾病;其中仅肠病相关T细胞淋巴瘤总是会表达CD30。
尽管肠病相关T细胞淋巴瘤的形态学具有显著异质性,但大部分病例的瘤细胞均为大而间变性表现,且常有血管侵犯及以血管为中心的特征。典型的肠病相关T细胞淋巴瘤免疫组化表达CD3、CD7而不表达CD5、CD4,CD8的表达情况不一。如间变性大细胞淋巴瘤一样,瘤细胞表达细胞毒性颗粒蛋白(如TIA、穿孔素、颗粒酶B)。
肠病相关T细胞淋巴瘤最特异性的标记是CD103,该指标可视为上皮内淋巴细胞沿着胃肠道黏膜表面及呼吸道黏膜表面归巢的受体。有趣的是,完全无关的B细胞肿瘤-毛细胞白血病也总是表达CD103。由于CD103表达于胃肠道的大部分上皮内淋巴细胞,因此推测这些细胞是肠病相关T细胞淋巴瘤对应的正常细胞是合理的。肿瘤细胞体积越大、间变性表现越显著,则表达CD30的可能性越大。
图1. 累及空肠近端的一例肠病相关T细胞淋巴瘤。(A)空肠被实性片状的较大、多形性淋巴细胞破坏,瘤细胞累及肠壁全层。(B、C)瘤细胞具有显著亲上皮性(即显著浸润上方的上皮)。
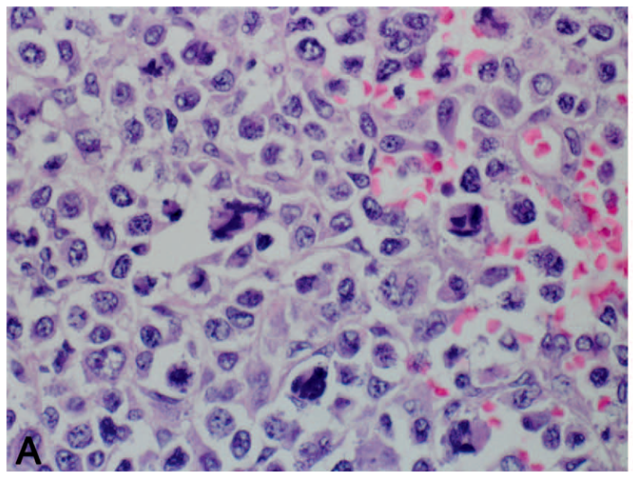
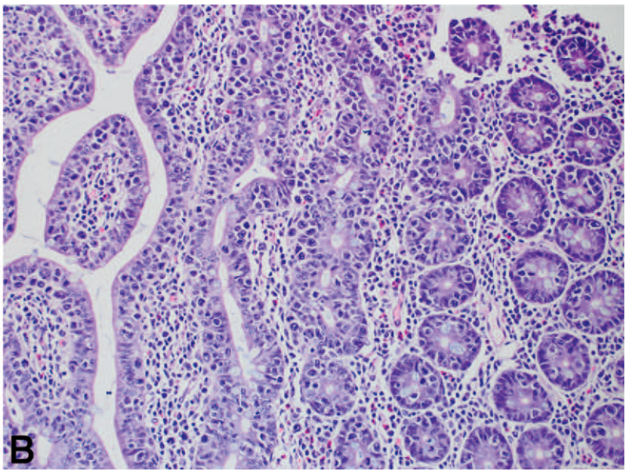
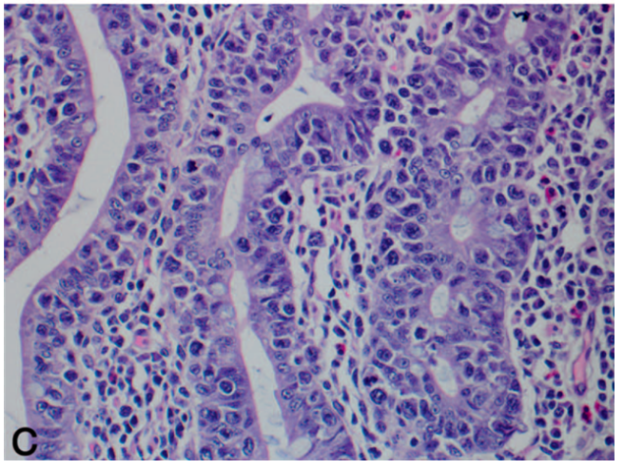
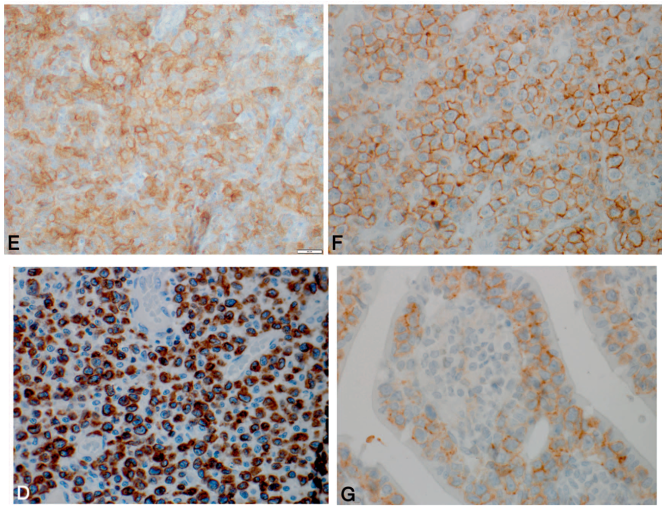
图2. 肠病相关T细胞淋巴瘤免疫组化:瘤细胞弥漫阳性表达CD30(左上)、CD56(右上)、CD3(左下),CD103阳性(右下,示上皮内的瘤细胞),也表达CD7、CD43(未示);不表达CD4、CD5、CD8、CD20、PAX8、ALK1,Ki-67增殖指数60%-80%。
肠病相关T细胞淋巴瘤极为罕见,长期以来被视为组织细胞来源,因此曾被称为肠道恶性组织细胞增生症。后来免疫表型及T细胞受体基因重排检测证实,几乎所有这类病变都是外周T细胞淋巴瘤的一种新类型而已。
顾名思义,肠病相关T细胞淋巴瘤与乳糜泻有关,临床多见于欧洲的老年患者。绝大部分病例发生于小肠,主要见于空肠和回肠。不过,也有胃部受累的罕见病例报道。本文原作者表示他们曾遇到一例CD30阳性、CD103阳性、CD4阳性、CD8阳性的胃部原发T细胞淋巴瘤,且20年前也遇到过类似病例。随着病变的进展,非肠道部位也可受累,如腹腔内淋巴结、纵隔淋巴结、肝脏、皮肤,偶有中枢神经系统受累的情况。
图3. 一例胃部原发的肠病相关T细胞淋巴瘤罕见病例:(A)胃黏膜及黏膜下被片状的非典型、大淋巴细胞完全破坏;(B)弥漫性浸润的淋巴细胞具有大量核分裂及显著凋亡。
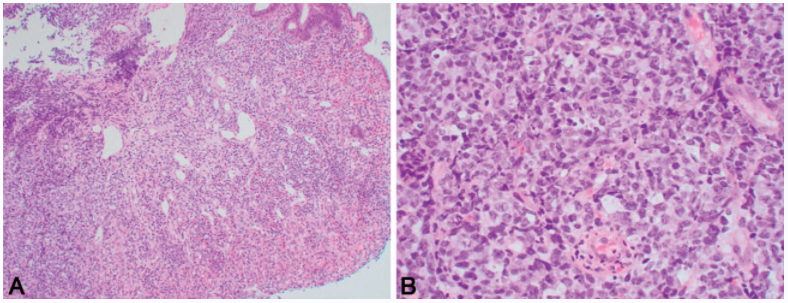
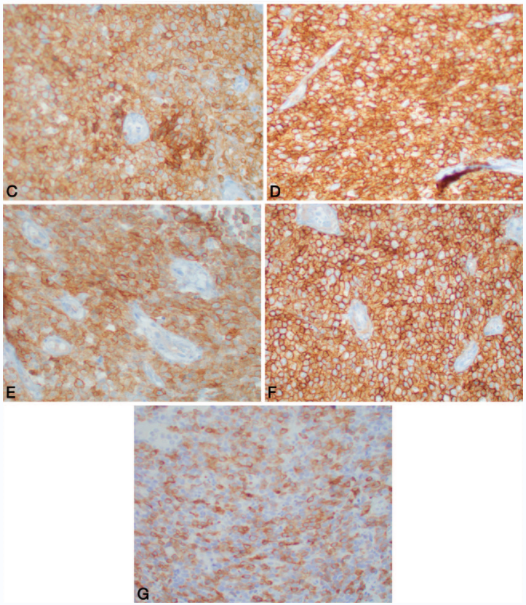
图4. 图3中病例免疫组化:瘤细胞弥漫、强阳性表达CD3(左上)、CD4(右上)、CD30(左中)、CD8(右中)、CD103(下)。
肠病相关T细胞淋巴瘤的总体预后较差,据报道以月计。治疗上有多药化疗、自体干细胞移植。有了CD30靶向治疗之后,可能可以显著改善这一侵袭性淋巴瘤的预后。
未完待续
往期回顾:
CD30阳性淋巴增殖性疾病及CD30靶向治疗(一)
CD30阳性淋巴增殖性疾病及CD30靶向治疗(二)
CD30阳性淋巴增殖性疾病及CD30靶向治疗(三)
点此下载原文
参考文献
Schwarting R, Behling E, Allen A, Arguello-Guerra V, Budak-Alpdogan T. CD30+ Lymphoproliferative Disorders as Potential Candidates for CD30-Targeted Therapies. Arch Pathol Lab Med. 2022;146(4):415-432.
doi:10.5858/arpa.2021-0338-RA



















共0条评论