[导读] 译者:慧海拾穗
【前言】
横纹肌肉瘤(RMS)是一种骨骼肌分化的恶性间叶性肿瘤。WHO目前将RMS分为胚胎型、腺泡型、多形型和梭形细胞/硬化型。然而,分子生物学的最新进展使这一认识得到进一步完善,进而鉴定出其他不同类型的RMS,包括罕见的FUS-TFCP2或EWSR1-TFCP2融合RMS。这些肿瘤典型地表现为单一的梭形细胞向上皮样细胞增生转化,具有明显的骨转移倾向,并且通常具有极强的侵袭性。我们报告了2例上皮样和梭形细胞RMS(ESRMS)伴FUS/EWSR1-TFCP2融合的病例,并讨论了其对分类、鉴别诊断和治疗的意义。
【病例报道】
病例1:患者,女性,23岁。6周前出现头部快速生长的包块伴头痛。病灶质硬活动性差,MRI显示右侧额骨中央坏死,破坏性损伤伴有皮质破裂,大小为5×4.6×4厘米。病变移位硬脑膜和下方的大脑,硬脑膜增厚和增强,但没有任何结节或破裂(图1左上)。无远处转移。行切口活检后,患者开始接受长春新碱、阿霉素和环磷酰胺(VDC)化疗。经过3个周期的VDC后,肿瘤的大小在临床和影像学上均无明显变化。根据多学科讨论后增加了放疗。患者共接受了28次50.4 Gy的治疗,并接受了2个周期的长春新碱和环磷酰胺(阿霉素未包括在内)。放化疗结束后,肿块缩小到4.8×3.3×3 cm。因此,我们采用右侧额叶开颅钛网颅骨成形术切除肿瘤。不幸的是,患者术后出现伤口裂开并感染,需要长时间的抗生素治疗,并在接下来的4个月里返回手术室,包括两次桡侧皮瓣重建。这些并发症妨碍了辅助化疗的安全应用。诊断后8个月影像学检查显示右侧髋臼和左侧髂骨有新的溶解性和硬化性混合病变。这名患者的骨骼和肺部继续出现渐进性疾病,最终在确诊17个月后死于疾病。
在初次活检中,肿瘤表现为双相外观,在黏液胶原间质中交替出现温和梭形细胞的低密度细胞区,以及梭形细胞到上皮样细胞的高密度细胞聚集(图右上)。肿瘤细胞含有中量嗜双色到淡嗜酸性细胞质,细胞核位于一侧。细胞核大小不一,形状不规则,散在多叶状。染色质细小且分散均匀;核仁不明显(图1左中)。核分裂象高(>20个/10HPF),肿瘤坏死不明显。免疫组化结果显示,肿瘤广泛弥漫表达AE1/AE3(图1右中),局灶表达desmin(图1左下),myogenin、S100蛋白和SMA均为阴性。重复免疫组化也未能在较深的组织切片中发现desmin阳性,肿瘤MYF4也为阴性。然而,肿瘤细胞ALK斑片状胞质阳性(图1右下)和CK7,并伴有局灶SMA、弱PAX8和局灶可疑p63和TTF1表达。其他免疫标记物包括CK20、CK5、calponin、SOX10、HMB45、CD34和ERG等均为阴性H3K27三甲基化和INI-1表达被保留。测序检测显示EWSR1-TFCP2基因融合。治疗后,切除肿瘤的形态与之前活检所见相似。肿瘤广泛坏死,散在细胞,伴有治疗相关的退行性改变。明显可行的区域显示梭形细胞增加和低的核分裂象(2个/10HPF)。 Desmin仍为阴性。
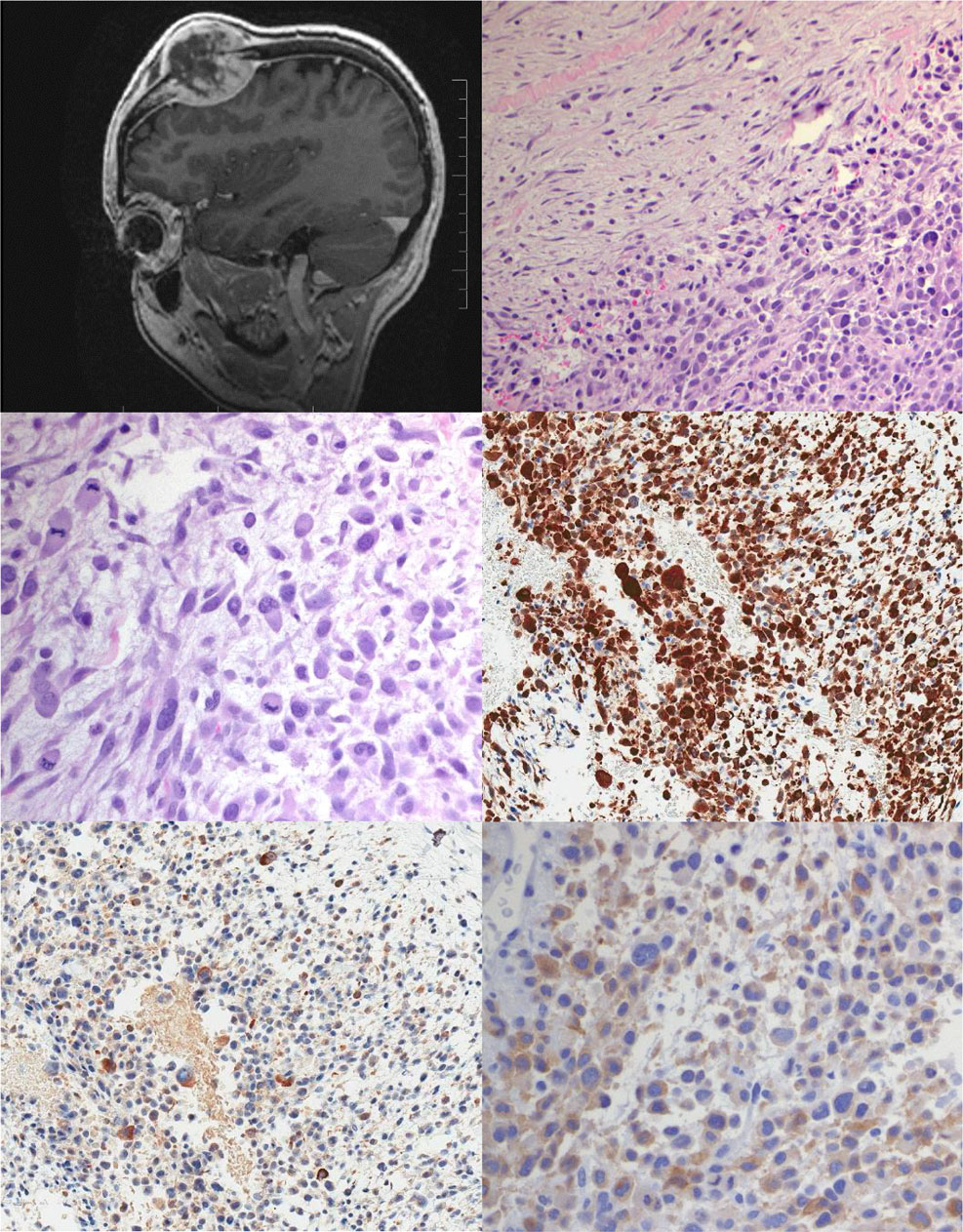
图1:T2矢状位MRI显示额骨大面积破坏并累及软组织(左上)。在黏液胶原间质中见相对温和的梭形细胞交替的低密度区和梭形到上皮样细胞高密度区(右上)。肿瘤细胞胞质嗜双色。偏位的细胞核大小不一,轮廓不规则,可见核分裂象(左中)。免疫组化显示肿瘤细胞AE1/AE3呈弥漫阳性(右中),desmin局灶阳性(左下),ALK1呈斑片状胞质阳性(右下)。
病例2:患者,女性,20岁,有5个月的左侧骨盆疼痛史。平片显示以左骶髂关节为中心的硬化症被怀疑为骶髂炎。一个月后MRI显示9.5cm的破坏性肿块,伴有中央坏死和软组织侵犯(图2左上)。肿瘤累及左后髂、髋臼顶、骶髂关节和左骶翼。臀中肌多发卫星结节,右侧髋臼上髂骨和右侧髂后骨有骨髓置换病变。分段CT扫描和执行FDG-PET扫描1月后,立即开始治疗之前,显示多个肺结节和溶解病变在L3、L4椎体与转移性疾病一致,一个门脉周围淋巴结代谢亢进,并增加肿瘤大小13.6厘米。开始对高危RMS进行多药化疗(异环磷酰胺、伊立替康、长春新碱、依托泊苷、阿霉素、环磷酰胺和放线菌霉素)。在开始治疗2个月后的FDG-PET扫描中,发现了显著的反应,肿瘤总体负担降低,最需要FDG的病变的最大标准摄取值(SUV)降低了63%。3个月后,她继续化疗并重复FDG-PET显示肿瘤大小稳定,转移病灶有完全的代谢反应,但左侧髂肿瘤部分摄取增加,导致进展。在那个时候,她接受了原发部位的放疗,并在放疗期间继续用长春新碱和伊立替康进行化疗。放疗后,她继续采用高风险的RMS方案进行化疗,3个月后重新扫描显示转移病灶总体大小稳定,包括左髂原发病灶在内的部分部位有所改善。不幸的是,尽管继续化疗,3个月后重新扫描显示疾病进展,伴有新的和扩大的肺转移,肝转移,臀软组织结节,和恶化的骨转移疾病。她开始接受替莫司、长春瑞滨和环磷酰胺的抢救治疗。然而,她继续快速进展,并在确诊11个月后的6周后去世。
治疗前活检显示肿瘤富于细胞呈片状和圆形、上皮样、横纹肌样和胖梭形细胞呈束状分布,胞质嗜酸性(图2右上)。细胞核从具有明显核仁的空泡状到深染。低密度细胞区可见黏液胶原间质。可见散在增大的细胞,常有丰富的嗜酸性胞质和多核(图2左中);然而,没有发现横纹。核分裂象活跃(25个/10HPF),肿瘤坏死明显。免疫组化结果显示,肿瘤细胞desmin(图2右中)、MyoD1(图2右中插图)、myogenin(散在细胞)、ALK1(图2左下)、SMA(局灶)、vimentin均阳性,caldesmon、S100蛋白均阴性。荧光原位杂交检测结果显示FUS基因重排阳性。RNAseq分析证实了FUS-TFCP2融合的存在。尸检的组织切片证实转移扩散到甲状腺,胸膜,肺,肝,右肾上腺和椎骨。与原发灶相比,转移灶具有类似的形态,除了更弥漫的梭形细胞形态和束状排列,包括鱼骨样排列(图2右下)。

图2:T2 MRI显示累及骨盆的巨大破坏性病变,伴有广泛的软组织延伸(图2左上)。梭形细胞束状排列,胞核呈卵形至细长,胞质呈淡染至嗜双色(图2右上)。片状圆形或卵形细胞,细胞核增大,深染。可见散在细胞中有丰富的嗜酸性胞质和罕见的横纹样细胞(图2左中)。免疫组化显示肿瘤细胞desmin(图2右中)、MyoD1(图2右中插图)和ALK1 (图2左下)均呈强阳性。尸检结果显示多数肿瘤细胞呈束状梭形细胞模式,包括鱼骨样排列(图2右下)。
【讨 论】
① 临床特征:FUS-TFCP2或EWSR1-TFCP2基因融合的上皮样和梭形细胞RMS(ESRMS)是一个新的类型,不同于之前描述的RMS类型。Watson等人在184例小圆细胞肉瘤的RNA测序研究中发现了前三个病例。迄今为止,仅报告了23例。女性居多(2.7:1),多数患者年龄为30~40岁,但年龄范围较广(11~86岁)。肿瘤的中位大小为5.5 cm(范围3.4~13.6 cm),通常累及骨骼,尤其是颅面骨,其次是骨盆和股骨。骨性肿瘤影像学上常表现为软组织扩张的侵袭性特征。只有两例骨外肿瘤,分别累及腹膜和腹股沟区。症状因部位而异,但通常表现为疼痛或不适。伴有EWSR1/FUS-TFCP2融合的ESRMS是高度侵袭性肿瘤。本报告中的两例患者均积极接受了放化疗治疗,但均在诊断后17个月内发生进展性转移,患者2出现远处转移,患者1在诊断后8个月内出现转移。包括目前的病例,在报道的随访患者中中位存活时间15个月,51%的患者存活1年,且仅5例无病生存(平均随访10个月,范围2~108个月)。在死于疾病的病人中,8例已经转移到肺部和/或骨骼。
② 组织形态学:ESRMS由梭形、圆形、横纹肌样和上皮样细胞呈片状和束状排列,胞质中等量嗜酸性。大多数病例表现出混合特征,但每种细胞的相对比例不一,肿瘤可能由单一细胞形态的细胞组成。横纹肌母细胞很少见。细胞核呈圆形、卵圆形或梭形,核仁明显,典型的多形性极小。如病例2所示,部分病例表现为细胞核染色加深和更明显的核大小和形状变化。此外,可见散在的多核细胞和胞质丰富的嗜酸性细胞。核分裂象通常很活跃,尽管少数病例显示低核分裂象。通常有坏死。间质通常不明显,可以看到纤维状、黏液液样和透明背景。值得注意的是,两例患者化疗后梭形细胞形态明显增加。
③ 免疫表型:包括当前病例,ESRMS大部分表达desmin(24/25例)、MyoD1(24/24例)和myogenin(21/ 24例)。染色程度不一,MyoD1通常是弥漫表达,而myogenin通常是局灶表达。常有panCK(21/23例)和ALK(23/25例)的表达。S100蛋白可局灶阳性或很少弥漫性,而SOX10蛋白呈阴性。5例中有3例表达SMA, 13例中有1例表达caldesmon。
④ 分子遗传学特征:EWSR1或FUS与TFCP2基因融合是该肿瘤的特征。转录因子细胞启动子2(Transcription factor cellular promoter 2, TFCP2),又称CP2,晚期猿猴病毒40因子(late simian virus 40 factor, LSF),或主要结合蛋白1c (leader binding protein1c, LBP1C),编码一种广泛表达的转录因子,参与细胞存活、DNA合成和细胞周期进程。TFCP2在肝细胞癌、口腔鳞状细胞癌、大肠癌、胰腺癌、宫颈癌中表达上调,而在黑色素瘤中表达下调。TFCP2在与EWSR1/FUS-TFCP2融合相关的ESRMS中过表达,但其在肿瘤发生中的作用的分子机制仍有待阐明。此外,虽然EWSR1/FUS-TFCP2融合极有可能驱动多能间充质干细胞向横纹肌母细胞分化,但可能骨骼肌细胞程序在细胞起源中已经活跃。需要进一步研究来区分这些可能性。值得注意的是,像ALK表达的血管瘤样纤维组织细胞瘤一样,ESRMS显示ALK表达,但没有潜在的ALK重排。矛盾的是,虽然ALK不存在重排,但在某些病例中检测到ALK缺失,且ALK转录本上调至少与ALK重排的炎性肌成纤维细胞瘤和ALK重排的Spitz痣中一样高。在这些肿瘤中报道的其他分子改变包括1p和3p的染色体碎裂(chromothripsis),TERT的过表达,CDKN2A纯合子缺失,以及缺乏MyoD1外显子1突变。
⑤ 鉴别诊断:骨ESRMS的诊断具有很大的挑战性,其鉴别诊断包括高级别骨肉瘤、间叶性软骨肉瘤、去分化软骨肉瘤、平滑肌肉瘤、假肌源性/上皮样肉瘤样血管内皮瘤和转移性肉瘤样癌。高级别骨肉瘤通常比ESRMS表现出更大的多形性,并显示组织学或x线证据显示骨质沉积。特别是在缺乏软骨成分的小活检中,间叶性软骨肉瘤可以在组织学上类似ESRMS,并表达desmin, myogenin和MyoD1。在这种模棱两可的病例中,对EWSR1/FUS-TFCP2或HEY1-NCOA2融合证据的分子分析可能有助于确定诊断。去分化软骨肉瘤的横纹肌肉瘤成分不常见,可以通过鉴别更大程度的多形性、中低级别软骨肉瘤的小叶和软骨样基质的x线证据从ESRMS中分离出来。ESRMS和平滑肌肉瘤之间有明显的形态重叠,两者都显示梭形细胞束状生长,胞质嗜酸性。然而,平滑肌肉瘤通常表现出更大的多形性,ESRMS可能表达SMA,很少表达caldesmon,平滑肌肉瘤不表达myogenin或MyoD1。假肌源性/上皮样肉瘤样血管内皮瘤和ESRMS均可由相对温和的上皮样细胞和梭形细胞组成,胞质嗜酸性,且强表达细胞角蛋白AE1/AE3;然而,假肌源性/上皮样肉瘤样血管内皮瘤常表现为低核分裂象、多灶性、中性粒细胞浸润、胞质丰富、间质明显、ERG、FLI-1和CD31阳性,而不表达desmin。最后,转移性肉瘤样癌是一个重要的诊断陷阱,特别是对于老年患者。肉瘤样癌常表现角蛋白表达,并可能有横纹肌母细胞成分;然而,它通常以明显的核异型性为特征。此外,影像学表现或病史的相关性常显示有很大的骨外原发性肿瘤。值得注意的是,病例1显示了角蛋白和PAX8的表达,不表达desmin或myogenin,这可能误诊为转移性肉瘤样癌,特别是肾或苗勒氏(Mullerian)起源的转移性肉瘤。ESRMS也应与其他具有梭形细胞或上皮样形态的横纹肌肉瘤类型相区别。与NCOA2和/或VGLL2重排相关的先天性/婴幼儿梭形细胞RMS由单一的梭形细胞组成;然而,他们胞质稀少,明显好发于躯干软组织,患者年龄小于1岁。与MYOD1 L122R外显子1突变相关的梭形细胞/硬化性横纹肌肉瘤,特别是纯梭形细胞模式的梭形细胞/硬化性横纹肌肉瘤与ESRMS有显著的组织学重叠;然而,MYOD1突变的横纹肌肉瘤很少发生于骨。在诊断困难的病例中,分析EWSR1/FUS-TFCP2融合或MYOD1突变的证据是有帮助的,特别是当ESRMS不包含MYOD1外显子1突变。最近报道了2例与MEIS-NCOA2融合相关的骨内横纹肌肉瘤,其特征为胞质稀少的原始梭形细胞束状增生,无ALK和角蛋白表达。胚胎型横纹肌肉瘤(ERMS)的典型特征是细胞多样性,黏液样间质,缺乏广泛的束状生长,原始细胞呈圆形或梭形,更明显的横纹肌细胞分化。ALK表达的存在并不能区分胚胎型横纹肌肉瘤(或腺泡状横纹肌肉瘤)和ESRMS。此外,胚胎型横纹肌肉瘤通常发生于10岁以内儿童。虽然罕见的ESRMS表现为纯上皮样,但上皮样横纹肌肉瘤通常发生在深部软组织,不表现出明显的角蛋白表达,也不含有TFCP2重排列。特别是要考虑到罕见的骨外ESRMS的报道,其鉴别诊断包括恶性周围神经鞘瘤、炎性肌纤维母细胞性肿瘤、梭形和圆形细胞肉瘤伴EWSR1-PATZ1融合。梭形细胞形态和S100蛋白的局部表达可能引起人们对恶性周围神经鞘瘤的关注。此外,恶性周围神经鞘瘤中异源横纹肌肉瘤分化并不少见,而且可能广泛到模糊了典型的组织学特征。H3K27me3可能是有益的,因为缺失不会出现在ESRMS;然而,迄今为止,只有1例ESRMS染色(病例1显示保留表达)。此外,ESRMS不表达SOX10,恶性周围神经鞘瘤不存在TFCP2重排,包括恶性蝾螈瘤。少见ESRMS表现为炎症浸润,结合胖梭形细胞形态及ALK表达可类似于炎性肌纤维母细胞性肿瘤。然而,炎性肌纤维母细胞性肿瘤不表达MyoD1或myogenin。EWSR1-PATZ1融合的梭形细胞和圆形细胞肉瘤与ESRMS表现出组织学和免疫组化重叠,包括MyoD1和myogenin表达,两种肿瘤均存在EWSR1重排。与ESRMS相比,这些EWSR1-PATZ1相关的肉瘤以瘤内致密纤维间质和更明显的圆形细胞形态为特征。
⑥ 治疗及预后:ESRMS的免疫组化和分子发现提供了几种潜在的化疗方法。ALK过表达提示ALK抑制剂可能有效;然而数据有限,结果不一。1例患者在常规化疗进展后稳定了15个月,而1例克唑替尼患者在短时间后发生转移性疾病进展和死亡。小分子抑制剂可能能够靶向TFCP2。喹啉酮因子抑制剂1 (Factor quinolinone inhibitor 1, FQI1)干扰TFCP2 DNA结合,抑制小鼠肝细胞癌异种移植瘤生长;然而,目前还没有直接数据表明该方法在ESRMS中的潜在效用。总之,我们报告了两例ESRMS的临床、病理和分子结果。这是一个非常罕见的肿瘤显示一个明显的骨骼偏好和侵袭性的临床过程。应小心区分ESRMS和类似肿瘤,因为识别对预后和治疗很重要,包括潜在的未来靶向治疗。
【参考文献】
[1] Epithelioid and spindle cell rhabdomyosarcoma with FUS-TFCP2 or EWSR1-TFCP2 fusion: report of two cases.Virchows Arch,2020,477:725-732.















共0条评论