[导读] 编译整理:强子
从精原细胞瘤形态学出发解读睾丸生殖细胞肿瘤(一)
从精原细胞瘤形态学出发解读睾丸生殖细胞肿瘤(二)
从精原细胞瘤形态学出发解读睾丸生殖细胞肿瘤(三)
化疗后切除的(转移性病变)标本中,常见畸胎瘤。本文作者认为这是原始生殖细胞肿瘤中分化型成分(如精原细胞瘤、胚胎性癌、卵黄囊瘤等)转移而来,而不是睾丸畸胎瘤的直接播散。由于这种情况下的畸胎瘤来源于原始生殖细胞肿瘤中的分化型成分,常具有细胞学的异型性,因此不能仅凭畸胎瘤中细胞学的异型性而诊断为体细胞性恶性肿瘤,而是要根据有无间质的破坏性浸润、或单一的异型性上皮或间质成分超过了一个4倍物镜下的视野来做出诊断。这一结果对原始神经外胚层肿瘤、高级别肉瘤(最多见为胚胎性横纹肌肉瘤)来说具有预后意义,但如可以完整切除则无治疗意义。高分化、但却明显为过度生长的骨骼肌成分(横纹肌瘤样肿瘤)者切除后预后较好,和一般的转移性畸胎瘤相似。

▲图20. 化疗后切除的转移性病变中,畸胎瘤成分常呈显著异型性并伴显著核分裂。

▲图21 高分化骨骼肌成分形成的结节,无核分裂,无原始细胞成分,代表了横纹肌瘤样肿瘤。
化疗后切除标本中可出现具有多形性、广泛散在的滋养细胞,可单个、也可呈小簇状,但这一现象并不多见。多数情况下染色质致密、深染,但本文作者并不认为切除后还需进一步治疗。按照本文作者意见,对放疗后相关标本进行评估时,病理医师一定要问一下自己,“如该患者因为我的镜下所见而接受进一步、大剂量的化疗并行骨髓移植,是否有更多获益?此次切除手术或仅随访是否更好?”
放疗后切除标本中偶见体细胞性恶性肿瘤,最常见的为腺癌、胚胎性横纹肌肉瘤、中枢性原始神经外胚层肿瘤。如治疗后多年才出现,则类似新发的肿瘤。这种情况下的腺癌多表现为肠型,免疫组化CK7阴性、CK20和CDX2阳性。这种情况下肿瘤一般出现于睾丸生殖细胞肿瘤常见的转移部位,如腹膜后、纵膈、左锁骨上窝,因此可能有助于和新发恶性肿瘤的鉴别。此外,至少对于胚胎性横纹肌肉瘤、中枢性原神经外胚层肿瘤来说,其发生年龄与常规情况下的好发年龄不同。大部分情况下通过临床相关信息即可做出鉴别,其余则需加做相关检查,比如此前有过生殖细胞肿瘤病史、目前肝脏出现肠型腺癌者;同时需进行内镜等相关检查,分子生物学方面有染色体12p的扩增则表明是生殖细胞来源的体细胞性恶性肿瘤。
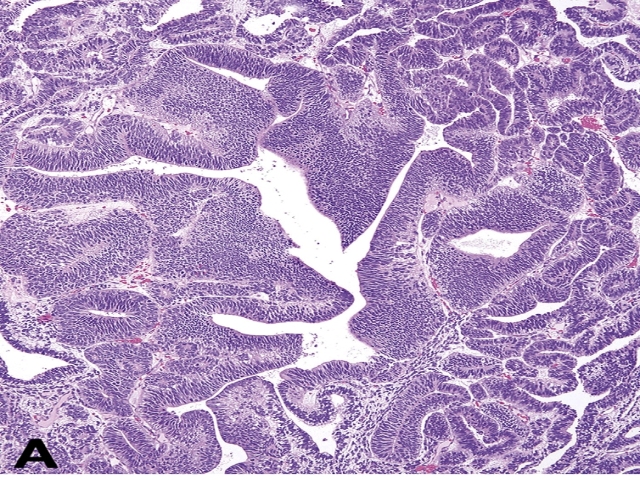
▲图22. 中枢性原神经外胚层肿瘤,表现为复层肿瘤细胞形成的小管状结构,周围成分可见过度生长。
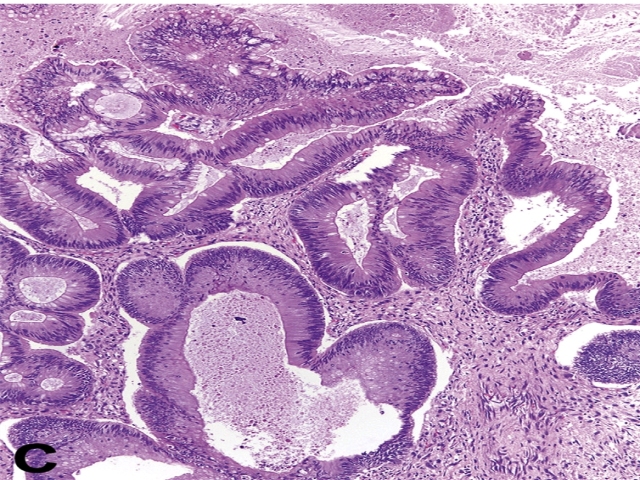
▲图23. 源自生殖细胞肿瘤的腺癌,仅凭形态学与结直肠腺癌无法区别。
化疗后切除标本中还有个问题,即纯粹为腺性表现的恶性肿瘤是体细胞性腺癌、还是腺样卵黄囊瘤。光镜下这二者有一定重叠,但腺样卵黄囊瘤相比体细胞性腺癌来说,更多见表现为内胚窦样形态,伴核下空泡、并偶见核上空泡。这种情况下,本文作者会进行一组包括glypican 3、AFP、CK7、EMA在内的免疫组化检测:腺样卵黄囊瘤一般表达glypican 3、AFP而不表达CK7、EMA,体细胞性腺癌恰好相反。当然,这一鉴别在治疗上也有一定意义:化疗后出现的腺样卵黄囊瘤手术切除即可,无需进一步实施针对生殖细胞肿瘤的化疗。
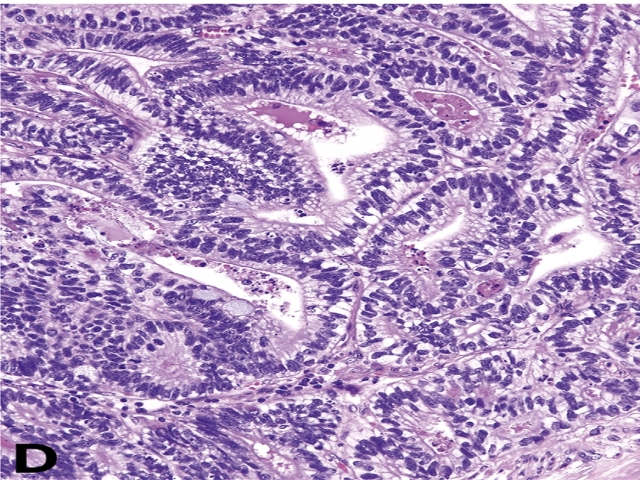
▲图24. 腺样卵黄囊瘤,可见内胚窦样结构,胞质内可见核上及核下空泡。
化疗后标本中,卵黄囊瘤梭形细胞成分进展而来的肉瘤样肿瘤有时很难分类。这种情况下一般并无特异性间质分化方向,除梭形细胞成分外还会有上皮细胞;可呈结节样生长,背景为程度不等的胶原或黏液。这种情况可出现于睾丸生殖细胞肿瘤确诊后数月内,但大部分情况为睾丸切除及化疗后数年。免疫组化共表达AE1/AE3、glypican 3,不表达AFP,血清AFP水平也并无升高。需要注意的是,这一免疫组化结果与原发卵黄囊瘤中的梭形细胞成分相似,也更支持这类情况是来源于卵黄囊瘤梭形细胞成分的进展。此时所述的“纤维化”也很常见。治疗方案为可能的情况下手术切除;对生殖细胞肿瘤相关化疗方案并不敏感。患者常表现为多次手术、多次复发,大部分会死于肿瘤进展,但临床病程可能很长。
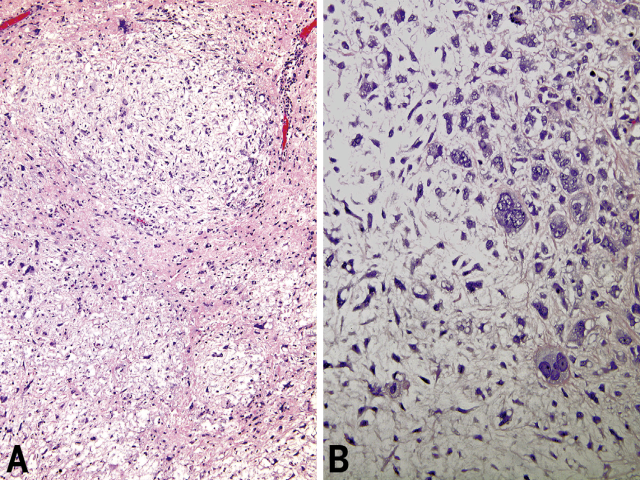
▲图25. (左)肉瘤样卵黄囊瘤,细胞中等密度,呈模糊结节状,间质为黏液样,伴非典型梭形细胞及卫星状细胞。(右)同一肿瘤的其他区域可见高度异型的上皮样肿瘤细胞。
全文完
点击下载英文文献
参考文献
Pitfalls in the interpretation of specimens from patients with testicular tumours, with an emphasis on variant morphologies[J].Pathology,2018,50(1):88-99.
DOI:10.1016/j.pathol.2017.07.013



















共0条评论