[导读] 编译整理:强子
非小细胞肺癌诊断及预测性免疫组化指标概览(一)
NSCLC中“必须检测”的预测性标志物
1. 间变性淋巴瘤激酶
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)最初研究是在间变性大细胞淋巴瘤,但目前ALK基因重排已见于多种上皮性、间皮性、间叶性肿瘤。肺腺癌中约5%具有ALK重排,最常见为EML4-ALK融合,与其他基因的融合相对少见。NSCLC中ALK阳性者多见于年轻的非吸烟患者,组织学几乎全部为腺癌,常伴实性结构及印戒样细胞。
美国已批准ALK抑制剂克唑替尼(crizotinib)、艾乐替尼(alectinib)用于一线治疗,一线治疗耐药后也有多种新型ALK抑制剂尚可应用,因此目前ALK靶向治疗已成为ALK重排肺癌患者的标准治疗方案。正是由于ALK靶向治疗的临床效果、以及ALK重排与临床病理性特征之间的相关性并不那么完美,因此目前建议对所有进展期肺腺癌均应进行ALK检测而不必考虑年龄及是否吸烟。
ALK重排可通过FISH断裂探针、分子学或测序等进行检测,也可通过免疫组化进行检测。以往用于间变性大细胞淋巴瘤的ALK抗体用于NSCLC时敏感性不足,新型抗体D5F3、5A4相比FISH检测来说,敏感性和特异性均≥95%。
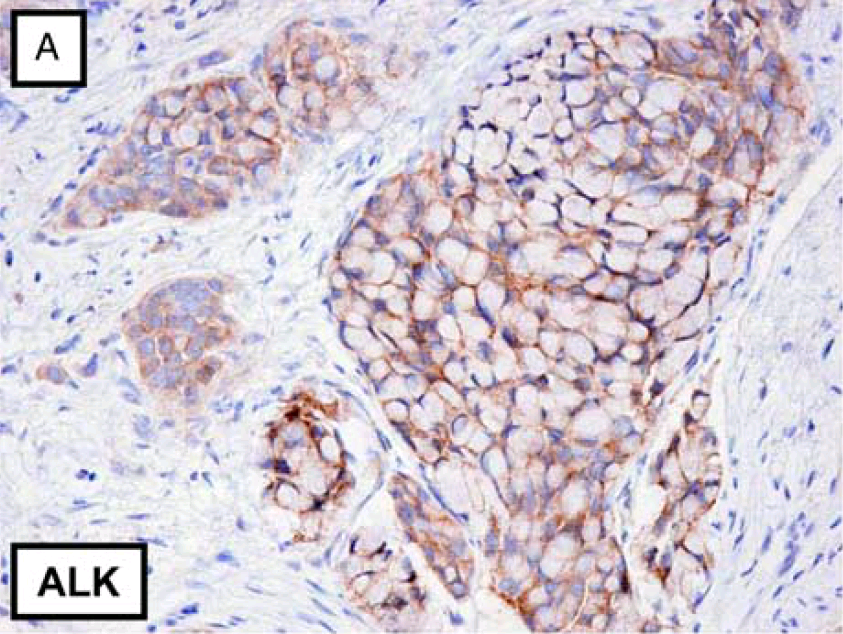 图3. 伴印戒样细胞特征的肺腺癌,ALK阳性;该例FISH检测证实存在ALK重排。
图3. 伴印戒样细胞特征的肺腺癌,ALK阳性;该例FISH检测证实存在ALK重排。
2. ROS1
ROS1重排最初研究是在胶质母细胞的细胞系中,肺腺癌中高达3%的会具有该重排。与ALK重排NSCLC患者相似,ROS1重排者也多为年轻、非吸烟患者,且几乎全部是腺癌;其组织学特点则为实性、黏液样、乳头状,伴印戒样细胞或程度不等的砂砾体样钙化。临床治疗二者也有相似,克唑替尼对于ROS1重排的NSCLC患者有效。目前该指标也和ALK、EGFR一样成为了进展期肺腺癌患者的必查指标,而不必考虑年龄等特征。
ROS1重排最常用检测方案为FISH,但也可通过其他分子学方法或免疫组化来检测。所用抗体克隆号为D4D6,相比其他检测方法来说敏感性可>95%;不过对于组织固定欠佳的病例免疫组化效果会降低。需要指出的是,免疫组化中因与ROS1融合的基因不同而染色结果也有所不同,CD74-ROS1融合者呈球状着色,EZR-ROS1融合者呈膜着色较强的方式。ROS1免疫组化的特异性在不同研究中有所差异,具体取决于其他参数和评分标准,甚至有研究中ROS1免疫组化阳性病例的数量是FISH阳性数量的8倍。目前,免疫组化检测ROS1用于进展期肺腺癌患者的筛查,阳性者需分子检测或细胞遗传学方法证实。当然,免疫组化阴性者目前认为可以可靠的排除ROS1重排,因此免疫组化还可用于FISH或分子检测方法的相互验证。
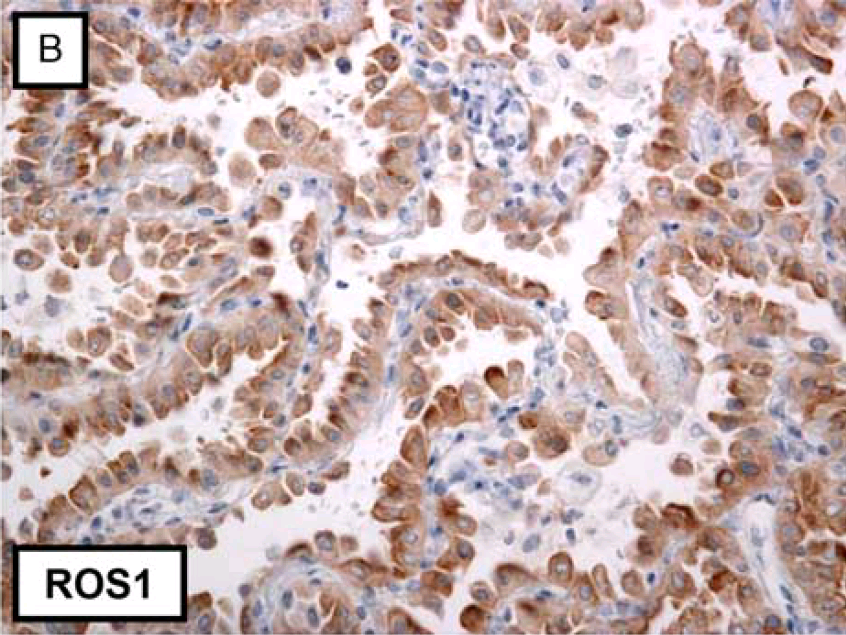 图4. 中分化、乳头状结构为主的肺腺癌中,ROS1阳性;该例经FISH检测证实有ROS1重排。
图4. 中分化、乳头状结构为主的肺腺癌中,ROS1阳性;该例经FISH检测证实有ROS1重排。
3. PD-1
PD-1/PD-L1通路的免疫检查点阻断已成为肿瘤领域的大热门。2018年已批准了下述免疫检查点抑制剂用于进展期NSCLC的治疗:纳武单抗(nivolumab,针对PD-1),帕博利珠单抗(pembrolizumab,针对PD-1),阿特珠单抗(atezolizumab,针对PD-L1),德瓦鲁单抗(durvalumab,针对PD-L1)。由于这类药物可引起免疫相关副作用,且只有部分患者获益,因此必须经生物标志物检测证实有治疗获益才可应用,尤其一线单药应用的情况下。除相关免疫组化结果外,其实检查点抑制治疗的效果还与遗传学驱动情况、突变负荷、是否吸烟、错配修复状态等情况有关。
尽管免疫组化检测PD-L1在预测免疫治疗效果方面仍不完美,但目前已进入临床及常规工作中。帕博利珠单抗用于进展期NSCLC的1期研究中将PD-L1肿瘤比例评分(tumor proportion score,TPS;指PD-L1膜阳性肿瘤细胞的比例)阈值设定为≥50%;但也有研究表明某些情况下PD-L1 TPS≥1%即可有获益。需要指出的是,目前帕博利珠单抗尚未批准一线用于EGFR突变、或ALK重排肿瘤,因为这类患者对免疫治疗无效。
当前实际工作中,EGFR野生型且ALK野生型进展期NSCLC患者需进行PD-L1免疫组化检测,以确定是否适合一线应用帕博丽珠单抗治疗,单药应用时TPS阈值需采取≥50%。非鳞的NSCLC联合治疗情况下则无需进行PD-L1检测。帕博丽珠单抗用于二线治疗时,免疫组化检测PD-L1的TPS阈值为≥1%。纳武单抗或阿特珠单抗则无PD-L1免疫组化检测的具体要求,但一般说来其效果与免疫组化中阳性表达的程度呈正比。早期可切除的NSCLC中,仅PD-L1免疫组化结果对于辅助化疗来说并无预后意义、也无预测意义;但最近的研究表明手术切除前新辅助应用纳武单抗的结果令人鼓舞,这提示早期可切除的NSCLC中PD-L1评估还是有一定价值。
实际工作中免疫组化评估PD-L1还是有一定挑战性:目前有多家商用平台,所用评分标准/阈值、抗体、检测平台等各不相同;评分的可重复性在不同组间、以及组内观察者之间也有差异。对帕博丽珠单抗来说,用克隆号为22C3的抗体(Dako公司产品)在安捷伦公司(Agilent Technologies,)的pharmDx平台检测;对纳武单抗、阿特珠单抗、德瓦鲁单抗来说,则分别用克隆号为28-8(Abcam公司产品)、SP142(Ventana公司产品)、SP263(Ventana公司产品)的抗体进行检测。还有些其他克隆的抗体如E1L3N(Cell Signaling Technology公司产品),虽然可能已有商用产品,但目前尚未用于治疗。
对于这些抗体来说,PD-L1免疫组化阳性均仅为膜着色。大部分检测中均仅评估肿瘤细胞的PD-L1结果,但阿特珠单抗用于进展期NSCLC时则对肿瘤细胞和免疫细胞均进行评估,最佳临床效果见于肿瘤细胞评分高(>50%)、或免疫细胞评分高(>10%)者。目前已有多机构研究正在对不同PD-L1抗体、不同检测平台、观察者一致性等问题进行评估。当然,NSCLC中PD-L1结果的差异可能还与肿瘤内异质性有关。
 图5. 肺低分化鳞状细胞癌,肿瘤细胞PD-L1免疫组化膜阳性,阳性细胞数量>95%。
图5. 肺低分化鳞状细胞癌,肿瘤细胞PD-L1免疫组化膜阳性,阳性细胞数量>95%。
4. EGFR
作为NSCLC中位于KRAS之后的第二常见癌基因,EGFR体细胞性突变在北美及欧洲患者中约占10-20%,且多见于非吸烟者及女性;在东亚人群,EGFR突变则见于约50%的肺腺癌患者。就NSCLC而言,EGFR突变几乎仅见于腺癌,且组织学上常为伴贴壁样、腺泡状、乳头状生长。具有EGFR突变的肺鳞癌其实最大可能是腺鳞癌、而腺癌成分并未取到。
肺癌中EGFR活性突变位于18-21号外显子的激酶区,90%以上的突变集中于21号外显子的L858R、19号外显子的ELREA模序移码缺失。具有肺癌家族史、或从不吸烟但却罹患多发肺腺癌者也曾报道有EGFR T790M种系突变。进展期肺腺癌一线治疗中,对EGFR突变治疗来说,EGFR酪氨酸激酶抑制剂治疗优于标准化疗,但EGFR野生型肿瘤则无此效果,因此治疗决策前进行EGFR评估意义显著。对于靶向治疗后由于EGFR T790M突变而病变进展的患者来说,不可逆性EGFR酪氨酸激酶抑制剂奥西替尼(osimertinib)有效。综合相关信息,目前建议对所有进展期肺腺癌患者均进行EGFR检测,而不必考虑患者年龄、种族及吸烟情况。
就相关患者的选择来说,应通过测序进行EGFR突变检测。针对EGFR全蛋白的免疫组化并不能预测患者酪氨酸激酶抑制剂治疗的预后,在治疗方案的选择上也无临床价值。针对L858R特异性突变的抗体(如Cell Signaling公司克隆号为43B2的产品、Ventana公司克隆号为SP125的产品),以及针对19号外显子E746-A750缺失的抗体(如Cell Signaling公司克隆号为6B6的产品、Ventana公司克隆号为SP111的产品)已进行了以分子检测为金标准的相关验证。这些抗体的临床表现不一,有研究表明其敏感性仅44%,而特异性为70%。EGFR 20号外显子插入所致原发耐药突变的肿瘤内已证实有免疫组化的假阳性。鉴于上述情况,以及可靠且高敏分子检测方法应用的增多,目前并不推荐EGFR突变特异性免疫组化检测作为治疗选择的手段;同时鉴于EGFR突变特异性免疫组化检测的阴性预测值较低,因此对于阴性结果者应通过分子学方法重新进行EGFR突变检测。
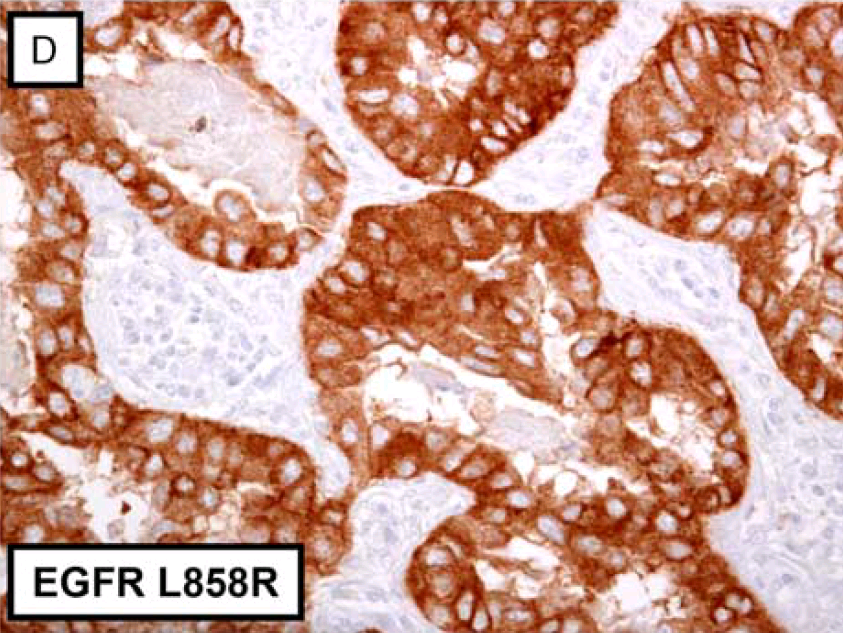 图6. 肺腺癌,针对EGFR L858R的免疫组化。
图6. 肺腺癌,针对EGFR L858R的免疫组化。
未完待续
点击下载英文文献
参考文献
Hung YP.Diagnostic and Predictive Immunohistochemistry for Non-Small Cell Lung Carcinomas[J].Advances in anatomic pathology,2018,25(6):374-386.
DOI:10.1097/PAP.0000000000000206





 图3. 伴印戒样细胞特征的肺腺癌,ALK阳性;该例FISH检测证实存在ALK重排。
图3. 伴印戒样细胞特征的肺腺癌,ALK阳性;该例FISH检测证实存在ALK重排。 图4. 中分化、乳头状结构为主的肺腺癌中,ROS1阳性;该例经FISH检测证实有ROS1重排。
图4. 中分化、乳头状结构为主的肺腺癌中,ROS1阳性;该例经FISH检测证实有ROS1重排。 图5. 肺低分化鳞状细胞癌,肿瘤细胞PD-L1免疫组化膜阳性,阳性细胞数量>95%。
图5. 肺低分化鳞状细胞癌,肿瘤细胞PD-L1免疫组化膜阳性,阳性细胞数量>95%。 图6. 肺腺癌,针对EGFR L858R的免疫组化。
图6. 肺腺癌,针对EGFR L858R的免疫组化。







共0条评论