郑宝文1,Marshall Austin2, 梁小曼1,李再波2,陈从德1,严姗姗1,赵澄泉2
Achieve Pathology and Laboratory Medicine 2015;139(3):373-377.
作者: 郑宝文1,Marshall Austin2, 梁小曼1,李再波2,陈从德1,严姗姗1,赵澄泉2
1 广州金域:2、 匹斯堡大学医学中心病理系
翻译:张和平1; 审校:梁小曼2, 赵澄泉3
1 安徽省妇幼医院病理科;2 广州金域;3 匹斯堡大学医学中心病理系
背景:运用Bethesda系统对中国人群宫颈细胞学检查的报告少见。
目的:分析2007-2012年间,中国最大的CAP认证的实验室中宫颈传统巴氏涂片和液基细胞学结果的Bethesda系统报告率。
设计:按照Bethesda系统对2007-2012年间广州金域细胞学诊断实验室1,394,389例宫颈细胞学(包括传统巴氏涂片和4种不同耗材的液基涂片)检查结果进行分析。
结果:本组宫颈传统巴氏涂片326,297例,液基涂片1,068,092例全部按照TBS系统报告结果。 其中液基涂片使用了4种不同的耗材,包括Thinprep(Hologic,Bedford,MA)928,884例, Surepath(BD Diagnostics,Franklin Lakes,New Jersey)63,465例, Liqui-Prep(LGM International,Melbourne,Florida)50,422例及Lituo(丽托生物科技公司,湖南,中国)50,422例。分析结果发现,在所有Bethesda系统类别中,异常结果(ASCUS及以上)报告率在液基细胞学中显著高于传统巴氏涂片(P<0.001)。除非典型腺细胞(AGC)和传统巴氏涂片不满意率(Unsatisfactory Rate)的报告率较低外,其他异常结果(ASCUS及以上)的报告率均在2006美国病理学家协会(CAP)的基准范围内。
结论:美国病理学家协会国际实验室认证项目(CAP LAP)能够为实验室提供很多其他国际组织所不能提供的质量标准。
宫颈癌是世界范围内女性第三大癌症,85%以上的宫颈癌发生于欠发达国家,这是因为那些地区比较缺乏资金和训练有素的人员进行规范的宫颈癌筛查 [1]。中国每年宫颈癌发病占世界宫颈癌发病的14%,特别是在一些农村地区,宫颈癌发生率很高(达81/10万),然而,筛查仍然未能广泛开展 [2]。据报道,中国女性的宫颈癌发生率为9.6/10万,但由于国家癌症登记中心欠完善,也没有全国性宫颈癌筛查项目以及缺乏宫颈细胞学质量控制的国家标准, 这一结果可能是被低估了的[3]。金域诊断(中国)是中国最大的全国连锁的独立病理医学实验室,其广州金域诊断是全国首家全部(包括解剖病理和临床病理)通过CAP认证的病理实验室[4],广州金域诊断同样通过了ISO15189国际标准组织认证。 虽然文献有一些关于中国子宫颈癌筛查的研究报告[5],但是如此大宗的细胞学异常分类报告的数据资料仍然有限,尤其是在中国,还有大量的未被筛查的人群,本文的数据更显珍贵。
材料和方法
本文为回顾性研究,收集了广州金域诊断细胞学实验室2007-2012年间所有宫颈巴氏细胞学检查结果资料。4种液基制备细胞学方法分别为:ThinPrep(Hologic,Bedford,MA)、SurePath(BD Diagnostics,Franklin Lakes,New Jersey)、Liqui-Prep(LGM International,Melbourne,Florida)及Lituo(丽托生物科技公司,湖南,中国)。作为液基细胞学低廉的替代品,传统巴氏涂片在2009年后也被该实验室应用。 本研究中所有液基涂片都在广州金域诊断细胞学实验室按照操作说明进行制作。Lituo液基涂片制作原理类似其他液基细胞学制片法,标本用乙醇为主的保存液固定,运用过滤法制片。广州金域诊断细胞室使用的是丽托生物科技公司的LTSYJ2000自动制片系统。传统巴氏涂片由临床医师各自收集和固定,然后发送到本实验室制片和阅片检查。使用何种宫颈细胞学的取样方法主要取决于临床医师。样本来自800多家当地医院、妇女健康中心、诊所及体检中心。90%以上的样本来自广东省。中国医院分三个等级,三级是大城市的大医院,二级是县级或小城市的中等医院,一级是乡村、郊区或小城市的医院,而金域诊断是一个独立的医学诊断实验室,不棣属于任何医院。虽然中国有全民的基本医疗保险,但由于各地区的地理、经济背景的多样性以及广东有大量的流动人口,使评估筛查人群的背景变得非常困难,更难以预测各类人群(城市、郊区或乡村)宫颈癌的发病风险。
所有宫颈巴氏细胞学检查结果均按照Besthesda系统(TBS) 2001版本的判读标准和术语进行报告[6]。实验室工作负荷标准、质量控制、细胞学-组织学对照都按照目前CAP实验室认证项目(CAP LAP)的条例进行。所有巴氏细胞学涂片都是由广州金域诊断细胞室的病理医师(约30人)进行筛查和判读;这些病理医师的执业范围均局限于妇科细胞学,其中大部分人是医学院校毕业后,再通过金域细胞学学校为期1年的细胞学课程的培训。 目前,在中国还没有全国系统性的细胞技师的培训项目或细胞病理学专科训练项目,据我们所知,金域细胞学学校是中国唯一相对完备的细胞学培训项目,其教学大纲参照已公开的美国细胞学学校课程,学生为金域诊断的员工。金域细胞学校的培训与美国的细胞学技师培训相类似,但不完全相同,因为所有学员为医学院校毕业的年轻职工。
统计学分析,细胞学异常率在不同方法之间的比较使用卡方检验,P<0.05为统计学显著差异。< p="">
结果
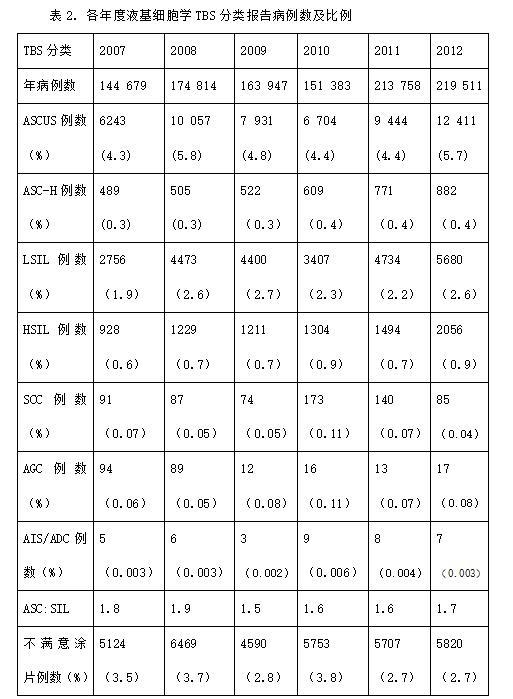
2007年1月1日至2012年12月30日6年间,广州金域诊断细胞室完成1,394,389例妇科宫颈细胞学检测,包括1,068,092例(平均年龄35.8岁,年龄范围14-100岁)液基细胞学样本(占76.6%),326,297例(平均年龄44.8岁,年龄范围16-104岁)传统巴氏涂片标本(占23.4%)。病例数在此期间逐年递增,2012年全年宫颈细胞学的病例数是2007年的2倍(337785/144679,增长了133%,见表1)。2007~2012年液基细胞学的TBS报告结果见表2。2009~2012年传统巴氏涂片的TBS报告结果见表3。 4种液基细胞学方法各自的TBS报告结果见表4。表5为液基细胞学和传统巴氏涂片TBS报告结果的比较。
从上面的表格可见,除了原位腺癌(AIS)、腺癌(ADC)两个类别之外, 在其他所有TBS类别中,液基细胞学的异常检出率都显著高于传统涂片的异常检出率(P<0.01)(表5)。高级别鳞状上皮内病变(HSIL)的检出率在ThinPrep、SurePath及Lituo是最高的(0.8-0.9%),而在Liqui-Prep(0.4%)和传统巴氏涂片(0.3%)则较低(表4和表5)。在此期间共报告鳞状细胞癌(SCC)666例,报告率最高的是ThinPrep(表4和表5)。综合高级别鳞状上皮内病变(HSIL)、原位腺癌(AIS)及癌这些临床最严重的细胞学异常类型,报告率最高的SurePath和ThinPrep(0.9%),接着是Lito(0.8%)、Liqui-Prep(0.5%)、传统巴氏涂片(0.3%)。非典型鳞状细胞--不除外高度鳞状上皮内病变(ASC-H)的报告率在各种液基细胞学方法之间相似(0.3%-0.4%)。非典型鳞状细胞--未明确意义(ASCUS)的报告率在Lito(7.0%)和SurePath(6.3%)最高,而在Thin-Prep(4.9%)、SurePath(3.8%)、传统涂片(2.3%)较低。低级别鳞状上皮内病变(LSIL)的报告率在SurePath最高达3.0%, 而在Lito为2.6%、 ThinPrep为2.4%、Liqui-Prep为1.5%、传统巴氏涂片为0.7%。不满意标本率(Unsatisfactory rate)在所有液基细胞学方法中以Lito(0.8%)和SurePath(1.4%)为最低,而在ThinPrep(3.2%)和Liqui-Prep(5.5%)较高; 然而传统巴氏涂片的不满意率小于0.1%。 非典型腺细胞(AGC)的报告率在液基细胞学和传统巴氏涂片的报告率均小于0.1%。非典型鳞状细胞与鳞状上皮内病变的比例(ASC:SIL)从ThinPrep的1.6到传统巴氏涂片的2.5不等, SurePath为1.7,Liqui-Prep为2.1,Lituo为2.2。总体上,广州金域诊断细胞室宫颈细胞学TBS分类的报告率,除了AGC和传统巴氏涂片的不满意率两个类别外,均符合CAP 2006调查的基准范围[7]。相信这得益于细胞学校培训项目的开展。
讨论
CAP在世界范围内认证了约7500家实验室, 美国之外实验室的认证越来越多[7]。CAP LAP的目的是通过培训、标准化设置、确保实验室达到或超过基本要求,以便提高病理和实验室服务的质量,进而提高对患者的安全保障[8]。由于世界上大部分国家对细胞学实验室缺乏详尽的、严格的规章标准,而CAP LAP为之提供了机会,使能利用CAP--这个世界上最广泛认证的病理学家组织--的经验、科学的专业建议及承诺,来提高实验室的服务质量。广州金域诊断就是为达到国际标准而寻求CAP认证和国际标准体系认证的。
CAP宫颈阴道细胞学标准的建立来源于美国1996-1997年间通过常规问卷调查所获得的数据,并在2003年和2008年进行过更新。这些周期性的更新与TBS 2001分类系统的广泛使用、从传统巴氏制片到液基细胞学制片方法的转变、计算机辅助诊断系统介入以及高危型HPV DNA的检测密切相关。尽管已有一些针对中国城市人群开展的筛查项目的报道,但是这一来源于中国最大的独立实验室的数据基本与2010年美国实验室使用传统巴氏涂片、ThinPrep和SurePath报告的结果相符[7]。这可能反应了金域诊断所服务的患者人群与美国CAP LAP实验室报道的大规模筛查人群有相似的特征。
与CAP的基准相比,本研究AGC的报告率较低。尽管在很多西方国家,相对于鳞状细胞癌的下降,宫颈腺癌的诊断比例增加了;但是在亚洲国家并没有太多的数据支持相似结论[9-10]。AGC低的报告率可能反映在中国宫颈腺癌的发生率较低,但此结果更提示中国的病理医生应对宫颈腺细胞病变的判断标准进行更多的学习探讨。
本研究中,传统巴氏涂片的不满意率的数据明显低于CAP的标准,这反映出实验室对临床医生的迁就。在服务自费病人时,临床医生会因病人担心额外收费而难于接受不满意的结果。更主要原因可能在于传统巴氏涂片来自政府组织的筛查项目,临床医生因为很难再次取材而不乐于接受不满意的结果;市场的竞争也促使实验室对巴氏涂片满意度的要求降低。为此,金域诊断制定了更多的针对临床的培训项目。
金域诊断的数据显示:与传统巴氏涂片相比,液基细胞学异常检出率明显增高,这与美国CAP LAP实验室[7]观察的结果及美国引入液基细胞学后的对比研究结果类似。[11-12]。尽管液基细胞学的优点在意大利和德国的临床实践中受到质疑[13-14],这可能是由于实验室对液基细胞学相对缺乏经验之故。但是英国国家卫生局(UK National Health System)在临床实践中进行了严密的质量控制,从而得出液基细胞学比传统巴氏涂片具有更佳表现的结论[15]。液基细胞学的优点在于采样器与传统的巴氏采样器相比更能富集细胞,并且对标本进行立即湿固定,有利于保持细胞的细节形态特征[16]。
本实验数据还提供了Lituo和Liqui-Prep这两个目前没有通过美国FDA认证、也没有在美国使用的液基细胞学方法的数据结果。价格低廉的中国Lituo液基细胞学方法因其有较高的异常检出率和较低的不满意率,具有一定的竞争力。来自金域诊断的宫颈细胞学-组织病理学随访数据和其他筛查方法同样很有意义,也是我们后续的研究课题。
本研究是目前中国最大的妇科细胞学检测数据的报道。这些数据可能有利于建立一个中国的宫颈细胞学检测标准,进而促进中国宫颈癌筛查的进步。鳞状细胞癌在本研究中的发生率为48/10万,这说明宫颈癌在中国的发生率可能高于预期。由于目前中国没有规范的细胞学技师培训项目,金域诊断在病理医师妇科细胞学上的专业培训和执业经验值得推广。基于CAP LAP的国家标准和质量控制也值得更广泛应用。最近另一家中国的实验室也报道了加入了CAP的实验室能力验证是达到卫生部门所要求的病理实验室室间质评的有效方法[17]。





参考文献:
1.Ferlang J, Shin HR, Forman D, et al. Estimates of the worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010; 127(12): 2893-2917.
2.Shi JF, Qiao YL, Pretroius R, et al. Epidemiology and prevention of human papillomavirus and cervical cancer in China and Mongolia. Vaccine 2008; 26 (suppl 12): M53-M59.
3.Li J, Kang LN, Qiao YL. Review of the cervical cancer disease burden in mainland China. Asian Pac J Cancer Prev 2011; 12(5): 1149-1153.
4.Pan QJ, Hu SY, Zhang X, et al. Pooled analysis of the performance of liquid-based cytology in population-based cervical cancer screening studies in China. Cancer Cytopathol 2013; 121(9): 473-482.
5.Khetarpal S, Kamis S. Tracing the rise of KingMed and its future route: a correspondence with Hongbo Li. Asia-Pacifac Biotech News 2012; 16(6): 20-38.
6.Solomon D, Davey D, Kurman R, et al. The 2001 Bethesda System: terminology for reporting results of cervical cytology. JAMA 2002; 287(16):2114-2119.
7.Eversole GM, Moriarty AT, Schwartz MR, et al. Practices of participants in the College of American Pathologists Interlaboratory Comparison Program in cervicovaginal cytology, 2006. Arch Pathol Lab Med 2010; 134(3): 331-335.
8.Allen TC, Hammond MEH, Robboy SJ. Quality and the College of American Pathologists. Arch Path Lab Med 2011; 135(11): 1441.
9. International Collaboration of Epidemiological Studies of Cervical Cancer. Comparison of risk factors for invasive squamous cell carcinoma and adenocarcinoma of the cervix: collaborative reanalysis of individual data on 8,097 women with squamous cell carcinoma and 1,374 women with adenocarcinoma from 12 epidemiological studies. Int J Cancer 2006;120(4):885-891.
10.Vizcaino AP, Moreno V, Bosch FX, et al. International trends in the incidence of cervical cancer, I: adenocarcinoma and adenosquamous cell carcinomas. Int J Cancer 1998; 75(4):536- 545.
11.Berstein SJ, Sanchez-Ramos L, Ndubisi B. Liquid-based cervical cytologic smear study and conventional Papanicolaou smears: a metaanalysis of prospective studies comparing cytologic diagnosis and sample adequacy. Am J Obstet Gynecol 2001;185(2):308–17.
12.Nance KV. Evolution of Pap testing at a community hospital—a ten year experience. Diagn Cytopathol. 2007; 35(3): 148–153.
13.Ronco G, Cuzick J, Pierotti P, et al. Accuracy of liquid based versus conventional cytology: overall results of new technologies for cervical cancer screening: randomised controlled trial. BMJ. 2007;335(7609):28. doi:10.1136/ bmj.39196.740995.BE.
14.Siebers AG,Klinkhamer PJ, Grefte JM, et al. Comparison of liquid-based cytology with conventional cytology for detection of cervical cancer precursors: a randomized controlled trial. JAMA.2009; 302(16):1757–1764.
15.Kitchener HC, Almonte M, Gilham C, et al. ARTISTIC: a randomised trial of human papillomavirus (HPV) testing in primary cervical screening. Health Technol Assess 2009; 13(51):1–150.
16.Hutchinson ML, Isenstein LM, Goodman AK, et al. Homogeneous sampling accounts for the increased diagnostic accuracy using the ThinPrep processor. Am J Clin Pathol. 1994; 101(2):215–219.
17.Liu X, Dai Q, Jiang Y. Proficiency Testing Experience With College of American Pathologists’ Programs at a University Hospital in China From 2007 to 2011. Arch Pathol Lab Med 2014; 138(1):114-120.
文章原标题:来自CAP认证的中国最大独立医学实验室--广州金域诊断的1,394,389例宫颈细胞学Bethesda系统报告结果分析



















共0条评论