[导读] 编译整理:强子
简介
临床病理诊断工作中,绝大部分病例都会有某些倾向性。比如,经尿道前列腺切除标本大部分为前列腺增生,比如胃肠道恶性肿瘤大部分为腺癌。与此类似,子宫颈处恶性肿瘤以鳞癌为最多见,而如果遇到鳞状细胞分化的涎腺恶性肿瘤则应首先排除皮肤或黏膜原发鳞癌的转移或直接播散、并排除其他伴鳞状分化的涎腺恶性肿瘤之后才可以诊断涎腺原发鳞癌。
美国克利夫兰医学中心病理专家Dababneh等人曾在《Histopathology》杂志发表文章,报道了6例伴鳞状分化的涎腺导管癌病例。了解相关特点,有助于我们临床病理诊断工作中避免误诊误判,因此我们将该文要点编译介绍如下。
研究内容及结果
该组6个病例来自两个研究机构2009年至2023年存档病例的回顾性分析。其中男性5例,女性1例,年龄38-75岁不等,年龄中位数63岁。发病部位涉及腮腺(5例)即下颌下腺(1例),肿瘤大小1.8cm至6.3cm不等。
病变切除后,所有病例均可见高级别组织学形态,具体表现为核分裂活性增高(平均18个/2mm2)、肿瘤坏死(占比5-65%不等)、神经周围浸润、脉管浸润。有1例为发生于原有多形性腺瘤的情况下。4例切缘阳性。5例做了淋巴结清扫的病例均存在淋巴结转移,转移淋巴结的数量1-6枚不等。
3例有随访数据:1例确诊1月后发现肺转移,进一步药物治疗,术后6个月时死亡;其余2例进行放疗,1例同时进行了卡铂化疗,这两例在41个月和102个月时均未见复发表现。
该组病例组织学上有数量不等的典型涎腺导管癌成分、类似鳞状细胞癌的鳞状分化区域、偶见肉瘤样/梭形细胞成分。典型涎腺导管癌成分是指增生的高级别腺样成分呈浸润性生长、偶见筛状结构,瘤细胞胞质致密嗜酸性,管腔内有断头分泌表现,细胞核圆形,有显著核仁。所有病例中都存在这一特征,只是所占比例不一,具体从不足5%、到90%。
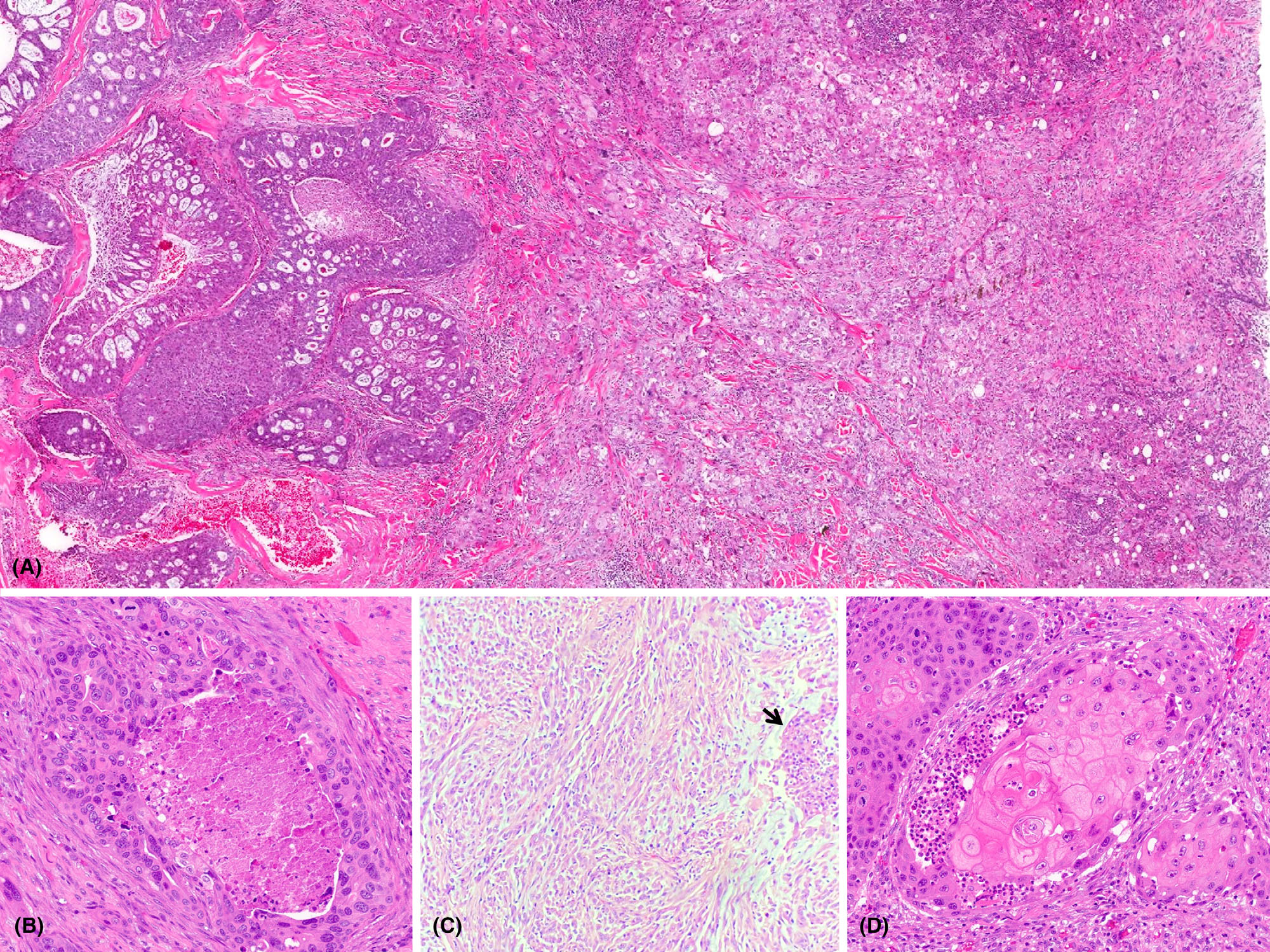 图1.(A)涎腺导管癌,可见典型的筛状形态(左)、相邻有低分化鳞癌区域和局灶肉瘤样成分(右)。(B)经典的涎腺导管癌成分,图示大汗腺导管分化、粉刺状坏死且常见核分裂;(C)肉瘤样成分,为非典型梭形细胞增生,背景为黏液样间质(箭头示局灶鳞状成分);(D)鳞状分化中的角化表现。
图1.(A)涎腺导管癌,可见典型的筛状形态(左)、相邻有低分化鳞癌区域和局灶肉瘤样成分(右)。(B)经典的涎腺导管癌成分,图示大汗腺导管分化、粉刺状坏死且常见核分裂;(C)肉瘤样成分,为非典型梭形细胞增生,背景为黏液样间质(箭头示局灶鳞状成分);(D)鳞状分化中的角化表现。
所有病例均有鳞状细胞癌样的区域,具体表现为有黏附性的细胞巢,鳞状分化则体现在胞质内角化、细胞间桥、和/或角化珠形成。鳞状分化所占比例不一,具体为10%至95%。有3例鳞状分化为主(>75%)。有3例可见表现为高级别梭形细胞增生而并无异源性成分的肉瘤样分化,具体占比10%至60%不等。淋巴结切片可供复阅者有4例,其中2例可见伴广泛鳞状分化的转移灶,1例主要为鳞状分化。
 图2.(A)淋巴结内的转移性涎腺导管癌,同时有典型的导管癌成分(左)和实性/鳞状成分(右);(B)转移性涎腺导管癌也可为广泛鳞状分化。
图2.(A)淋巴结内的转移性涎腺导管癌,同时有典型的导管癌成分(左)和实性/鳞状成分(右);(B)转移性涎腺导管癌也可为广泛鳞状分化。
免疫组化方面,不同的肿瘤成分表达不一。正如预期所料,所有病例中的涎腺导管癌成分均阳性表达AR、CAM5.2或CK7,而鳞状分化成分弥漫阳性表达鳞状标记/基底细胞标记,如CK5/6、p63、和/或p40。此外,鳞状标记/基底细胞标记还可显示出涎腺原位导管增生周围的肌上皮细胞。鳞状成分中未见肌上皮细胞,但未做其他肌上皮标记,如SMA。
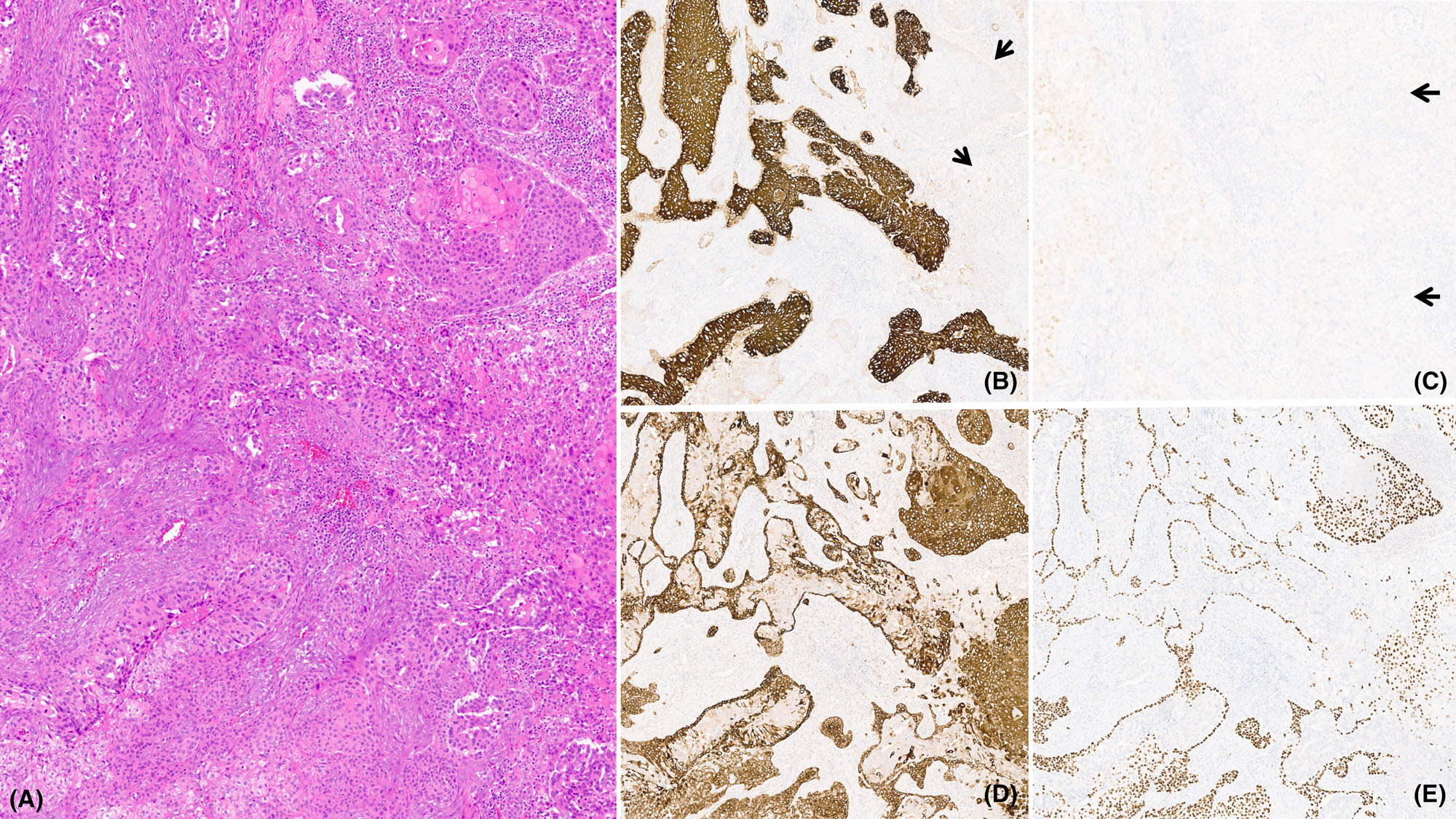 图3.(A)涎腺导管癌伴鳞状分化的形态学表现。免疫组化CK7(B)和AR(C)仅在导管成分阳性表达,鳞状成分(箭头所示)并不表达CK7和AR;CK5/6(D)和p63(E)则表达于鳞状上皮成分以及“原位”癌中的基底细胞。
图3.(A)涎腺导管癌伴鳞状分化的形态学表现。免疫组化CK7(B)和AR(C)仅在导管成分阳性表达,鳞状成分(箭头所示)并不表达CK7和AR;CK5/6(D)和p63(E)则表达于鳞状上皮成分以及“原位”癌中的基底细胞。
需要注意的是,有4个病例中的鳞状分化成分完全不表达大汗腺导管免疫表型,仅有2例在鳞状成分中仍有AR表达。3例的鳞状成分程度不等的表达CK7。肉瘤样成分也均不必表达C、或不确定的表达CK及AR;且有1例p63呈弱阳性。
 图4.(A)涎腺导管癌伴广泛鳞状分化,插图示局灶的经典形态;免疫组化AR(B)及CK7(C)显示鳞状成分中也有表达。
图4.(A)涎腺导管癌伴广泛鳞状分化,插图示局灶的经典形态;免疫组化AR(B)及CK7(C)显示鳞状成分中也有表达。
小结
涎腺导管癌罕见情况下可有鳞状分化,会影响我们准确诊断、并可能因此而考虑原发或转移的鳞状细胞癌。这种情况下的鳞状分化可以非常广泛、仅有少许经典涎腺导管癌成分,且转移灶中可仅为鳞状成分。鳞状分化成分中,免疫组化AR一般并不表达,此时更是会类似鳞状细胞癌。该组肿瘤总体级别较高,病理分期高,且常伴有肉瘤样成分。
点此下载原文献
参考文献
Dababneh MN, Griffith CC, Magliocca KR, Stojanov IJ. Salivary duct carcinoma with squamous differentiation: histomorphological and immunophenotypical analysis of six cases. Histopathology. 2024;85(4):590-597.
doi:10.1111/his.15217

















共0条评论