[导读] 作者:刘争进
【病史简介】
患者,女,54岁,“以大便形状及习惯改变约8月余。”于2022年6月入院。
外院胃肠镜活检病理报告: 胃:低分化腺癌(伴印戒细胞癌);肠:低分化腺癌。外院免疫组化:CK7(+),CK20(-),Villin(-),CDX2(-),CK19(+),CK-P(+),Her2(胃2+,直肠1+),Ki-67(5%+)。
患者拟在我院胃肠外科做手术,术前请病理科会诊。
外院会诊病理切片【镜下表现】
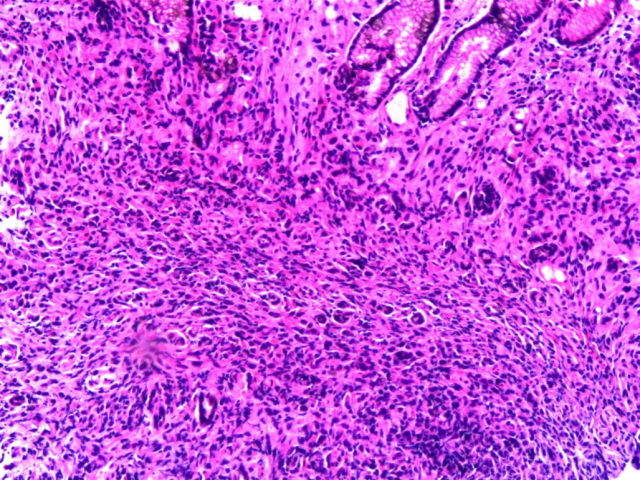
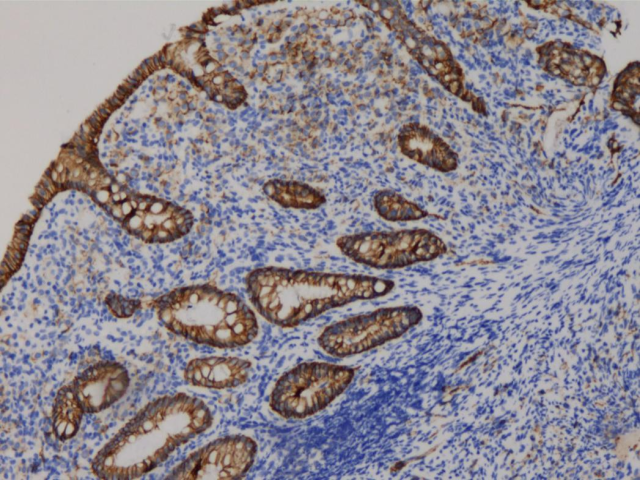
胃镜HE切片:黏膜固有层内见松散分布的异型上皮样细胞。

肠镜HE切片:黏膜固有层内见异型上皮样细胞。异型细胞与背景肠粘膜腺体略显突兀,背景肠粘膜无明显不典型增生。异型细胞较松散,胞浆红,没有明确“腺样”组织学构象。
外院的病理诊断有问题吗?黏膜内异型细胞上皮标记阳性,低分化癌明确,但有很多疑点:
疑点1:异型细胞与背景粘膜腺体略显突兀,背景粘膜腺体无明显不典型增生;异型细胞较松散,胞浆红,没有明确“腺样”组织学构象。
疑点2:胃、肠双原发癌极为罕见,有无可能胃癌肠转移/肠癌胃转移/其他部位癌转移胃肠道转移?
疑点3:为何胃、肠两处癌免疫表型一致?且均CK7(+)、CK20(-),均提示前肠来源,Villin(-),CDX2(-)又不支持胃肠道原发?
疑点4:内镜图片(未展示)示黏膜尚平坦,未见明确肿物或溃疡。固有层出现癌细胞,癌组织似乎从下而上,而不是从上而下。
能否排除胃肠道被转移?
赶快查病史及影像学,期待能够获取能多信息。病史提示患者2016年在我院做右乳腺穿刺,穿刺病理提示:浸润性导管癌,2级;新辅助化疗后,2017年行乳腺根治切除,病理提示Miller-Payne分级4级。淋巴结未见癌转移。本次(2022年)入院后影像学提示胃、肠局部粘膜下略增厚,余脏器均未见明显占位。
综上,乳腺癌胃、肠转移必须进一步排除!
调取原右乳腺穿刺病理切片,同时会诊的胃、肠活检标本加做免疫组化:
2016年右乳腺穿刺HE切片:
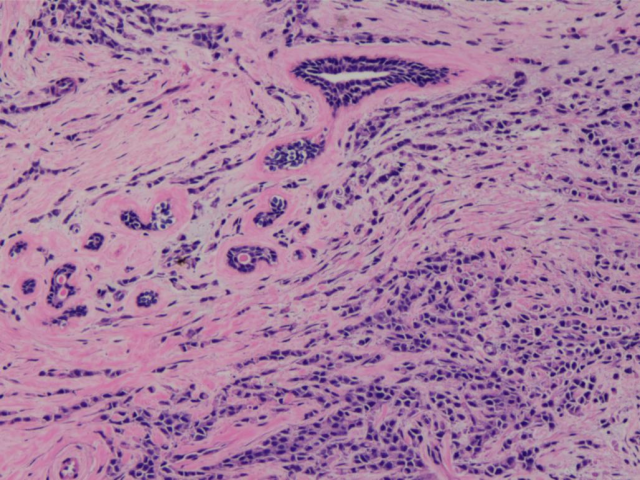
2016年右乳腺穿刺HE切片(1):
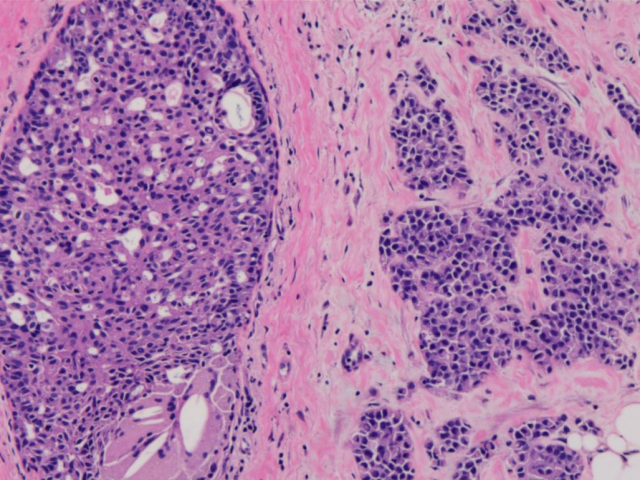
2016年右乳腺穿刺HE切片(2):
免疫组化ER、PR、E-cad、CK-H均(+),P120(膜+),CK5/6(弱+),HER2(1+),Ki-67约6%。
外院会诊的胃、肠活检标本加做免疫组化:
胃:
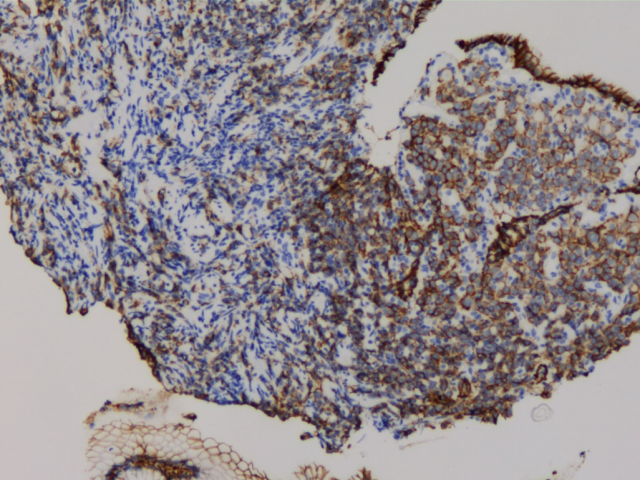
E-Cad(+)
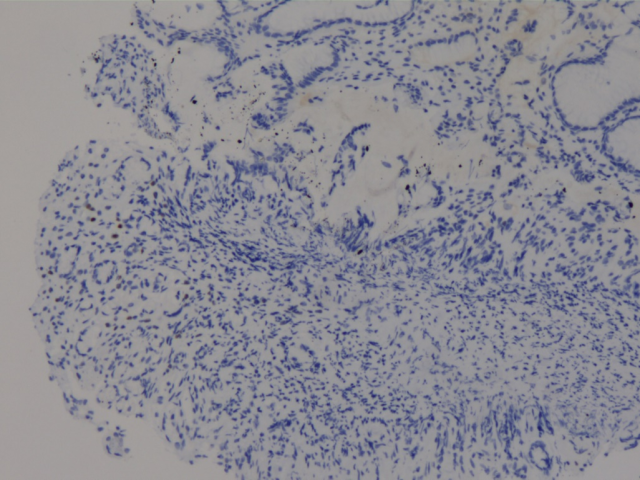
ER(少量细胞+)
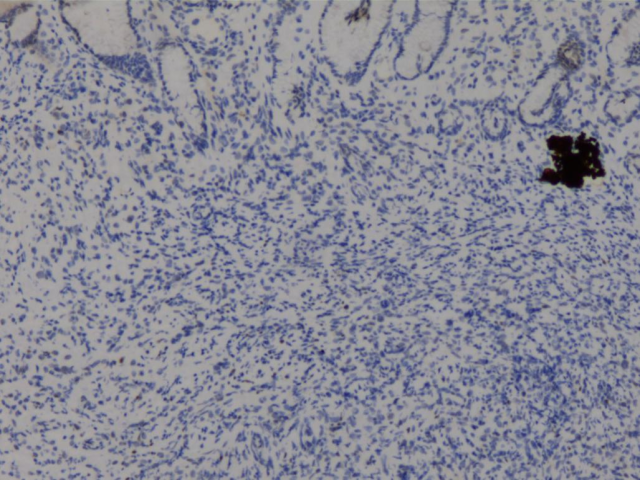
PR(少量细胞+)
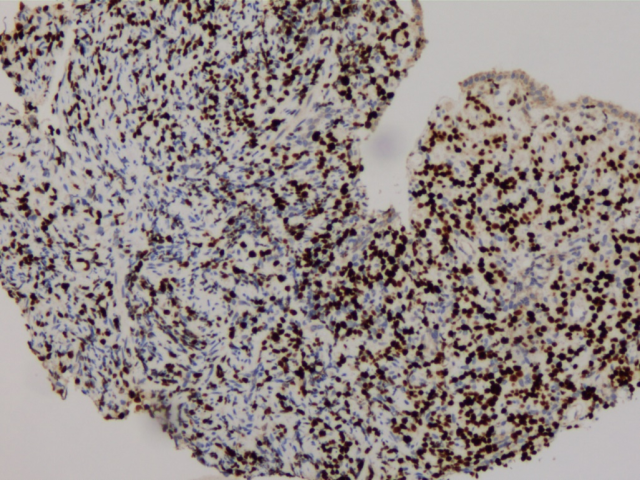
GATA3(+)
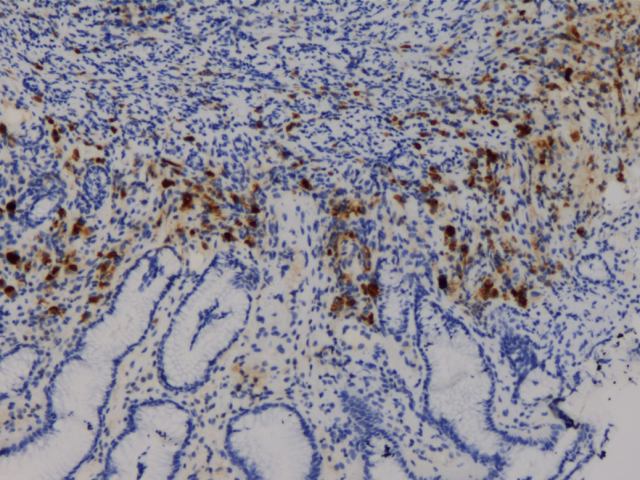
GCDFP-15(+)
肠:
E-Cad(+)
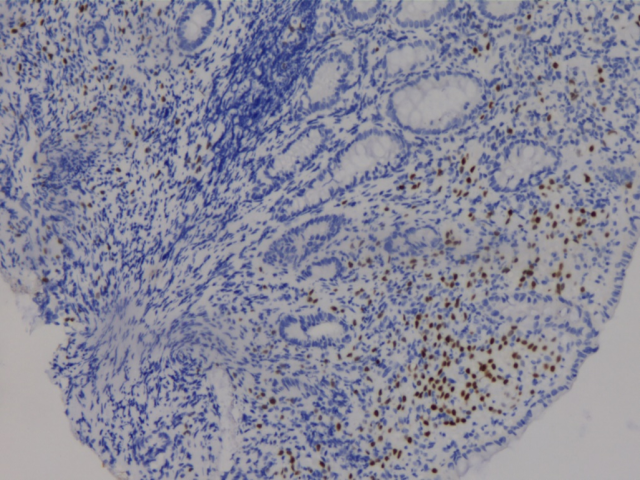
ER(少量细胞+)
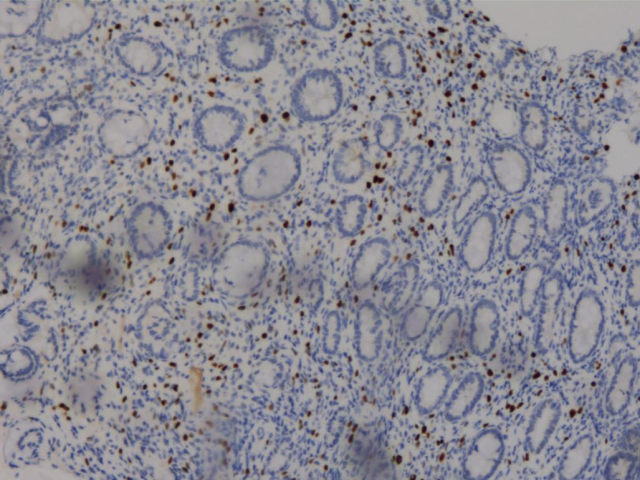
PR(少量细胞+)
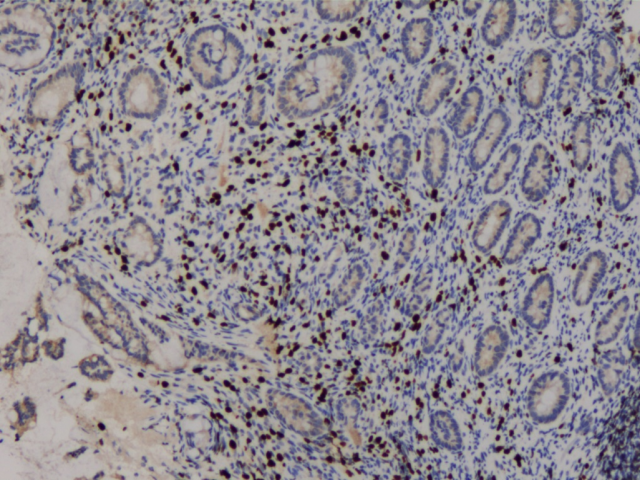
GATA3(+)
GCDFP-15(+)
【免疫组化汇总】
胃、肠外院免疫组化:CK7(+),CK20(-),Villin(-),CDX2(-),CK19(+),CK-P(+),Her2(胃2+,直肠1+),Ki-67(5%+)。
胃、肠活检标本本院加做免疫组化:E-Cad(+),ER(胃内肿瘤细胞约3%+,直肠内肿瘤细胞约30%+),PR(胃内肿瘤细胞约3%+,直肠内肿瘤细胞约40%+),Her-2(胃内肿瘤细胞2+,直肠内肿瘤细胞1+),GCDFP-15(+),GATA3(+),其余SYN(-),CgA(-),CD56(部分细胞弱+),S-100(-),CDX2(-),SATB2(-)。
形态学,胃、肠黏膜内癌组织与乳腺癌类似(细胞松散,胞浆红);免疫组化支持胃、肠黏膜内癌组织为乳腺来源,不支持胃肠道原发;病史、内镜亦均提示转移可能。
【最终诊断】
(胃窦、直肠)粘膜内均见少量上皮样细胞,结合形态学、临床病史及免疫组化,符合乳腺癌转移。
【讨论】
作为一位诊断病理医生,临床病史极为重要,尤其在发病部位、形态学、免疫组化不好解释的时候,更要仔细了解病史、临床表现、病程发展过程、影像学、检验学指标等,通过综合这些信息,进一步完善、扩展诊断思路。
如这例,胃、肠同时出现癌不好解释,太为罕见;胃、肠背景黏膜无不典型增生到癌变的过程;组织学无明确腺样特点;细胞散而胞浆红,不像一般胃肠道癌的特点;免疫组化不支持胃肠原发;内镜表面异常不明显,等等。出现单一的少见情况有可能的,但多种少见、罕见情况在一个患者出现,大概率诊断是有问题的。
一、原发还是转移癌?
乳腺癌血行转移最常见的部位一般有肝、肺、骨、脑等,胃肠转移罕见,胃、肠黏膜内癌组织形态学与2016年乳腺癌类似(细胞松散,胞浆红);免疫组化CK-P、ER、PR、GCDFP-15、GATA3、CK7阳性支持乳腺来源,Villin、CDX2、SATB2不支持胃肠原发。再结合临床病史、内镜所见,乳腺癌转移诊断明确。
二、组织学类型是导管癌还是小叶癌?抑或混合性导管-小叶癌?
癌细胞松散,非黏附性细胞生长,尤其原发癌列兵状排列,细胞小而一致,形态像浸润性小叶癌,但一些导管癌(尤其是组织固定不佳时细胞出现欺骗性的非黏附性外观),鉴别较困难。免疫组化对鉴别的帮助:Ecadherin(钙粘素)在小叶癌中总是缺失的,在导管癌中表达(虽然有时较弱),E-cadherin缺失 (缘于该基因突变) 是乳腺小叶癌的特征。弥漫性胞浆P120染色是小叶肿瘤的阳性标记。相比之下,导管肿瘤保留了P120膜染色的主要特征, 反映出正常的E-cadherin复合物组成。但有15%的浸润性小叶癌表达E-cadherin,因此不能单依靠阳性染色区别之。多取材,仔细观察切片有帮助,如看到经典导管内癌区域或小叶瘤变区域,可提示来自导管或小叶上皮。
有回顾性研究表明,相对于浸润性导管癌,小叶癌更易发生转移,小叶癌患者的总生存率低。
【感想】
病理诊断陷阱无处不在,尤其小活检尤要小心,以免不精确的诊断,给患者造成过度治疗。
参考文献
[1]Breast cancer metastatic to the gastrointestinal tract. Oncol Rep. 1996 May;3(3):589-91. doi: 10.3892/or.3.3.589. PMID: 21594419.
[2]Metastatic breast cancer to the gastrointestinal tract: a case series and review of the literature. World J Gastroenterol. 2006 Oct 14;12(38):6219-24. doi: 10.3748/wjg.v12.i38.6219. PMID: 17036400; PMCID: PMC4088122.



























共0条评论